АРЕКОЛИНА ГИДРОБРОМИД Ареколин бромистоводородный
ARECOLINUM HYDROBROMICUM Arecolini hydrobromidum
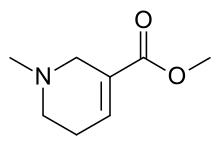
Гидробромид метилового эфира метил-1,2,5,6- тетрагидроникотиновой кислоты
Свойства: белый кристаллический порошок без запаха. Препарат содержит 99,4% ареколина. Легко растворяется в воде (1 : 0,5); растворяется в спирте (1 : 10) и хлороформе. Практически не растворяется в эфире. Водные растворы нейтральной или едва заметно кислой реакции. Можно стерилизовать при 100°, в течение 30 минут.
Несовместим с сулемой, раствором йода, а также с солями серебра и свинца. В щелочной среде легко гидролизуется.
Форма выпуска: порошок.
Хранение: под замком (список А), в хорошо закупоренных банках темного стекла.
Действие: оказывает активизирующее действие на клетки холинергической иннервации, сходное с карбахолином. Усиливает секрецию желез органов пищеварения, усиливает моторную функцию кщнечиика, вызывает спазм желудка и особенно кишечника (при переполнении которого возможен разрыв), сужение зрачка.
Обладает сильным антигельминтным действием в отношении ленточных гельминтов собак и птиц.
Противопоказания: при сердечной слабости, большом скоплении пищевых и каловых масс, безоарах п конкрементах.
Показания, способ применения и дозы: как слабительное средство при запорах у лошадей и травоядных животных. В форме водного раствора препарат вводят подкожно в два приема с интервалом в 30 минут.
В качестве средства, способствующего рассасыванию экссудатов и транссудатов, при ревматическом воспалении копыт и остром отеке головного мозга в форме раствора подкожно.
Как миотическое средство для сужения зрачка в форме 0,1 — 1%-ного раствора. Действие длится от 20 минут до 1 часа.
Как аптигельминтное средство внутрь: при дипилидиозе собак после 16-18 часов голодной диеты в форме раствора или порошка с мясным фаршем. Для предотвращения рвоты за 15-20 минут до введения ареколина задают внутрь 1 каплю настойки йода в 1 ложке воды. Действие проявляется через 1-1,5 часа.
При цестодозах гусей и кур, при дрепанидотениозе и гпменолепидозе уток в форме водного раствора 1 : 1000. Действие проявляется через 12-15 минут.
Под кошу Внутрь
Лошадям 0,02-0,05
Крупному рогатому скоту 0,03-0,06
Мелкому рогатому скоту . 0,01-0,04
Свиньям 0,01-0,04
Собакам 0,001-0,005 0,02-0,03
Уткам — 0,002-0,004
Гусям — 0,003-0,006
Курам 0,001-0,002 0,003-0,005
Действие ареколпна снимается атропином, введенным подкожно.
|
← АПОМОРФИНА ГИДРОХЛОРИД |
АТРОПИНА СУЛЬФАТ → |
|---|
Похожий материал по теме:
-

СРОКИ ХРАНЕНИЯ ФАРМАКОПЕЙНЫХ ПРЕПАРАТОВ И ЛЕКАРСТВЕННОГО СЫРЬЯ(Утверждены Министерством здравоохранения СССР)
ОБЩИЕ … -

ЮГЛОН JUGLONUM
5-окси-1,4 нафтахинонСвойства: кристаллический порошок желтовато-оранжевого цвета. Растворяется …
-

ЭФИР ДЛЯ НАРКОЗА AETHER PRO NARCOS AETHER ANAESTHESICURS PH. I
Получается при перегонке смеси винного спирта и с…
-

ЭФЕДРИНА ГИДРОХЛОРИД EPHEDRINUM HYDROCHLORICUM
Ephedrini hydrochloridum Эфедрин хлористоводородный Гидрохлорид 1-1 … -

ЭТИЛОВЫЙ АЛКОГОЛЬ СПИРТ, ВИННЫЙ СПИРТ, ЭТИЛОВЫЙ СПИРТ SPIRIT
Свойства: прозрачная бесцветная летучая легко воспл…
From Wikipedia, the free encyclopedia
 |
|
 |
|
| Clinical data | |
|---|---|
| Other names | Arecaline; Arecholine; Arecolin; Arecoline base; Arekolin; Methylarecaidin |
| ATC code |
|
| Legal status | |
| Legal status |
|
| Identifiers | |
|
IUPAC name
|
|
| CAS Number |
|
| PubChem CID |
|
| IUPHAR/BPS |
|
| DrugBank |
|
| ChemSpider |
|
| UNII |
|
| KEGG |
|
| ChEBI |
|
| ChEMBL |
|
| CompTox Dashboard (EPA) |
|
| ECHA InfoCard | 100.000.514 |
| Chemical and physical data | |
| Formula | C8H13NO2 |
| Molar mass | 155.197 g·mol−1 |
| 3D model (JSmol) |
|
| Density | 1.0495 g/cm3 |
| Melting point | 27 °C (81 °F) |
| Boiling point | 209 °C (408 °F) |
|
SMILES
|
|
|
InChI
|
|
| |
Arecoline () is a nicotinic acid-based mild parasympathomimetic stimulant alkaloid found in the areca nut, the fruit of the areca palm (Areca catechu).[2] It is an odourless oily liquid. It can bring a sense of enhanced alertness and energy, euphoria and relaxation. Its psychoactive effects are comparable to that of nicotine.
Chemistry[edit]
Arecoline is a base, and its conjugate acid has a pKa ~ 6.8.[3]
Arecoline is volatile in steam, miscible with most organic solvents and water, but extractable from water by ether in presence of dissolved salts. Being basic, arecoline forms salts with acids. The salts are crystalline, but usually deliquescent: the hydrochloride, arecoline•HCl, forms needles, m.p. 158 °C;[3] the hydrobromide, arecoline•HBr, forms slender prisms, mp. 177–179 °C from hot alcohol; the aurichloride, arecoline•HAuCl4, is an oil, but the platinichloride, arecoline2•H2PtCl6, mp. 176 °C, crystallizes from water in orange-red rhombohedrons. The methiodide forms glancing prisms, mp. 173-174 °C.
Pharmacology[edit]
Arecoline is the primary active ingredient responsible for the central nervous system effects of the areca nut. Arecoline has been compared to nicotine; however, nicotine agonizes nicotinic acetylcholine receptors, whereas arecoline is primarily a partial agonist of muscarinic acetylcholine receptors,[4][5] leading to its parasympathetic effects. In frogs, arecoline also acts as an antagonist (or very weak partial agonist) at α4 and α6-containing nicotinic acetylcholine receptors and as a silent antagonist at α7 nicotinic receptors, which may account for its anti-inflammatory activity.[6] Arecoline also inhibits AMPK through generation of ROS in several types of cells.[7]
Nervous system[edit]
Arecoline promotes excitation and decreases sleeping time. It also enhances learning and memory. Intraperitoneal administration of arecoline decreases locomotor activity dose-dependently. Arecoline reversed scopolamine induced memory loss. It could also decrease symptoms of depression and schizophrenia [8]
Cardiovascular system[edit]
AN (Areca Nut) is a vasodilator mainly due to the presence of arecoline. It also has anti-thrombosis and anti-atherogenic effects by increasing plasma nitric oxide, eNos, and mRNA expression and decreasing IL-8 along with other downregulations.[8]
Endocrine system[edit]
It increases the level of testosterone by stimulating Leydig’s cells as well as levels of FSH and LH.[9][10] It also activates HPA axis and stimulates CRH release. It prevents the dysfunction of B cells of the pancreas from high fructose intake.[8]
Digestive system[edit]
Arecoline has the ability to stimulate the digestive system through the activation of muscarinic receptors. Areca nut water extract could increase the contractions of gastric smooth muscle and muscle strips of the duodenum, ileum, and colon significantly. This activity could be caused by arecoline.[8]
Pharmacokinetic[edit]
Arecoline is metabolized by both kidneys and liver.[11] Currently, 11 metabolites of arecoline are documented among which N-methylnipecotic acid was found to be a major metabolite of both arecoline and arecaidine.[12] Lime is said to hydrolyse almost all arecoline to arecaidine, a GABA reuptake inhibitor.[13] Arecaidine is also formed during liver metabolism of arecoline in rats.[12]
Uses[edit]
Owing to its muscarinic and nicotinic agonist properties, arecoline has shown improvement in the learning ability of healthy volunteers. Since one of the hallmarks of Alzheimer’s disease is a cognitive decline, arecoline was suggested as a treatment to slow down this process and arecoline administered intravenously did indeed show modest verbal and spatial memory improvement in Alzheimer’s patients, though due to arecoline’s possible carcinogenic properties,[14] it is not the first drug of choice for this degenerative disease.[15] In many Asian cultures, the areca nut is chewed along with betel leaf to obtain a stimulating effect.[16]
Arecoline has also been used medicinally as an antihelmintic (a drug against parasitic worms).[17]
Arecoline has also been shown to increase testosterone in rats, in low doses.
[9]
Toxicity[edit]
LD50: 100 mg/kg, administered subcutaneously in mouse.[3] Also, the minimum lethal dose (MLD) values of arecoline in mice, dog and horse is 100 mg/kg, 5 mg/kg and 1.4 mg/kg respectively. It causes Oral Submucous Fibrosis by stimulating collagen, interleukin 6, keratinocyte growth factor-1, IGF-1, cystatin C, tissue inhibitor of matrix metalloproteinases in the mouth.
Current science is confident that areca nut chewing is carcinogenic. Research suggests this is probably at least partly because of arecoline itself, although it could also be from the other constituents of the nut as well, some of which are precursors to nitrosamines that form in the mouth during chewing. Section 5.5 Evaluation on page 238 of IARC Monograph 85-6 states the following:[18]
- […]
- There is sufficient evidence in humans for the carcinogenicity of betel quid without tobacco. Betel quid without tobacco causes oral cancer.
- There is sufficient evidence in experimental animals for the carcinogenicity of betel quid without tobacco.
- There is sufficient evidence in experimental animals for the carcinogenicity of betel quid with tobacco.
- There is sufficient evidence in experimental animals for the carcinogenicity of areca nut.
- There is sufficient evidence in experimental animals for the carcinogenicity of areca nut with tobacco.
- There is limited evidence in experimental animals for the carcinogenicity of arecoline.
- There is inadequate evidence in experimental animals for the carcinogenicity of arecaidine.
- […]
Toxicity of Arecoline can be partially mitigated by Vitamins C and E. [19]
Synthesis[edit]
Although an older method was described in the patent literature,[20] this is less attractive than the modern methods.
Synthesis:[21] Recent patents:[22][23] Recent publication:[24] Chinese:[25]
Fischer esterification of nicotinic acid (niacin) (1) gives methyl nicotinate [93-60-7] (2). Alkylation with methyl iodide then gives Iodonicot (Cesol iodide) [4685-10-3] (3). Coordination of the methyl cation to the nitrogen lone pair disrupts the aromaticity of the pyridine system. Hydride reduction with an agent such as potassium borohydride thus gives the tetrahydropyridine (4). Salt formation with HBr completes the synthesis (5).
A double Mannich reaction between methylamine (1), acetaldehyde (2) and formaldehyde (3) in the presence of hydroxylamine hydrochloride is supposed to have delivered 1-methyl-1,2,5,6-tetrahydropyridine-3-carbaldehyde oxime hydrochloride Fb: [139886-54-7] (4) as the product. Dehydration of the aldoxime to the nitrile occurs upon treatment with acetic anhydride giving 3-cyano-1-methyl-1,2,5,6-tetrahydropyridine [5657-66-9] (5). FGI of the nitrile to the methyl carboxylate ester then occurs upon acid catalyzed treatment with methanol, and then conversion to the HBr salt completes the synthesis.
See also[edit]
- Chavibetol
- Muscarine
References[edit]
- ^ «Poisons Standard October 2020». Federal Register of Legislation. The Australian Government.
- ^ Ghelardini C, Galeotti N, Lelli C, Bartolini A (2001). «M1 receptor activation is a requirement for arecoline analgesia». Farmaco. 56 (5–7): 383–385. doi:10.1016/S0014-827X(01)01091-6. hdl:2158/327019. PMID 11482763.
- ^ a b c Windholz M (1983). The Merck index : an encyclopedia of chemicals, drugs, and biologicals (10th ed.). Rahway, N.J., U.S.A.: Merck & Co. p. 113. ISBN 978-0-911910-27-8.
- ^ Fisher SK, Snider RM (July 1987). «Differential receptor occupancy requirements for muscarinic cholinergic stimulation of inositol lipid hydrolysis in brain and in neuroblastomas». Molecular Pharmacology. 32 (1): 81–90. PMID 3600615.
- ^ Mei L, Lai J, Yamamura HI, Roeske WR (February 1991). «Pharmacologic comparison of selected agonists for the M1 muscarinic receptor in transfected murine fibroblast cells (B82)». The Journal of Pharmacology and Experimental Therapeutics. 256 (2): 689–94. PMID 1704434.
- ^ Papke RL, Horenstein NA, Stokes C (2015). «Nicotinic Activity of Arecoline, the Psychoactive Element of «Betel Nuts», Suggests a Basis for Habitual Use and Anti-Inflammatory Activity». PLOS ONE. 10 (10): e0140907. Bibcode:2015PLoSO..1040907P. doi:10.1371/journal.pone.0140907. PMC 4619380. PMID 26488401. S2CID 7207479.
- ^ Yen CY, Lin MH, Liu SY, Chiang WF, Hsieh WF, Cheng YC, et al. (May 2011). «Arecoline-mediated inhibition of AMP-activated protein kinase through reactive oxygen species is required for apoptosis induction». Oral Oncology. 47 (5): 345–351. doi:10.1016/j.oraloncology.2011.02.014. PMID 21440488.
- ^ a b c d Liu YJ, Peng W, Hu MB, Xu M, Wu CJ (November 2016). «The pharmacology, toxicology and potential applications of arecoline: a review». Pharmaceutical Biology. 54 (11): 2753–2760. doi:10.3109/13880209.2016.1160251. PMID 27046150. S2CID 43564006.
- ^ a b Wang SW, Hwang GS, Chen TJ, Wang PS (August 2008). «Effects of arecoline on testosterone release in rats». American Journal of Physiology. Endocrinology and Metabolism. 295 (2): E497–E504. doi:10.1152/ajpendo.00045.2008. PMID 18559981.
- ^ Saha I, Das J, Maiti B, Chatterji U (2015). «A protective role of arecoline hydrobromide in experimentally induced male diabetic rats». BioMed Research International. 2015: 136738. doi:10.1155/2015/136738. PMC 4324734. PMID 25695047.
- ^ Cox S, Ullah M, Zoellner H (January 2016). «Oral and systemic health effects of compulsive areca nut use.». In Preedy VR (ed.). Neuropathology of Drug Addictions and Substance Misuse; Volume 3: General Processes and Mechanisms, Prescription Medications, Caffeine and Areca, Polydrug Misuse, Emerging Addictions and Non-Drug Addictions. Academic Press. pp. 785–793. doi:10.1016/B978-0-12-800634-4.00078-0. ISBN 978-0-12-800634-4.
Animal models demonstrate that the primary sites for metabolism of arecoline are the liver (Giri et al., 2006; Nery, 1971) and kidneys (IARC, 2004).
- ^ a b Giri S, Idle JR, Chen C, Zabriskie TM, Krausz KW, Gonzalez FJ (June 2006). «A metabolomic approach to the metabolism of the areca nut alkaloids arecoline and arecaidine in the mouse». Chemical Research in Toxicology. 19 (6): 818–827. doi:10.1021/tx0600402. PMC 1482804. PMID 16780361.
- ^ Johnston GA, Krogsgaard-Larsen P, Stephanson A (December 1975). «Betel nut constituents as inhibitors of gamma-aminobutyric acid uptake». Nature. 258 (5536): 627–628. Bibcode:1975Natur.258..627J. doi:10.1038/258627a0. PMID 1207742. S2CID 4147760.
- ^ Saikia JR, Schneeweiss FH, Sharan RN (May 1999). «Arecoline-induced changes of poly-ADP-ribosylation of cellular proteins and its influence on chromatin organization». Cancer Letters. 139 (1): 59–65. doi:10.1016/S0304-3835(99)00008-7. PMID 10408909.
- ^ Christie JE, Shering A, Ferguson J, Glen AI (January 1981). «Physostigmine and arecoline: effects of intravenous infusions in Alzheimer presenile dementia». The British Journal of Psychiatry. 138 (1): 46–50. doi:10.1192/bjp.138.1.46. PMID 7023592. S2CID 24009415.
- ^ Gupta PC, Ray CS (July 2004). «Epidemiology of betel quid usage» (PDF). Annals of the Academy of Medicine, Singapore. 33 (4 Suppl): 31–36. PMID 15389304. Archived from the original (PDF) on 2009-06-12.
- ^ Yusuf H, Yong SL (July 2002). «Oral submucous fibrosis in a 12-year-old Bangladeshi boy: a case report and review of literature». International Journal of Paediatric Dentistry. 12 (4): 271–276. doi:10.1046/j.1365-263X.2002.00373.x. PMID 12121538.
- ^ International Agency for Research on Cancer (2005). Betel-quid and areca-nut chewing. IARC Monograph 85-6 (PDF). IARC. ISBN 978-92-832-1285-0.
- ^ Zhou J, Sun Q, Yang Z, Zhang J (April 2014). «The hepatotoxicity and testicular toxicity induced by arecoline in mice and protective effects of vitamins C and e». The Korean Journal of Physiology & Pharmacology. 18 (2): 143–148. doi:10.4196/kjpp.2014.18.2.143. PMC 3994301. PMID 24757376.
- ^ Knox Lawrence Howland, U.S. Patent 2,506,458 (1950 to Nopco Chemical Co)
- ^ Kozello, I. A.; Gasheva, A. Ya.; Khmelevskii, V. I. (1976). «Improvement of the synthesis of arecoline from nicotinic acid». Pharmaceutical Chemistry Journal. 10 (11): 1515–1516. doi:10.1007/BF00760390.
- ^ K. S. Keshave Murthy, Allan W. Rey, Dan S. Matu, U.S. Patent 6,132,286 (2000 to Brantford Chemicals Inc.).
- ^ Jean-Daniel Brion, et al. U.S. Patent 20,090,258,883 (2009 to Centre National de la Recherche Scientifique CNRS, Laboratoires Servier, Universite Paris Sud (Paris 11)).
- ^ Volgin, A. D., Bashirzade, A., Amstislavskaya, T. G., Yakovlev, O. A., Demin, K. A., Ho, Y.-J., Wang, D., Shevyrin, V. A., Yan, D., Tang, Z., Wang, J., Wang, M., Alpyshov, E. T., Serikuly, N., Wappler-Guzzetta, E. A., Lakstygal, A. M., Kalueff, A. V. (15 May 2019). «DARK Classics in Chemical Neuroscience: Arecoline». ACS Chemical Neuroscience. 10 (5): 2176–2185. doi:10.1021/acschemneuro.8b00711.
- ^ Liu Naishan, Li Jingjie, & Liu Cuizhen, CN 105439941 2016 to QINGDAO KANGYUAN PHARMACEUTICAL CO Ltd).
- ^ Kozello, I. A.; Khmelevskii, V. I.; Gasheva, A. Ya.; Birbaeva, G. N. (1979). «An improved method of preparation of arecoline, starting from acetaldehyde (exchange of experience)». Pharmaceutical Chemistry Journal. 13 (11): 1158–1159. doi:10.1007/BF00778093.
Описание лекарственного препарата ветеринарного назначения БРОМКОЛИН®-О
Основано на официально утвержденной инструкции по применению
препарата БРОМКОЛИН®-О для специалистов
и утверждено компанией-производителем для электронного издания справочника Видаль Ветеринар
2017 года
Дата обновления: 2016.06.16
Активные вещества
-
бромгексин
(bromhexine)
Rec.INN
зарегистрированное ВОЗ -
линкомицин
(lincomycin)
Rec.INN
зарегистрированное ВОЗ -
колистин
(colistin)
Prop.INN
предложенное к употреблению ВОЗ
Лекарственная форма
|
|
БРОМКОЛИН®-О |
Раствор для перорального применения рег. 77-3-2.13-1256№ПВР-3-2.13/02901 |
Форма выпуска, состав и упаковка
Вспомогательные вещества: пропиленгликоль — 80 мг, поливинилпирролидон — 50 мг, нипагин — 1.8 мг, вода д/и — до 1 мл.
Расфасован по 0.5 л и 1 л в полиэтиленовые канистры соответствующей вместимости. Полиэтиленовые канистры закрывают резьбовыми пластмассовыми крышками с контролем первого вскрытия.
Фармакологические (биологические) свойства и эффекты
Комплексный антибактериальный препарат, содержащий компонент из группы линкозамидов и группы полимиксинов.
Линкомицин проявляет наибольшую активность в отношении грамположительных микроорганизмов: Staphylococcus spp., Streptococcus spp. (в т.ч. Streptococcus pneumoniae), Clostridium spp., Corynebacterium spp.; а также Mykoplasma spp. Активен в отношении микроорганизмов, особенно стафилококков, устойчивых к другим антибиотикам. На грамотрицательные бактерии, грибы и вирусы не действует. Механизм действия связан с подавлением синтеза белка в микробных клетках. Максимальная концентрация антибиотика в крови достигается через 1 ч. Терапевтическая концентрация антибиотика сохраняется на протяжении 24 ч. Линкомицин проникает во все органы и ткани организма, включая костную ткань.
Колистин действует против грамотрицательных микроорганизмов, в т.ч.: Escherichia coli, Klebsiella sрp., Enterobacter spp., Salmonella sрp., Shigella spp., Haemophilus spp., Brucella spp., Pseudomonas aeruginosa. Обладает бактерицидным эффектом. В одинаковой степени активен как в отношении размножающихся клеток, так и находящихся в состоянии покоя. Приобретенная бактериальная резистентность развивается очень медленно.
Колистин, связываясь с фосфолипидами цитоплазматической мембраны бактериальной клетки, усиливает ее проницаемость, что ведет к деструкции клетки. Выводится преимущественно с фекалиями.
Комбинация линкомицина и колистина обладает синергическим действием.
Бромгексин оказывает муколитическое (секретолитическое) и отхаркивающее действие. Механизм действия обусловлен деполимеризацией мукопротеинов и мукосахаридов, в результате чего уменьшается вязкость бронхиального секрета и облегчается отхождение мокроты. Бромгексин не обладает протеолитическим действием, вследствие чего не повреждается слизистая бронхов. Бромгексин проникает через гематоэнцефалический и плацентарный барьер. Экскретируется почками.
Препарат особенно активен против Pseudomonas aeruginosa и при септицемии. Перед применением следует проверить чувствительность возбудителей к линкомицину и колистину.
Препарат малотоксичен для теплокровных животных. В рекомендованных дозах не оказывает местнораздражающего и сенсибилизирующего действия.
Препарат по степени воздействия на организм относится к умеренно опасным веществам (3 класс опасности по ГОСТ 12.1.007).
Показания к применению препарата БРОМКОЛИН®-О
- желудочно-кишечные инфекции, вызванные Escherichia coli, Pseudomonas aeruginosa, Haemophilus spp., Salmonella sрp., Pasteurella spp., Staphylococcus spp., Streptococcus spp., Enterobacter spp.;
- респираторные заболевания, вызванные грамположительными аэробными бактериями: Staphylococcus spp., Streptococcus spp., в т.ч. Streptococcus pneumoniae (за исключением Enterococcus faecalis), Corynebacterium diphtheriae; анаэробными бактериями Clostridium spp., а также грамотрицательными анаэробными бактериями Bacteroides spp.
Порядок применения
Препарат применяется орально в следующих дозах:
- поросятам массой до 3 кг дают по 1 мл препарата 1 раз/сут в течение 5 дней;
- поросятам массой от 3 до 5 кг дают по 1 мл препарата 2 раза/сут в течение 3 дней;
- цыплятам-бройлерам и ремонтному молодняку птиц в дозе 1 мл на 2 л питьевой воды в течение 3-5 дней.
Особенностей действия лекарственного препарата при его первом применении и отмене не установлено.
Следует избегать пропуска очередной дозы препарата, т.к. это может привести к снижению терапевтической эффективности. В случае пропуска одной дозы необходимо ввести препарат как можно скорее.
Побочные эффекты
При применении препарата Бромколин®-О в соответствии с инструкцией побочных явлений и осложнений, как правило, не наблюдается.
Симптомы передозировки лекарственного препарата не выявлены.
Противопоказания к применению препарата БРОМКОЛИН®-О
- тяжелая почечная недостаточность;
- индивидуальная повышенная чувствительность животных к компонентам препарата.
Особые указания и меры личной профилактики
В случае появления аллергических реакций использование препарата прекращают и назначают животному антигистаминные и симптоматические препараты.
Не следует применять одновременно с антибиотиками группы аминогликозидов (гентамицин, неомицин), а также с миорелаксантами и анестетиками (угроза развития паралича дыхательных мышц).
Убой животных на мясо разрешается не ранее чем через 3 дня после последнего применения препарата. Мясо животных, вынужденно убитых до истечения указанного срока, может быть использовано для кормления пушных зверей после термической обработки.
Яйцо кур-несушек может быть использовано в пищу через 3 суток после прекращения применения препарата.
Меры личной профилактики
При работе с препаратом Бромколин®-О следует соблюдать общие правила личной гигиены и техники безопасности, предусмотренные при работе с лекарственными препаратами. По окончании работы руки следует вымыть теплой водой с мылом.
При случайном контакте лекарственного препарата с кожей или слизистыми оболочками глаза, их необходимо промыть большим количеством воды. Людям с гиперчувствительностью к компонентам препарата следует избегать прямого контакта с препаратом. В случае появления аллергических реакций или при случайном попадании препарата в организм человека следует немедленно обратиться в медицинское учреждение (при себе иметь инструкцию по применению препарата или этикетку).
Пустые канистры из-под лекарственного препарата запрещается использовать для бытовых целей, они подлежат утилизации с бытовыми отходами.
Условия хранения БРОМКОЛИН®-О
Препарат следует хранить в закрытой упаковке производителя в сухом, защищенном от прямых солнечных лучей, недоступном для детей месте, отдельно от продуктов питания и кормов, при температуре от 5°С до 25°С.
Срок годности БРОМКОЛИН®-О
Срок годности при соблюдении условий хранения — 2 года с даты производства.
Утилизация неиспользованного препарата производится в соответствии с требованиями законодательства.
БРОМКОЛИН®-О отзывы
Помогите другим с выбором, оставьте отзыв об БРОМКОЛИН®-О
Оставить отзыв
|





 , Генгин М.Т.1
, Генгин М.Т.1