Как подготовиться к приему пробиотиков. Действие Эноанта в педиатрии.
05 февраля 2021
Как подготовиться к приему пробиотиков. Действие Эноанта в педиатрии.
Как подготовиться к приему пробиотиков. Действие Эноанта в педиатрии.
Ведущая роль микробов кишечника в поддержании гомеостаза организма.
В последнее время мы все больше внимания истинным источникам иммунитета. Открытия Л. Пастера, Л. Коха, ИИ. Мечникова позволили установить, что многие болезни обусловлены нарушениями со стороны микроэкологической системы кишечника. В настоящее время возрос интерес ученых к идее ИИ. Мечникова о ведущей роли микробов кишечника в поддержании гомеостаза организма, который, как известно, определяет состояние здоровья человека, его продолжительность жизни, работоспособность и даже эмоциональный тонус. В связи с этим нормализация микробного биоценоза кишечника является отправной точкой в поддержании состояния здоровья человека.
В этом аспекте рациональное питание является наиболее доступным и физиологичным способом воздействия на эубиоз, а, следовательно, и на организм в целом. В улучшении состояния здоровья весьма перспективным направлением является создание продуктов функционального питания, в состав которых входят вещества естественного происхождения, предназначенные для ежедневного употребления и оказывающие регулирующее действие на физиологические функции и биохимические реакции организма.
Для этих целей сейчас многие применяют пробиотики, например Линекс, Ветом, Хилак Форте, Флорин Форте, Нормобакт L, Аципол, Бифиформ, Нормофлорин Л, Флорок, Бак-сет Форте, Риофлора и другие.
Возможно ли улучшить этот процесс, создавая пробиотикам наилучшие условия для размножения?
Попадая в организм, пробиотикам приходится бороться с другими микроорганизмами, населяющими кишечник. Как им в этом помочь? Как подготовить подходящую среду для их существования и размножения. Оказывается в этом может помочь натуральный продукт из крымского винограда, действие которого обусловлено веществами из кожицы винограда. Этот продукт – ЭНОАНТ. Вот, что показали исследования.
Нормализация индигенной микрофлоры
Результаты комплексных клинико-бактериологических исследований показали высокую эффективность использования ЭНОАНТА при лечении дисбактериоза кишечника. Так, при включении его в пищевой рацион происходит полная нормализация микробного пейзажа у 80% больных.
Нормализующее действие ЭНОАНТА на микробный биоценоз заключается в увеличении нормальной кишечной палочки, значительном улучшении ее физиологических свойств, в росте бифидобактерий, элиминации из кишечника грибов Candida albicans. Такое благоприятное воздействие ЭНОАНТА на индигенную микрофлору связано со следующими моментами: во-первых, активная кислотность ЭНОАНТА Ph = 3,5, а, как известно, максимум физиологической активности большинства условно-патогенных бактерий находится в интервале Ph = 6,0-8,0. Снижение кислотности до 4,5 приводит к гибели большинства факультативных микроорганизмов. Во-вторых, биоорганический комплекс, входящий в состав ЭНОАНТА, является прекрасной средой, способствующей росту, размножению и улучшению физиологических свойств индигенной микрофлоры.
Обеспечение колонизации экзогенных бактерий, входящих в состав пробиотиков
В настоящее время наиболее перспективным направлением в лечении дисбактериоза кишечника является использование пробиотиков вместе с препаратами, обеспечивающими адгезию и приживаемость экзогенной микрофлоры. ЭНОАНТ является уникальной средой для колонизации бактерий, составляющих основу эубиотиков.
ЭНОАНТ оказывает комплексное воздействие на организм, которое наблюдается в следующем:
+ Регуляция антиоксидантного баланса.
Антиоксидантная активность флавоноидов в 10-20 раз превосходит таковую у других природных антиоксидантов (например, витамина Е). Содержащиеся в ЭНОАНТЕ полифенолы имеют мономерные и олиго-мерные формы молекул, обладающие выраженными антиоксидантными свойствами. Благодаря уникальным антиоксидантным свойствам полифенолы оказывают противовоспалительное, антиаллергическое, противовирусное, антиканцерогенное, радиопротекторное и др. действия на организм.
+ Регуляция всасывания и расщепления питательных веществ
Полифенолы, входящие в состав ЭНОАНТА, стимулируют высвобождение гастрина и соляной кислоты в желудке, активизируют процесс взаимодействия белков пищи с пищеварительными ферментами. Это ускоряет транспорт белков по пищеварительному тракту, оптимизирует их гидролиз и улучшает всасывание пептидов, аминокислот, витаминов (в том числе витамина Д), железа. В связи с этим ЭНОАНТ возможно использовать для улучшения аппетита, стимуляции процесса пищеварения, профилактики рахита, авитаминозов, анемии.
+ Коррекция иммунных нарушений
Применение ЭНОАНТА способствует повышению важнейших факторов неспецифической резистентности и иммунологической реактивности организма: активности лизонима, комплемента, пропердина, фагоцитарной активности нейтрофилов, увеличению концентрации IgA и параметров Т-клеточного звена иммунитета. Такое благотворное влияние на иммунную систему осуществляется опосредованно, через микроэкологическую систему кишечника. Микробиоценоз является важнейшим фактором, определяющим состояние иммунологической реактивности организма. Необходимым условием для адекватного функционирования иммунной системы является достаточное содержание в микробном пейзаже индигенных бактерий, выполняющих антагонистическую, витаминсинтезирующую, иммунопродуцирующую и др. функции.
По материалам исследования «»ЭНОАНТ» — ЛЕЧЕБНОЕ И ПРОФИЛАКТИЧЕСКОЕ ДЕЙСТВИЕ В ПЕДИАТРИИ. И.В. БОГАДЕЛЬНИКОВ, Р.Е. ВЕРЕМЬЕВА»
(https://s.siteapi.org/cf6de9406ab9559.ru/docs/9e2b63682cf237415c7244ef696a9732b67dcbcf.pdf)
Правда и вымысел вокруг иммунотерапии. Интервью с онкологом Михаилом Ласковым
09.11.2018
В октябре Нобелевку вручили исследователям иммуотерапии. Если и раньше вокруг этого метода ходило много слухов, то после решения Нобелевского комитета ажиотаж возрос еще больше. Мы поговорили с онкологом Михаилом Ласковым о том, что такое иммунотерапия и что выдают за иммунотерапию, при лечении каких видов рака она наиболее эффективна, и почему во многих случаях ее нельзя использовать.
- Обновление. В сентябре 2022 года мы опубликовали новый материал об иммунотерапии онкологических заболеваний. В нем подробно рассказываем, как работают иммуноонкологические препараты и в каких ситуациях они могут назначаться, как проводится иммунотерапия и какие побочные эффекты возникают чаще всего. Прочитать статью можно по этой ссылке.
Что такое иммунотерапия?
Иммунотерапия – это относительно новый метод лечения онкологических заболеваний. Иммунотерапия не действует напрямую на опухоль, но заставляет иммунитет убивать раковые клетки. Это и есть принципиальное ее отличие от химиотерапии и таргетной терапии.
По большому счету, иммунотерапия заставляет иммунитет делать то, что он и так должен, но не делает по каким-либо причинам. Например, иногда раковые клетки маскируются под здоровые, тогда иммунная система перестает воспринимать их как инородные и не уничтожает. Иммунотерапия может “снимать маску” с опухолевых клеток и помогать иммунитету распознавать их.
Справедливости ради нужно сказать, что сейчас поднялся очень большой хайп по поводу иммунотерапии, потому что вышли действительно эффективные препараты: авелумаб, атезолизумаб, дурвалумаб, пембролизумаб, ниволумаб и ипилимумаб. Но иммунотерапия началась, конечно же, не сейчас и даже не три года назад. Она очень давно применялась с переменным успехом. Как правило, с не очень большим.
Что же произошло сейчас? Появился новый класс препаратов, которые действуют на рецепторы PD1 и PD-L1. Именно эти рецепторы позволяют опухолевой клетке повлиять на иммунитет так, чтобы он перестал распознавать ее, и, следовательно, убивать раковые клетки.
Для лечения каких видов рака используется иммунотерапия?
Сначала эти препараты начали применяться при меланоме и имели большой успех. Почему именно при меланоме? Как мы понимаем, есть опухоли, которые лечатся относительно легко, а есть те, что лечатся очень плохо, рак поджелудочной, например.
Новые препараты стараются разрабатывать именно для труднолечимых раков. Меланома – это как раз один из таких труднолечимых раков, в лечении которого двадцать лет не происходило ничего хорошего, никаких новых высокоэффективных препаратов не появлялось.
Иммунотерапия показала себя очень эффективно при меланоме, все воодушевились и начали применять этот метод лечения на все раки, которые только могли. Тут, конечно же, очень быстро выяснилось, что где-то он работает, где-то не работает совсем, а где-то работает только в конкретных ситуациях.
Иммунотерапия сейчас успешно применяется при лечении рака легких. Как мы знаем, есть разные мутации и разные виды этого рака. И при некоторых из них иммунотерапия быстро заменила химию, оказалась и лучше, и безопаснее. Это очень большой успех. Но стоит помнить, что далеко не весь рак легких успешно лечится иммунотерапией.
В России иммунотерапию также используют при лечении рака почек, а на Западе – в случаях рака головы и шеи, лимфомы Ходжкина, рака мочевого пузыря и некоторых случаях рака печени.
Как объяснить, что иммунотерапия подходит только по показаниям и небольшому проценту больных?
Как и все, что есть в онкологии, иммунотерапия – это не панацея от всего рака. Это просто еще один способ воздействовать на опухоль, далеко не всегда эффективный и ни разу не безопасный
Использовать иммунотерапию можно лишь в ограниченном количестве случаев. На данный момент ее эффективность доказана только для следующих видов рака:
— меланома;
— немелкоклеточный рак легких;
— мелкоклеточный рак легких;
— рак почки;
— рак головы и шеи;
— лимфома Ходжкина;
— рак мочевого пузыря.
*** Иммунотерапия может быть эффективной в строго определенных ситуациях даже при вышеуказанных видах рака.
К тому же есть ряд побочных эффектов. И довольно серьезных. В некоторых случаях иммунная система начинает атаковать здоровые ткани и органы, что может вызвать такие осложнения, как:
— пневмония,
— гормональные нарушения,
— проблемы с желудочно-кишечным трактом,
— нефрит и нарушение функции почек,
— мышечные боли, боли в костях и суставах,
— ощущение усталости, слабость,
— тошнота, диарея, нарушения аппетита и др.
Впрочем, серьезные осложнения появляются в среднем только в одном случае из шести.
В октябре вы назвали Нобелевскую премию за иммунотерапию премией для маркетологов. Почему вы отреагировали именно так?
Вспомним историю прекрасного препарата бевацизумаб. Когда он вышел, маркетологи подняли хайп по поводу этого средства, которое останавливает рост сосудов в опухоли. Начали из каждого утюга говорить о том, какое это чудо-чудо-чудо. В итоге, конечно, никакого чуда не было, и этот препарат нашел свое довольно ограниченное применение. И по соотношению цена-польза он, вежливо говоря, далеко не идеален.
И вот уже на этой неделе ко мне толпами приходят люди, которые пытаются спастись при помощи иммунотерапии. И только максимум у 10 % из них этот метод можно пробовать с неизвестным результатом.
Вот про такую ситуацию как раз и было предостережение в этом посте. Потому что на этом сейчас можно быстро срубить много денег в России, именно срубить, а не заработать. Ведь у людей есть все подтверждения: 1) не могли просто так дать Нобелевку; 2) все журналисты написали, что это чудо и панацея; 3) препарат стоит от 200 тысяч в месяц. Все сходится – Нобелевка, цена. Отлично, квартиру продаем.
И тут еще какой-нибудь радостный доктор из частной клиники предлагает его назначить и прямо сейчас, ведь завтра может быть уже поздно.
И главное – очень хочется верить, что это спасет. Это ведь не гомеопатия, а высокая наука.
Как пациенту понять, назначают ему фейковые препараты или нормальные?
Это сделать можно, но необходимо, конечно, включать голову. Нужно много читать и стараться уметь разбираться в источниках.
Например, почитать гайдланы для пациентов NCCN или ESMO. Это англоязычные источники, NCCN – американский , ESMO – европейский. Кстати, мы сейчас переводим их на русский язык при помощи благотворительного фонда «Живой».
Еще можно посмотреть русскоязычные рекомендации, но только профессиональные.
Тут проблема, конечно, в том, что на русском языке практически ничего нету. Существуют клинические рекомендации, но они для врачей. Для пациентов – почти ничего. Вот у нас (на ютуб-канале Клиники амбулаторной онкологии и гематологии — примечание Profilaktika.Media) есть видео про иммунотерапию. Еще пара моих комментариев и несколько материалов моих коллег на эту тему. Но в общем море «ура-ура, нашли лекарство от рака», «британские ученые доказали…» это может быть очень сложно найти.
А какие препараты иммунотерапии используются сейчас в России?
Их всего четыре, и они довольно дорогие. Это атезолизумаб «Тецентрик», пембролизумаб «Кейтруда», ипилимумаб «Ервой» и ниволумаб «Опдиво». И все, больше пока ничего нет, но много всего на предрегистрационной стадии.
Какие “методики” на рынке выдают за фальшивую иммунотерапию? Например, назначают профилактические капельницы с иммуномодуляторами против рака.
Инарон, рефнот, вакцины всякие, фракция АСД, всего и не упомнишь.
Как пациенту понять, что ему нужна и может помочь иммунотерапия и как ее можно попробовать получить в рамках ОМС?
Поговорить с врачом, почитать надежные источники (об этом выше). По ОМС пойти к химиотерапевту по месту жительства. Все, больше никак.
За счет чего иммунотерапия такая дорогая? Из чего складывается стоимость лекарства?
Разработка нового лекарства, действительно нового, как эти ингибиторы, стоит миллиард долларов. И семь лет после разработки формула защищена патентом. После этого срока буквально на следующий же день заранее скопированный препарат начинают продавать дешевле.
Появляется большая конкуренция. Соответственно, за эти семь лет люди, работающие над созданием лекарства, должны вернуть себе “ярд” и заработать. Один “ярд” что в себя включает? Что из 10 лекарств, которые на ранней стадии компания начинает разрабатывать, до клиник доходит только одно, и это занимает лет двадцать.
Соответственно, вот и вся экономика, за 7 лет нужно всю стоимость отбить и немного заработать для акционеров. Очень сложно разрабатывать и очень просто копировать.
Как пациенту понять, что он наткнулся на мошенников?
Сигнальный значок – это, прежде всего, давление. Когда начинается – давайте скорее, уже вчера надо было начать применять препарат, думать вам некогда, по другим местам ходить нечего. То есть такие довольно простые элементы давления.
В онкологии, на самом деле, крайне редко бывает так, что необходимо вот прямо сейчас, сию минуту начать лечение.
Понятно, что если требуют много денег и есть давление по времени, чтобы человек не успел одуматься, то, скорее всего, что-то не так.
Курящие люди нередко страдают хронической патологией дыхательной системы, например, хроническим бронхитом. Кашель с небольшим количеством мокроты, особенно в утреннее время, является классическим симптомов для курильщиков. Нередко при обращении за медицинской помощью им рекомендуется прием ацетилцистеина как муколитического и отхаркивающего средства, обладающего еще антиоксидантным и цитопротекторным эффектом. Также частой является рекомендация во избежание развития рака легких для таких больных прием витаминов, которые в результате своего антиоксидантного действия должны предотвратить развитие онкологических процессов.
Ускорение роста опухоли: эксперименты на мышах.
Однако, вопреки этому представлению, учеными из Швеции недавно показано, что прием некоторых антиоксидантов ведет к обратному результату, то есть ускоряет рост опухоли в легком. В исследовании использованы лабораторные мыши с уже имевшимся раком легкого, одной группе которых вводился витамин Е и ацетилцистеин, другая же была контрольной. При этом первая группа разделялась на мышей, получавших указанные препараты в небольших дозах, и тех, кто получал их в высоких. В результате среди всех мышей, получавших антиоксиданты, наблюдался в три раза больший уровень смертности, чем в контрольной группе. При вскрытии животных определялось, что рост и агрессивность опухоли были выше среди получавших ацетилцистеин и витамин Е. Эффект этот продемонстрировал зависимость от дозы вводимых антиоксидантов. В частности, у мышей, которым препараты давались в небольших дозах, наблюдался соответственно небольшой рост опухоли по сравнению с контролем. У животных же, получавших высокие дозы антиоксидантов, опухоль по сравнению с контролем, увеличивалась значительно.
Антиоксиданты: польза или вред?
Организмом вырабатываются собственные антиоксиданты для предотвращения повреждения ДНК химическими веществами, названными свободными радикалами, но при большой нагрузке негативных внешних факторов требуется внесение антиоксидантов извне. Таков традиционный взгляд на эти вещества. Однако исследования демонстрируют противоречивые результаты на этот счет. В частности, в Финляндии в 1993 г при участии 30 000 человек было продемонстрировано, что у курильщиков, принимавших антиоксидант бета-каротин отмечался высокий риск развития рака легких и повышенный уровень смертности по сравнению с популяцией. В другом исследовании SELECT среди 35 000 участников в США и Канаде выяснено, что у тех, кто принимает витамин Е, рак простаты развивается чаще.
Механизм канцерогенеза при участии антиоксидантов.
В чем же дело? Почему антиоксиданты не оказывают протективного эффекта? Исследователями выдвинуто предположение, что антиоксиданты способны защищать от повреждения свободными радикалами не только нормальные клетки, но и клетки опухоли. Белок, названный р53, способен улавливать информацию о повреждении ДНК вследствие избытка реактивных оксидантных молекул, при этом останавливать рост опухолевых клеток. Антиоксиданты снижают уровень этих молекул в результате химического взаимодействия, разрушение ДНК опухоли не происходит, уровень р53 остается низким.
Прием антиоксидантов с осторожностью.
Таким образом, традиционно считавшиеся защитниками от развития онкологических процессов у пациентов с раком легкого, антиоксиданты не только не останавливают процессы канцерогенеза, но и могут способствовать их ускорению. Особенно важно это для больных хроническими заболеваниями легких, среди которых могут находиться лица с не выявленной пока опухолью, но активно принимающих ацетилцистеин и витамин Е. Таким больным, как продемонстрировано в исследованиях, следует назначать указанные препараты с осторожностью.
Источник: «Antioxidants Accelerate Lung Cancer Progression in Mice,» by V.I. Sayin et al. Science Translational Medicine, 2014.
Статья на конкурс «Био/Мол/Текст»: Корректировка диеты часто применяется для лечения и профилактики заболеваний. Онкологические заболевания — не исключение: правильное питание может служить не только профилактической мерой, но и повышать эффективность терапии. Здесь мы предлагаем обсудить «вкусовые предпочтения» раковых клеток и разобраться в том, как отдельные питательные вещества могут помочь бороться с опухолью.
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022.
Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.
Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Введение: на вкус и цвет товарищей нет
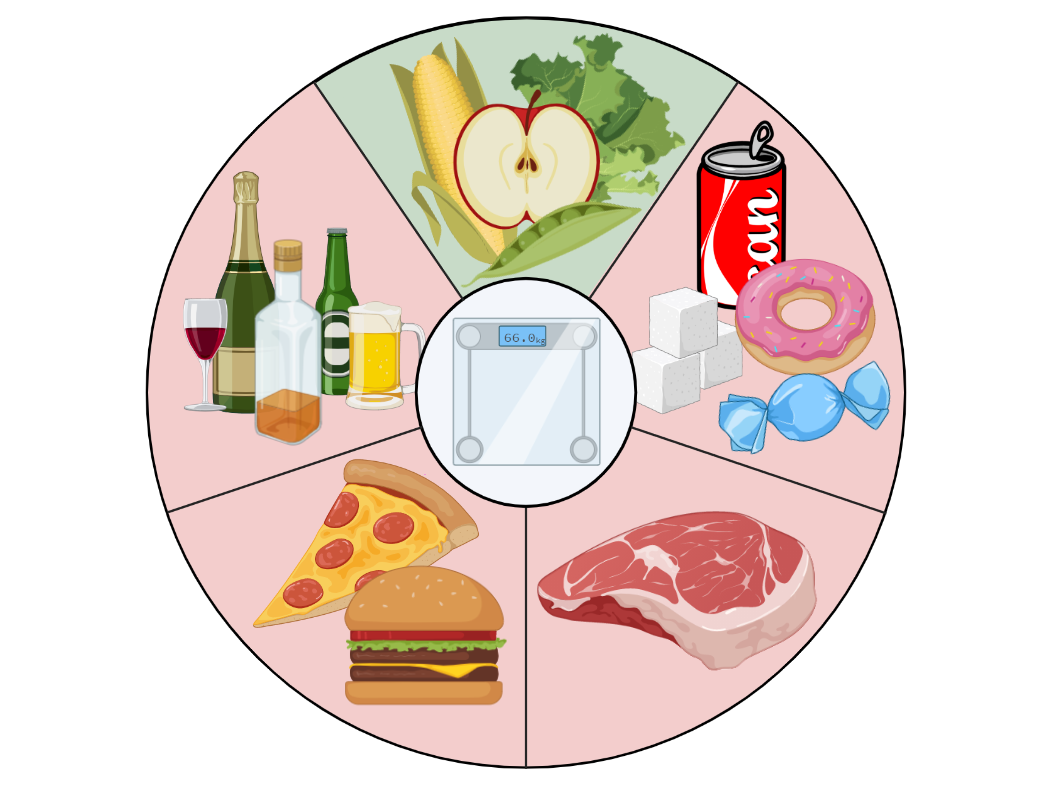
С начала 1980-х годов ведущие организации здравоохранения выпускают рекомендации по питанию и образу жизни, которые позволяют снизить индивидуальный риск развития рака. Данные рекомендации основаны на результатах метаанализов эпидемиологических исследований (иными словами, анализ многолетнего опыта миллионов людей, которые питались тем или иным образом). Эти рекомендации универсальны и просты в исполнении: они не требуют подсчета калорий, строгого контроля состава продуктов, а лишь предлагают общую схему и принцип питания для поддержания здорового веса (рис. 1).
Рисунок 1. Рекомендации по питанию, которые направлены на снижение вероятности возникновения онкологических заболеваний. Ежедневный рацион должен включать фрукты, овощи, бобовые культуры, цельнозерновые крупы. По возможности, необходимо ограничивать употребление красного мяса, сахара, сладких газированных напитков и алкоголя. Следование данным советам позволит поддерживать здоровый вес в течение всей жизни и снизить индивидуальный риск развития рака.
коллаж авторов статьи. Создан с помощью BioRender.com
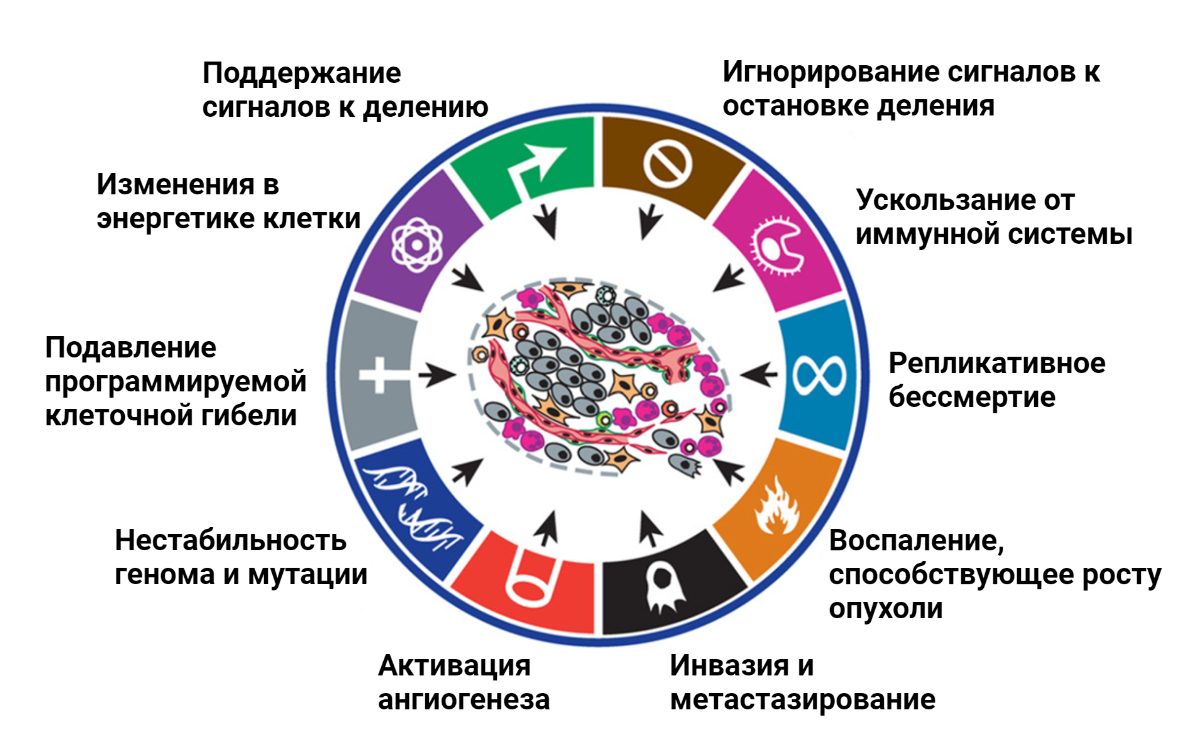
Подобного рода советы относятся к здоровым людям, тогда как для людей, страдающих онкологическими заболеваниями, стандартных рекомендаций по питанию не существует. В то же время, питание пациентов может сильно влиять на успешность терапии злокачественных образований [1]. Почему для людей, больных раком, нельзя составить универсальные рекомендации по составу пищи? Ответ на этот вопрос следует из принципов, согласно которым развиваются все опухоли [2]. Изначально клетка, которая в будущем даст начало опухоли, ничем не отличается от своих соседей. По мере накопления мутаций нормальные клетки могут постепенно эволюционировать и приобретать черты раковых клеток [3], [4]. В 2000 году среди многочисленных особенностей рака, в легендарном обзоре Hallmarks of cancer [3] были обозначены основные признаки, которые определяют биологию опухолевой клетки (рис. 2).
Рисунок 2. Особенности опухолевых клеток (hallmarks of cancer), которые отличают их от нормальных. Были сформулированы в 2000 году [3] и затем дополнены в 2011 [4].
адаптировано из [4]
Важнейшей особенностью всех раковых клеток является нестабильность генома, которая приводит к огромному генетическому разнообразию опухолей. Несмотря на ряд свойств, присущих всем раковым клеткам, каждая опухоль обладает уникальным набором мутаций, которые и определяют ее агрессивность, скорость роста, эффективность терапии. Генетическое разнообразие опухолей является основной преградой для составления универсальных рекомендаций по питанию для пациентов.
В последнее время исследователи активно изучают влияние питательных веществ на прогрессию опухоли и эффективность лечения. В основном проводятся экспериментальные работы на животных моделях, но есть и немногочисленные клинические исследования. Мы предлагаем читателям познакомиться поближе с особенностями метаболизма опухолевой клетки. Попытаемся разобраться, как вещества, потребляемые с пищей, могут влиять на опухоль и ее окружение. И, наконец, попробуем ответить на вопрос: может ли диета помочь в борьбе с раком?
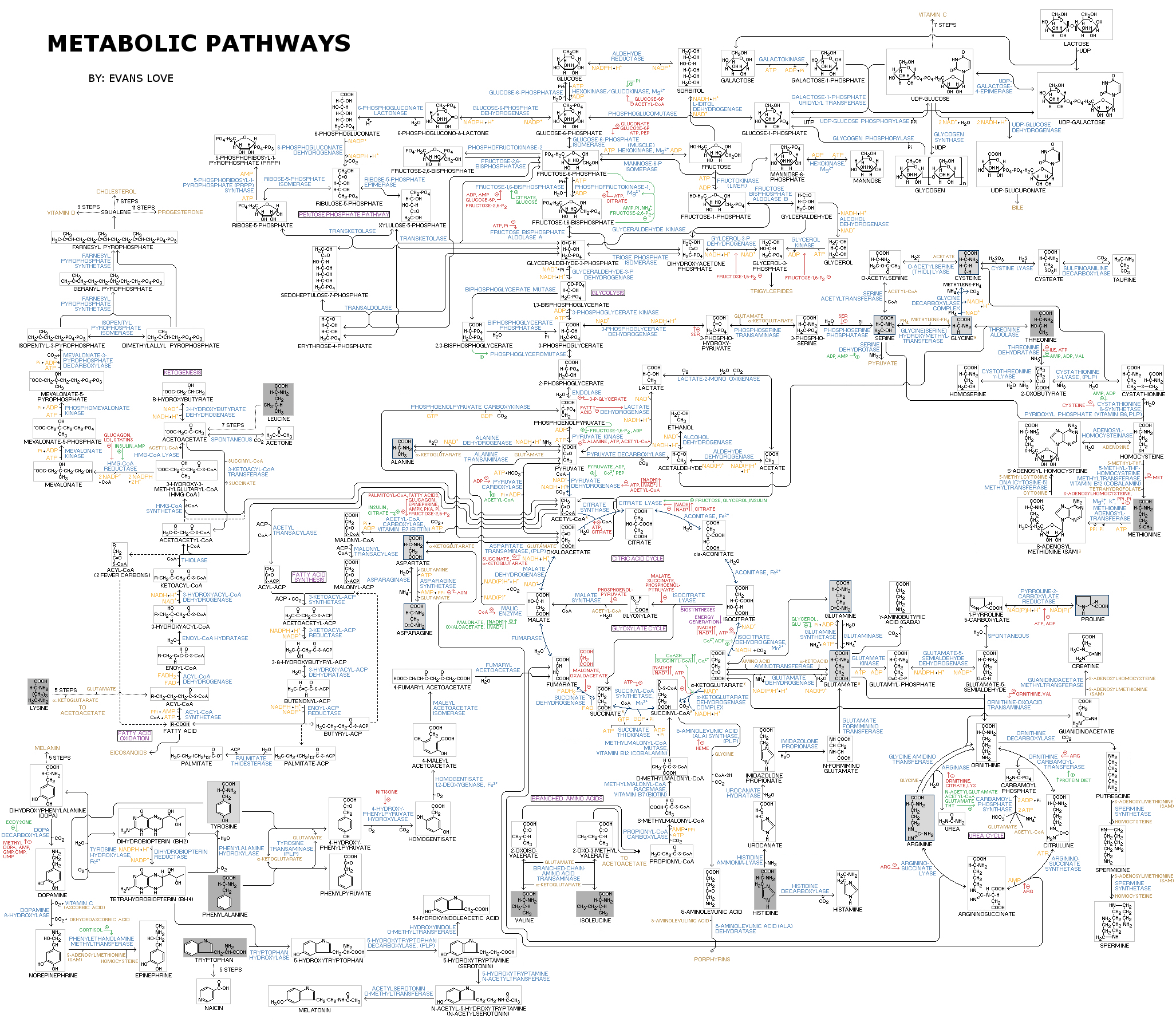
Для того, чтобы разобраться в тонкостях метаболизма раковой клетки, кратко вспомним основные принципы и термины биоэнергетики. Метаболизм — это совокупность химических превращений в клетке, которые направлены на получение энергии и необходимых веществ. Только посмотрите, какое бесчисленное количество реакций включает в себя метаболизм (рис. 3)! Все метаболические пути можно условно разделить на биодеградацию (катаболизм) и биосинтез (анаболизм) [5]. Катаболизм приводит к получению энергии в виде макроэргических соединений (таких как АТФ), а также NADH, NADPH и FADH2 — коферментов, участвующих в окислительно-восстановительных реакциях. Анаболические процессы используют запасенную энергию для синтеза молекул, необходимых для жизни клетки: жиров, нуклеотидов, белков, углеводов.
Рисунок 3. Метаболическая карта — схема, объединяющая основные метаболические пути в клетке.
Метаболизм тесно связан с питанием: ежедневно мы потребляем питательные вещества, которые, с одной стороны, участвуют в катаболических реакциях и поставляют энергию клеткам, а с другой — необходимы для синтеза собственных молекул. Углеводы, белки и жиры, которые мы потребляем, разрушаются в пищеварительном тракте до мономерных единиц: углеводы до моносахаридов (глюкоза, фруктоза и др.), жиры до жирных кислот и глицерина, белки до аминокислот. Эти молекулы поступают в клетки организма и принимают участие в метаболических процессах.
В раковой клетке зачастую увеличена активность некоторых метаболических ферментов или целых метаболических путей, а значит, и потребность в питательных веществах у клеток опухоли может отличаться от нормальных клеток [6]. Эти особенности могут быть учтены при лечении опухоли: исключение из рациона пациента определенных компонентов пищи приведет к понижению их содержания в плазме крови, а следовательно, и в окружении раковых клеток, что негативно скажется на их размножении. Кроме этого, некоторые элементы питания могут непосредственно влиять на противоопухолевый иммунитет, что также должно быть учтено при составлении диеты.
Глюкоза
Глюкоза является основным источником энергии для живых организмов. В нормальном рационе человека она встречается как в свободном виде, так и в составе олиго- и полисахаридов (например, в сахарозе, лактозе и мальтозе). Одним из важнейших биоэнергетических путей в клетке является гликолиз — последовательность химических реакций, в результате которых из 1 молекулы глюкозы получается 2 молекулы пировиноградной кислоты, 2 молекулы АТФ и 2 молекулы NADH. Затем пировиноградная кислота может быть вовлечена в цикл трикарбоновых кислот (цикл Кребса) — биохимический процесс, протекающий в митохондриях, который поставляет NADH и FADH2 что, в конечном счете, делает возможным синтез АТФ посредством окислительного фосфорилирования. При этом из 1 молекулы глюкозы можно получить приблизительно 36 молекул АТФ, что гораздо более выгодно с точки зрения энергетики, нежели просто гликолиз. Вследствие этого большинство клеток активно использует цикл трикарбоновых кислот и окислительное фосфорилирование для получения энергии.
Тем не менее, известно множество случаев, когда по разным причинам клетки смещают баланс в сторону гликолиза, используя этот путь в качестве основного источника энергии, ингибируя ферменты цикла трикарбоновых кислот или активируя ферменты гликолиза.
Давно известно, что опухолевые клетки активно используют гликолиз, несмотря на его относительно низкую эффективность с точки зрения энергетической выгоды. Это явление было открыто Отто Генрихом Варбургом в 1924 году. Сам Варбург считал, что нарушение клеточного дыхания — главная причина развития опухоли. Однако оказалось, что клеточное дыхание в большинстве опухолевых клеток не нарушено, а просто подавляется из-за активного гликолиза. Сейчас понятно, что активный гликолиз дает преимущество опухолевым клеткам. Во-первых, гликолиз протекает без кислорода, и, по-видимому, во многом является адаптацией к гипоксии, которая развивается по мере удаления опухолевых клеток от кровеносных сосудов. Частично эта проблема также решается тем, что раковые клетки могут способствовать ангиогенезу — прорастанию сосудов в опухоль за счет продукции ангиогенных факторов, например фактора роста эндотелия сосудов (VEGF, Vascular endothelial growth factor). Во-вторых, активный гликолиз сопряжен с образованием большого количества молочной кислоты, что приводит к закислению среды, тем самым способствуя инвазии опухоли за счет разрушения нормальных популяции клеток и деградации внеклеточного матрикса.
В то же время, нельзя не отметить тот факт, что эффект Варбурга наблюдается не только в опухолевых клетках, но и вообще во всех активно пролиферирующих клетках. Глюкоза — один из основных источников углерода в клетке, и ее полное окисление в цикле трикарбоновых кислот идет вразрез с потребностями пролиферирующей клетки. Некоторая часть глюкозы, а точнее, ее метаболитов, должна быть направлена на пути биосинтеза аминокислот, нуклеотидов и жирных кислот. Важную роль в производстве предшественников нуклеотидов и аминокислот, а также NADPH, необходимого для синтеза жирных кислот, играет пентозофосфатный путь — альтернативный путь окисления глюкозы, который также имеет ключевое значение в поддержании роста раковых клеток.
Итак, глюкоза особенно необходима раковым клеткам в связи с их активным размножением; при этом она служит не только источником энергии, но и важным предшественником для синтеза аминокислот, нуклеотидов и жирных кислот. Однако помимо непосредственной роли глюкозы в клеточном метаболизме, важным физиологическим аспектом также является эффект инсулина на опухолевые клетки.
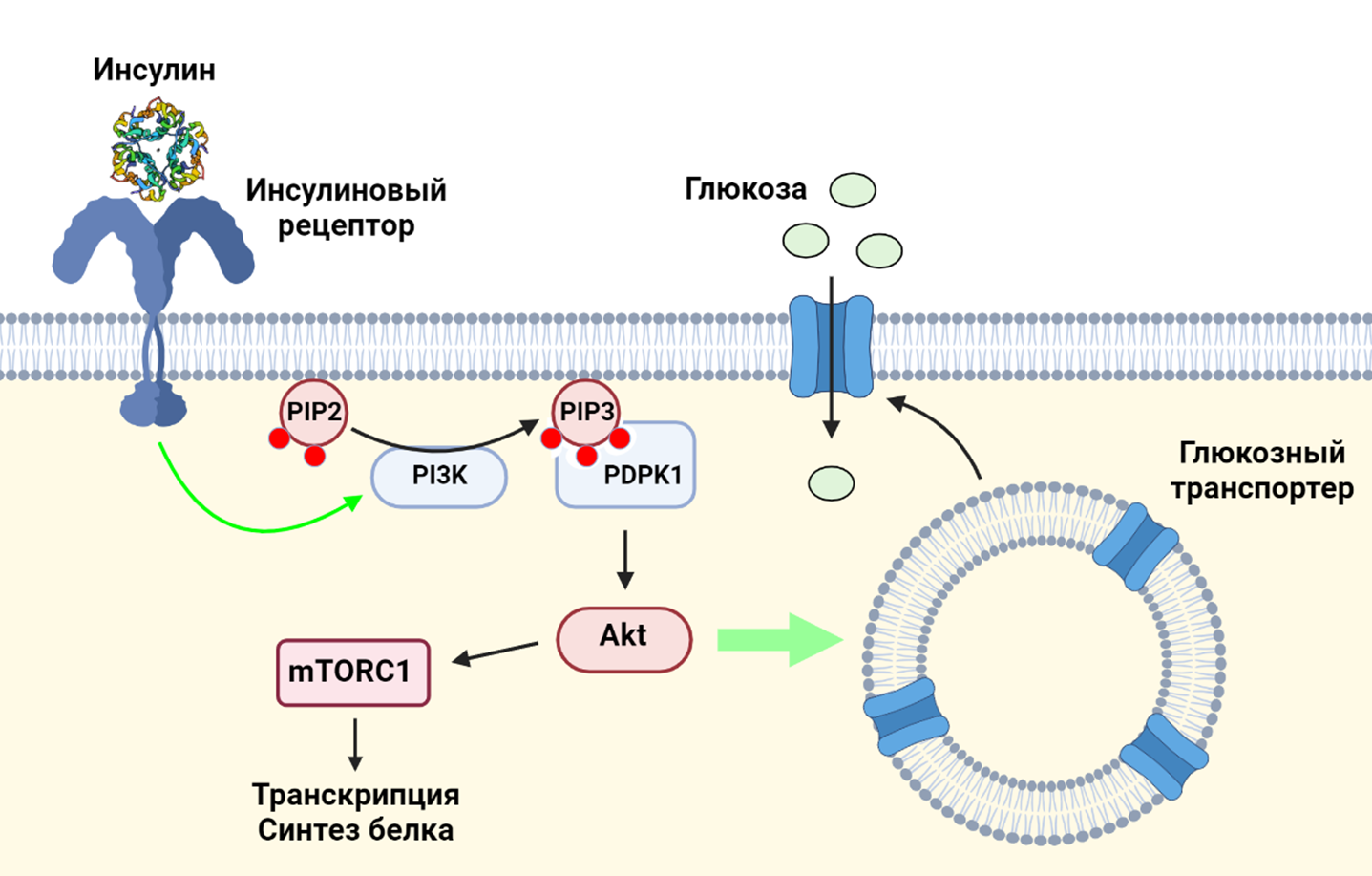
Как известно, повышение уровня глюкозы в крови вызывает секрецию гормона инсулина бета-клетками поджелудочной железы. Инсулин, в свою очередь, взаимодействует с инсулиновыми рецепторами на поверхностях клеток. Взаимодействие инсулина с его рецептором приводит к активации фосфатидилинозитол-3-киназы (PI3K) — ключевого фермента PI3K/AKT/mTOR сигнального пути: работа PI3K делает возможным фосфорилирование протеинкиназы Akt, что приводит, с одной стороны, к транслокации глюкозных транспортеров на клеточную мембрану (и, как следствие, к увеличению поглощения глюкозы клетками), а с другой стороны — к активации протеинкиназы mTORС1, важнейшего регулятора клеточного метаболизма и роста [1].
Рисунок 4. Взаимодействие инсулина и его рецептора приводит к активации фосфатидилинозитол-3-киназы (PI3K), которая фосфорилирует фосфатидилинозитолдифосфат (PIP2). Образовавшийся фосфатидилинозитолтрифосфат (PIP3) нужен для того, чтобы фосфоинозитид-зависимая киназа-1 (PDPK1) активировала протеинкиназу Akt. Akt необходима для стыковки внутриклеточных везикул, несущих глюкозный транспортер, с клеточной мембраной. Также Akt активирует mTORC1.
коллаж авторов статьи. Создан с помощью BioRender.com
Сигнальный путь PI3K/AKT/mTOR играет важную роль в раковых клетках, которые могут активно экспрессировать рецепторы к инсулину и, получая сигналы при их стимуляции, увеличивать темпы роста и размножения.
Снижение уровня глюкозы в крови пациентов рассматривается как одна из потенциальных диетических стратегий при терапии рака. Такой подход ограничит доступность глюкозы для раковых клеток и понизит секрецию инсулина бета-клетками поджелудочной железы. Как можно понизить содержание глюкозы в крови пациентов? Конечно, уменьшение калорийности пищи приведет к снижению уровня глюкозы в крови, но такой способ не может быть оптимальным, так как поставит под угрозу общее состояние пациента. Куда более выгодной стратегией может стать кетогенная диета, которая предполагает ограничение потребления углеводов с одновременным увеличением доли жиров в рационе. Действительно, есть данные доклинических исследований и немногочисленные клинические испытания, которые говорят, что такая диета может способствовать благоприятному исходу болезни — например, при глиобластоме [7]. Однако важно отметить, что некоторые типы опухолей, наоборот, зависят от жирных кислот, а значит, диета, богатая жирами, может опосредовать проканцерогенный эффект [1], о чем мы поговорим чуть далее.
А что насчет других углеводов?
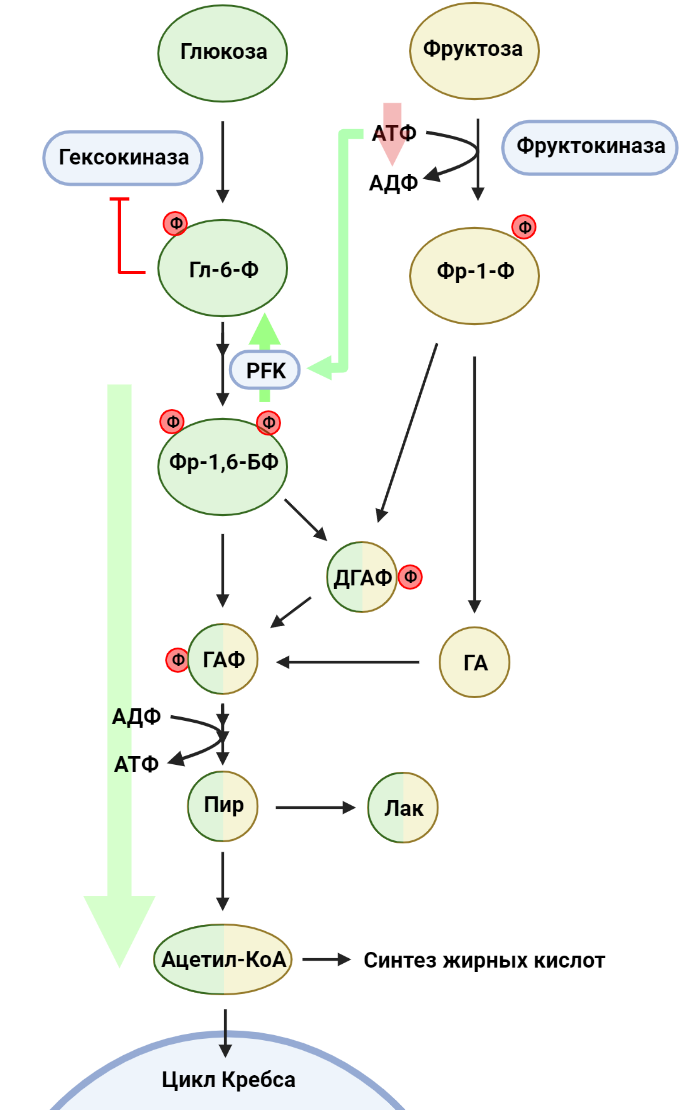
Рисунок 5. Метаболизм фруктозы. В первой стадии гликолиза глюкоза фосфорилируется до глюкозо-6-фосфата (Гл-6-Ф). Параллельно фруктоза фосфорилируется до фруктозо-1-фосфата (Фр-1-Ф). Фруктоза-1,6-бисфосфат (Фр-1,6-БФ), продукт фосфофруктокиназы (PFK), распадается на глицеральдегидфосфат (ГАФ) и дигидроксиацетонфосфат (ДГАФ), а Фр-1,6-БФ расщепляется на ДГАФ и глицеральдегид (ГА). ДГАФ и ГА переходят в ГАФ, который в оставшихся реакциях гликолиза превращается в пируват (ПИР). ПИР может восстановиться до лактата (ЛАК) или подвергаться превращению в ацетил-КоА, соединение, использующееся в многих биохимических процессах.
коллаж авторов статьи. Создан с помощью BioRender.com
Помимо глюкозы, в наш ежедневный рацион входит множество других углеводов. Например, фруктоза, один из наиболее распространенных в природе сахаров, встречается в пище как в свободном виде, так и в составе олигосахаридов, например, сахарозы. Эпидемиологи связывают рост потребления сахаросодержащих напитков с увеличением частоты заболеваемости раком [8]. Более того, оказывается, что даже умеренное потребление фруктозы (эквивалентное одной банке газировки в день) оказывает негативное воздействие и может способствовать росту опухоли, что было отмечено в экспериментах с мышами на примере колоректального рака [9]. Глюкоза эффективно поглощается эпителиальными клетками тонкого кишечника за счет специальных белков, осуществляющих совместный транспорт глюкозы и ионов натрия. При этом транспорт фруктозы опосредуется пассивным транспортером GLUT5 и потому менее эффективен. В результате значительная часть потребляемой фруктозы проходит тонкую кишку и попадает в толстый кишечник. В случае колоректального рака фруктоза становится одним из потенциальных питательных веществ для опухолевых клеток: действительно, раковые клетки в кишечнике активно экспрессируют как GLUT5, так и ферменты, метаболизирующие фруктозу. Глюкоза и фруктоза похожи между собой с точки зрения строения молекул, однако с точки зрения их метаболизма они немного отличаются (рис. 5). Если говорить про глюкозу, то первая стадия гликолиза представляет собой фосфорилирование глюкозы с затратой АТФ и образованием глюкозо-6-фосфата, причем активность гексокиназ (ферментов, осуществляющих эту реакцию) зависит от концентрации глюкозо-6-фосфата в среде: чем больше продукта для фермента, тем менее активно он работает. Это явление — пример отрицательной обратной связи, важного аспекта регуляции активности метаболических путей. Фруктоза же в первую очередь фосфорилируется фруктокиназой до фруктозо-1-фосфата (Фр-1-Ф), также с затратой АТФ, однако в данном случае активность фермента не зависит от концентрации продукта. Это значит, что киназа будет фосфорилировать всю доступную фруктозу, вне зависимости от того, сколько Фр-1-Ф уже было сделано. Следовательно, при повышенной концентрации фруктозы клетка будет тратить много АТФ на ее фосфорилирование. В ответ на понижение уровня АТФ активируется фермент глизолиза фосфофруктокиназа (PFK), а также, помимо этого, продукты расщепления Фр-1-Ф в конечном счете попадают в реакции гликолиза. Таким образом, фруктоза усиливает гликолиз, что на руку раковым клеткам: в случае колоректального рака активация гликолиза способствует индукции синтеза жирных кислот, необходимых для роста опухоли [9].
Надо отметить, что фруктоза, хоть и способствует росту опухолей в случае колоректального рака, для роста и выживания нормальных клеток вовсе не обязательна, так что фармакологическое подавление переносчиков фруктозы и ферментов, участвующих в ее метаболизме (например, фруктокиназы) может препятствовать прогрессии колоректального рака. И конечно же, исключение фруктозы из рациона пациента также может оказывать благотворный эффект на течение болезни. Однако клинических данных, подтверждающих это, пока недостаточно [1].
Еще один любопытный пример связан с маннозой, моносахаридом, который также часто встречается в рационе как в свободном виде, так и в составе полисахаридов. Манноза поглощается теми же транспортерами, что и глюкоза, но затем накапливается в клетках в виде маннозо-6-фосфата и дальше почти не метаболизируется. В то же время, маннозо-6-фосфат ингибирует некоторые ферменты гликолиза (гексокиназу и глюкозоизомеразу), а также глюкозо-6-фосфатдегидрогеназу — первый фермент пентозофосфатного пути, альтернативного способа окисления глюкозы. Таким образом, накопление маннозо-6-фосфат влечет за собой подавление метаболизма глюкозы, что негативно сказывается на жизнеспособности раковых клеток. Однако не все опухоли чувствительны к маннозе. Дело в том, что в клетках есть фермент маннозо-6-фосфат—изомераза (PMI), который катализирует превращение маннозо-6-фосфата в фруктозо-6-фосфат, метаболит гликолиза. Казалось бы, накопление маннозо-6-фосфата перестает быть проблемой для клетки, но дело в том, что разные опухоли имеют разную активность PMI, и если в каких-то опухолевых клетках его активность понижена, то манноза будет подавлять рост опухоли. Оказалось, что колоректальные опухоли обычно имеют очень низкие уровни PMI, и действительно, на мышиной модели колоректального рака было показано, что биодобавки, содержащие маннозу, значительно подавляют рост опухолей и не оказывают отрицательный эффект на здоровье и вес мышей [10]. Возможно, применение маннозы в виде добавок к пище будет повышать эффективность терапии колоректального рака и у людей, но клинических исследований на этот счет еще не проводилось [1].
Жирные кислоты
Жирные кислоты являются важнейшим источником энергии в клетке, особенно для «энергозатратных» тканей вроде скелетной и сердечной мышечных тканей. При окислении жирных кислот (которое в основном происходит в ходе процесса β-окисления) образуются NADH и FADH2, а также ацетил-КоА — вещества, необходимые для синтеза АТФ при окислительном фосфорилировании. Более того, если сравнить между собой жирные кислоты и углеводы, то окажется, что по отношению к своей сухой массе жирные кислоты обеспечивают больше АТФ, чем углеводы, а значит, они лучше подходят на роль запасного питательного вещества (жирные кислоты запасаются в форме триглицеридов в жировой ткани). Разумеется, не могло бы случиться такого, чтобы не нашлось опухолевых клеток, активно использующих жирные кислоты как источник энергии и восстановительных эквивалентов. Действительно, описаны процессы, когда раковая клетка переходит на β-окисление, а также отдельные опухоли, для которых основной источник энергии — это жиры, а не углеводы [1], [11].
Так, было показано, что окисление жирных кислот критично для клеток рака груди при их откреплении от матрикса. Протоки молочных желез выстланы слоем эпителиальных клеток, которые дают начало опухоли. На ранних стадиях развития рака молочной железы опухолевые клетки открепляются от матрикса, покидают свои ниши, начинают пролиферировать в просветах полых железистых структур, заполняя их. Эпителиальные клетки имеют на своей поверхности рецепторы эпидермального фактора роста (epidermal growth factor receptor, EGFR). При стимуляции EGFR, помимо прочего, происходит активация сигнального пути PI3K/AKT/mTOR, что приводит к росту, пролиферации, а также способствует поглощению глюкозы и подавлению апоптоза. Для эпителиальной клетки очень важен контакт с внеклеточным матриксом. Если клетка по какой-либо причине теряет контакт с матриксом, то экспрессия EGFR падает, и, как одно из следствий, клетка начинает испытывать дефицит в глюкозе. В норме эта череда событий непременно приведет к нехватке АТФ, окислительному стрессу, и наконец — к аноикису— гибели клетки, происходящей в ответ на открепление от матрикса. Но опухолевая клетка не так проста и активно пытается спастись от апоптоза. Активность ряда онкогенов в данном случае способствует активации окисления жирных кислот, что обеспечивает клетку энергией и предотвращает гибель [12].
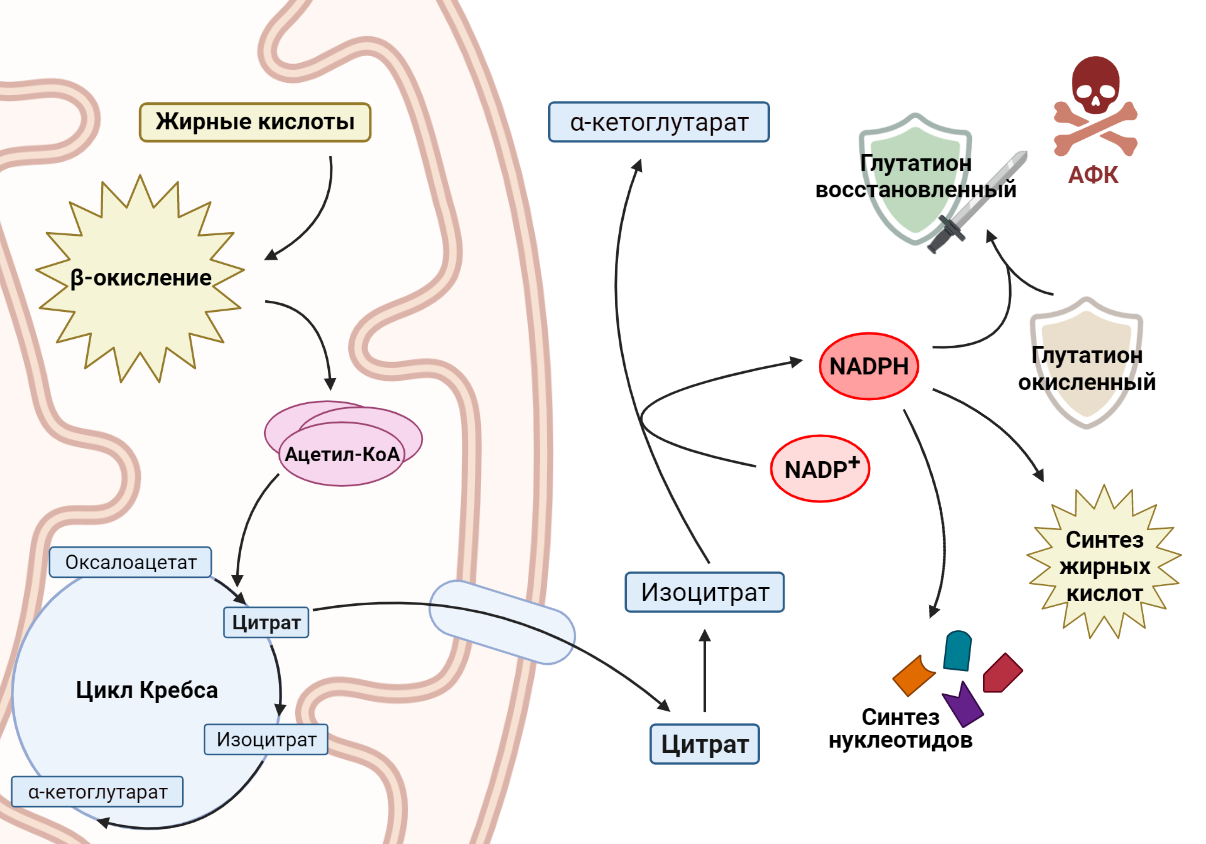
Другой важный пример роли жирных кислот в раковых клетках связан с никотинамидадениндинуклеотидфосфатом (NADPH) — веществом, которое выполняет две основные функции. С одной стороны, он участвует в защите клетки от токсичных активных форм кислорода (АФК), обеспечивая регенерацию антиоксиданта глутатиона (GSH), что особенно важно для выживания раковых клеток в условиях метаболического стресса. С другой стороны, NADPH необходим для синтеза жирных кислот и нуклеотидов, необходимых для поддержания роста и пролиферации клеток, что является неотъемлемой частью биологии опухолевой клетки. Зачастую рост раковой клетки ограничен уровнями NADPH, следовательно, изменения в метаболизме раковой клетки должны учитывать этот важный аспект. Как связаны между собой окисление жирных кислот и производство NADPH? Основным продуктом окисления жиров является ацетил-КоА, который вступает в цикл Кребса и превращается в цитрат. Цитрат может остаться воволеченным в цикл Кребса, а может покинуть митохондрию и выйти в цитоплазму. Там он превратится в изоцитрат, который является субстратом для NADP-зависимой изоцитратдегидрогеназы [13]. Этот фермент окисляет изоцитрат, при этом происходит перенос водорода на NADP+ и образуется NADPH, необходимый раковым клеткам. Например, в клетках глиомы, в которых ингибируется окисление жирных кислот, значительно понижается уровень NADPH, что приводит к накоплению АФК и, как следствие, клеточной гибели [14].
Рисунок 6. Ацетил-КоА, продукт окисления жирных кислот, поступает в цикл Кребса. В то же время цитрат, промежуточное соединение цикла Кребса, покидает митохондрию, где превращается в изоцитрат. При окислении изоцитрата происходит перенос водорода на NADP+, образуется NADPH, необходимый клеткам для множества процессов.
коллаж авторов статьи. Создан с помощью BioRender.com
Из данных примеров мы видим, что в некоторых случаях жирные кислоты способствуют выживанию и метастазированию опухолевых клеток. Это значит, что для отдельных пациентов диета с низким содержанием жиров может оказаться полезной. В то же время, кетогенная диета, которую мы обсуждали в главе про глюкозу, может вызывать непредвиденные проканцерогенные эффекты и способствовать росту опухоли. Таким образом, режим питания пациентов должен подбираться индивидуально с учетом стадии опухоли, ее локализации и особенностей метаболизма.
Аминокислоты
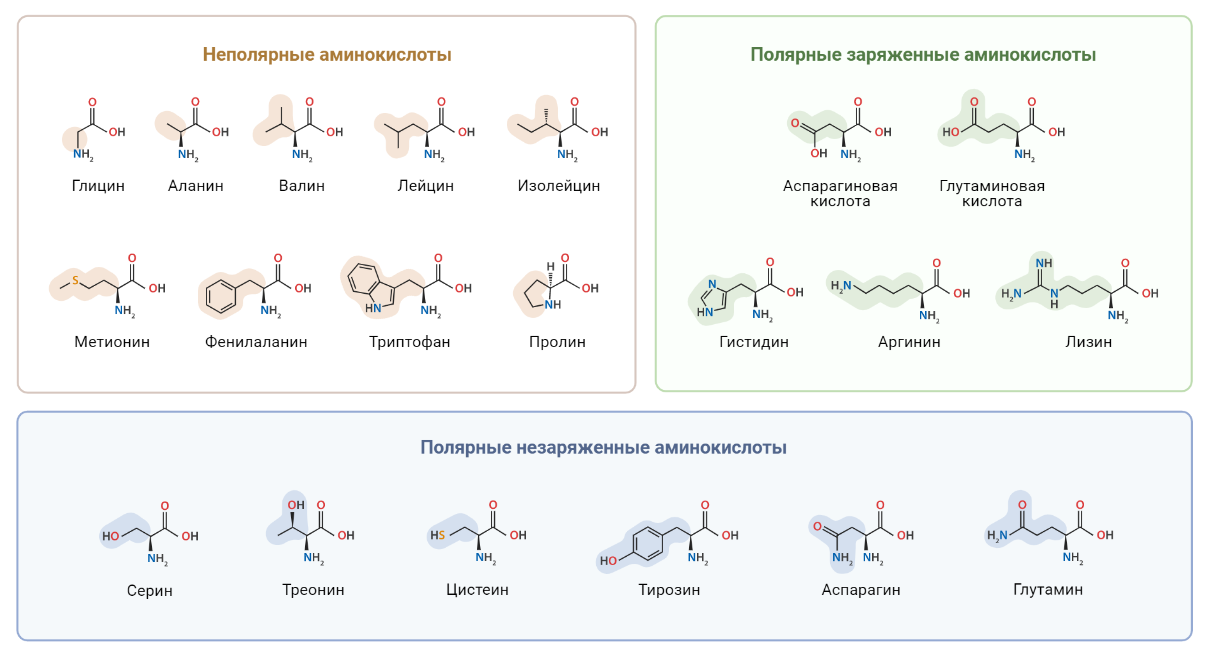
Как известно, белки принимают участие в большинстве клеточных процессов: поддерживают форму клетки, обеспечивают ее подвижность, контролируют работу генов, регулируют метаболические процессы и многое-многое другое. Аминокислоты являются строительными мономерными блоками для белков. Удивительно, что при огромном разнообразии белков, все они построены из довольно ограниченного набора аминокислот (рис. 7).
Рисунок 7. 20 классических аминокислот.
С пищей в организм попадают белки, после чего в желудочно-кишечном тракте они деградируют до отдельных аминокислот. Смесь аминокислот всасывается в тонком кишечнике, поступает в кровь и разносится к каждой клетке организма. В клетках аминокислоты используются уже для синтеза собственных белков, которые необходимы для нормального функционирования организма. Важно отметить, что некоторые из аминокислот клетки нашего организма умеют синтезировать сами (так называемые заменимые аминокислоты), а некоторые непременно должны поступать с пищей (незаменимые аминокислоты). Итак, аминокислоты, которые попали в клетку, могут войти в состав белков, но для нас более интересен тот факт, что отдельные аминокислоты могут выполнять специальные метаболические функции. Далее мы будем рассматривать роль конкретных аминокислот в метаболизме раковых клеток, а также возможные диетические стратегии для пациентов с онкологическими заболеваниями, основанные на ограничении или биодобавках данных аминокислот в рационе.
Метионин
Метионин относится к незаменимым аминокислотам для клеток человека. При этом раковые клетки для своего роста требуют бóльшие количества метионина по сравнению с нормальными клетками. Дело в том, что метионин выполняет ряд регуляторных функций. В клетке есть специальные сенсоры, которые в ответ на высокий уровень метионина (а точнее, его производного — S-аденозилметионина) способны активировать протеинкиназу mTORC1. Эта протеинкиназа крайне важна для раковых клеток: она активирует процесс синтеза белка и, как следствие, ускоряет рост и деление клетки [15]. Кроме этого, S-аденозилметионин является главным донором метильной группы в клетке, то есть обеспечивает метилирование. Метилирование ДНК и гистонов (белков, связанных с ДНК) позволяет «включать» и «выключать» определенные гены. Изменения статуса метилирования гистонов и ДНК регулируют экспрессию генов и вносят свой вклад в рост и развитие опухоли [16]. Начиная с 1990 года проводятся исследования на животных, которые демонстрируют, что ограничение потребления метионина улучшает исход лечения опухолей [1], [17]. Совсем недавно было проведено первое клиническое исследование, которое показало, что снижение количества метионина в рационе пациентов позволяет замедлить прогрессирование опухоли [18]. Таким образом, диетическое ограничение метионина у людей, страдающих онкологическими заболеваниями, является весьма многообещающим подходом [1]. Важно уточнить, что диетическое ограничение тех или иных аминокислот можно осуществить только за счет «искусственных» диет, при которых основным источником белковой пищи являются протеиновые напитки/батончики без содержания определенных аминокислот. Именно такой режим питания соблюдали пациенты, принявшие участие в клиническом испытании диеты с низким содержанием метионина: 75% белковой пищи представляли из себя протеиновые напитки без метионина [18].
Серин
Аминокислота серин принимает участие во множестве метаболических процессов: в синтезе нуклеотидов и липидов; она может превращаться в пируват и поступать в цикл Кребса, и так далее. Серин относится к заменимым аминокислотам и может синтезироваться в нормальных клетках из глюкозы и глицина (самой простой аминокислоты). Для раковых клеток, которые активно используют гликолиз и, соответственно, остро нуждаются в глюкозе, синтез серина из глюкозы непременно обернется потерями в количестве АТФ и скорости размножения. Именно поэтому можно сказать, что для опухолевых клеток серин является незаменимой аминокислотой, то есть обязательно должен поступать извне. Путь синтеза серина из глицина для раковых клеток тоже крайне нежелателен, так как глицин принимает непосредственное участие в синтезе нуклеотидов, а значит, превращение глицина в серин опять же ставит под угрозу скорость деления раковых клеток. Таким образом, ограничение потребление серина действительно может помочь в терапии опухолей. Эффективность такой диеты уже была показана в экспериментах на мышах, но клинических исследований пока не проводилось [1].
Аргинин
В нормальных клетках аргинин способен образовываться de novo, то есть является заменимой аминокислотой. В опухолевых клетках меланомы, гепатоцеллюлярной карциномы и рака простаты синтез аргинина сильно снижен. Это связано с низким уровнем фермента аргининосукцинатсинтетазы, участвующем в образовании аргиинина. Выходит, что некоторые раковые опухоли требуют поступление аргинина извне (для клеток этих опухолей аргинин — незаменимая аминокислота). «Аргининовая зависимость» опухолей может быть использована для терапии, причем как в фармакологических подходах, так и в простом диетическом ограничении аргинина. Про фармакологическое снижение аргинина в раковых клетках уже кое-что известно из научных работ: так, например, препараты, снижающие уровень аргинина в плазме крови пациентов, оказались эффективными при лечении гепатоцеллюлярной карциномы и меланомы [19].
Однако аргинин может негативно сказываться на противоопухолевом иммунитете. Важнейшими клетками, участвующими в борьбе с опухолью, являются T-лимфоциты. Аргинин активно поглощается активированными T-клетками, затем метаболизируется, что приводит к увеличению выживаемости клеток и усилению противоопухолевого Т-клеточного ответа. В мышиной модели рака кожи увеличение количества потребляемого с пищей аргинина привело к уменьшению размера опухолей, способствовало выживанию мышей [20].
Не менее важную роль в противоопухолевом иммунитете играют NK-клетки (Natural killer cells, натуральные киллеры) — иммунные клетки, способные уничтожать опухолевые клетки. Исследования показали, что потребление аргинина с пищей увеличивает количество и активность NK-клеток [21], и, наоборот, дефицит аргинина угнетает работу и жизнеспособность натуральных киллеров [22], что может негативно сказаться на борьбе с опухолью.
Таким образом, аргинин необходим как некоторым опухолям для роста, так и иммунным клеткам, сражающимся с опухолью. По-видимому, только масштабные клинические испытания помогут понять, в каких случаях стоит исключать или, наоборот, увеличивать содержание аргинина в пище для достижения максимального эффекта терапии.
Цистин и цистеин
Одна из важнейших функций аминокислоты цистеина в клетке — защита от активных форм кислорода (например, перекиси водорода), которые повреждают ДНК, липиды и белки, вызывая в клетке окислительный стресс. Раковые клетки, по сравнению с нормальными, испытывают сильный окислительный стресс и требуют большого количества цистеина. Действительно, для некоторых опухолевых клеток снижение уровня цистеина губительно: клетки «сгорают» из-за накопленных активных форм кислорода. Цистеин образуется из неклассической аминокислоты цистина, которая поступает в клетку из плазмы крови [1]. Препараты, снижающие уровень цистина в плазме крови, тормозят рост опухолей с мутантным рецептором эпидермального фактора роста (например, немелкоклеточного рака легких) у мышей [23]. Теоретически, достичь снижения уровня цистина в плазме крови пациентов можно при помощи корректировки диеты, без применения препаратов, но такой подход пока не исследован.
Гистидин
При деградации гистидина в клетке тратится тетрагидрофолат — кофактор, который необходим для синтеза нуклеотидов, а значит, определяет скорость деления раковых клеток. Чем больше в раковую клетку поступает гистидина, тем больше тетрагидрофолата тратится на распад гистидина и тем медленнее клетка делится. Применение гистидина вместе с пищей может помочь в терапии некоторых видов опухолей. В частности, такой диетический подход может стать особенно эффективным при лечении рака химиотерапевтическим агентом — метотрексатом (часто применяется для лечения злокачественных заболеваний крови). Метотрексат нарушает синтез тетрагидрофолата, что приводит к остановке синтеза нуклеотидов и к гибели раковых клеток. Оказалось, что эффективность лечения лейкемии метотрексатом заметно увеличивается при добавлении к пище аминокислоты гистидина — это было показано на мышиной модели [24].
Биодобавки фолиевой кислоты
В заключение мы хотим уделить внимание витаминам. Витамины необходимы для протекания многих биохимических реакций и должны поступать в организм с пищей. Существует распространенное заблуждение о том, что прием витаминных биодобавок может послужить защитой от рака и других заболеваний. На самом деле, витамины должны поступать исключительно с пищей, а дополнительный прием витаминов здоровым людям в основном не рекомендован (за некоторыми редкими исключениями). Регулярный прием биодобавок может оказаться не только неэффективными, но и вредным, особенно людям, страдающим онкологическими заболеваниями. Давайте рассмотрим пример того, как дополнительный прием витаминов способствует росту опухоли.
Фолиевая кислота (фолат, витамин B9) является необходимым веществом для синтеза нуклеотидов. Опухолевые клетки быстро делятся и нуждаются в больших количествах нуклеотидов для синтеза ДНК, поэтому активно потребляют фолат. Еще в 1948 году стало известно, что биодобавки фолиевой кислоты способствуют росту некоторых видов опухолей [25]. На сегодняшний день метаболизм фолиевой кислоты является фармакологической мишенью для терапии рака: упоминавшийся ранее химиотерапевтический препарат метотрексат нарушает метаболизм фолата и ингибирует пути синтеза нуклеотидов. Надо подчеркнуть, что антифолиевая терапия рака пока что является сугубо фармакологической и не предполагает корректировки диеты [1].
Однако потенциальные негативные эффекты фолата в опухолевой прогрессии на этом не заканчиваются. Ряд исследований показал, что присутствие в крови неметаболизированной фолиевой кислоты, связанное с ее избыточным потреблением, влекло за собой снижение количества и активности NK-клеток [26-28]. Упоминавшиеся ранее NK-клетки — это иммунные клетки, одна из основных функций которых состоит в защите организма от раковых клеток. Следовательно, снижение числа и подавление активности NK-клеток может повлечь за собой повышенный риск образования и прогрессии рака, хотя конкретных исследований о влиянии высоких доз фолата на противоопухолевый иммунитет не проводилось.
Таким образом, витамины необходимы для поддержания функций организма, однако чрезмерное потребление некоторых из них может привести к негативным последствиям, в том числе и к прогрессии опухоли, как в случае с витамином B9. Возможно, диета с низким содержанием фолата будет полезной для некоторых пациентов.
Заключение
Мы постарались кратко охарактеризовать некоторые особенности метаболизма опухолевых клеток и роль питательных веществ в прогрессии рака. В заключение мы хотели бы еще раз обратить внимание на то, что не существует какой-либо универсальной диеты для людей, страдающих онкологическими заболеваниями. Это связано с тем, что опухоли сильно различаются по своему метаболизму. Перечисленные диетические подходы пока что не могут использоваться повсеместно, так как перед внедрением любого из них для каждого типа рака, его локализации и стадии заболевания должны быть проведены масштабные клинические испытания, подтверждающие безопасность и эффективность нового метода лечения. Однако, ввиду многообещающих результатов исследований, модификации диеты являются перспективным подходом к лечению рака. Мы уверены, что в скором времени контроль состава диеты пациентов станет важной частью терапии онкологических заболеваний и поможет спасти многие жизни. А пока что давайте просто стараться питаться правильно и вести здоровый образ жизни. Будьте здоровы!
- Naama Kanarek, Boryana Petrova, David M. Sabatini. (2020). Dietary modifications for enhanced cancer therapy. Nature. 579, 507-517;
- Путь клетки «из греков в варяги». Малигнизация: причины и следствия;
- Douglas Hanahan, Robert A Weinberg. (2000). The Hallmarks of Cancer. Cell. 100, 57-70;
- Douglas Hanahan, Robert A. Weinberg. (2011). Hallmarks of Cancer: The Next Generation. Cell. 144, 646-674;
- Метаболизм клетки;
- Вослед Варбургу — последние достижения в изучении биоэнергетики рака;
- Colin E. Champ, Joshua D. Palmer, Jeff S. Volek, Maria Werner-Wasik, David W. Andrews, et. al.. (2014). Targeting metabolism with a ketogenic diet during the treatment of glioblastoma multiforme. J Neurooncol. 117, 125-131;
- Julie K. Bassett, Roger L. Milne, Dallas R. English, Graham G. Giles, Allison M. Hodge. (2020). Consumption of sugar‐sweetened and artificially sweetened soft drinks and risk of cancers not related to obesity. Int. J. Cancer. 146, 3329-3334;
- Marcus D. Goncalves, Changyuan Lu, Jordan Tutnauer, Travis E. Hartman, Seo-Kyoung Hwang, et. al.. (2019). High-fructose corn syrup enhances intestinal tumor growth in mice. Science. 363, 1345-1349;
- Pablo Sierra Gonzalez, James O’Prey, Simone Cardaci, Valentin J. A. Barthet, Jun-ichi Sakamaki, et. al.. (2018). Mannose impairs tumour growth and enhances chemotherapy. Nature. 563, 719-723;
- Arkaitz Carracedo, Lewis C. Cantley, Pier Paolo Pandolfi. (2013). Cancer metabolism: fatty acid oxidation in the limelight. Nat Rev Cancer. 13, 227-232;
- Zachary T. Schafer, Alexandra R. Grassian, Loling Song, Zhenyang Jiang, Zachary Gerhart-Hines, et. al.. (2009). Antioxidant and oncogene rescue of metabolic defects caused by loss of matrix attachment. Nature. 461, 109-113;
- Alessandra Castegna, Pasquale Scarcia, Gennaro Agrimi, Luigi Palmieri, Hanspeter Rottensteiner, et. al.. (2010). Identification and Functional Characterization of a Novel Mitochondrial Carrier for Citrate and Oxoglutarate in Saccharomyces cerevisiae. Journal of Biological Chemistry. 285, 17359-17370;
- Lisa S. Pike, Amy L. Smift, Nicole J. Croteau, David A. Ferrick, Min Wu. (2011). Inhibition of fatty acid oxidation by etomoxir impairs NADPH production and increases reactive oxygen species resulting in ATP depletion and cell death in human glioblastoma cells. Biochimica et Biophysica Acta (BBA) — Bioenergetics. 1807, 726-734;
- Xin Gu, Jose M. Orozco, Robert A. Saxton, Kendall J. Condon, Grace Y. Liu, et. al.. (2017). SAMTOR is an
S
-adenosylmethionine sensor for the mTORC1 pathway. Science. 358, 813-818; - Samantha J. Mentch, Mahya Mehrmohamadi, Lei Huang, Xiaojing Liu, Diwakar Gupta, et. al.. (2015). Histone Methylation Dynamics and Gene Regulation Occur through the Sensing of One-Carbon Metabolism. Cell Metabolism. 22, 861-873;
- Raghu Sinha, Timothy K. Cooper, Connie J. Rogers, Indu Sinha, William J. Turbitt, et. al.. (2014). Dietary methionine restriction inhibits prostatic intraepithelial neoplasia in TRAMP mice. Prostate. 74, 1663-1673;
- Xia Gao, Sydney M. Sanderson, Ziwei Dai, Michael A. Reid, Daniel E. Cooper, et. al.. (2019). Dietary methionine influences therapy in mouse cancer models and alters human metabolism. Nature. 572, 397-401;
- Francesco Izzo, Paolo Marra, Gerardo Beneduce, Giuseppe Castello, Paolo Vallone, et. al.. (2004). Pegylated Arginine Deiminase Treatment of Patients With Unresectable Hepatocellular Carcinoma: Results From Phase I/II Studies. JCO. 22, 1815-1822;
- Roger Geiger, Jan C. Rieckmann, Tobias Wolf, Camilla Basso, Yuehan Feng, et. al.. (2016). L-Arginine Modulates T Cell Metabolism and Enhances Survival and Anti-tumor Activity. Cell. 167, 829-842.e13;
- K.G.M. Park, P.D. Hayes, O. Eremin, H. Sewell, K.G.M. Park, P.J. Garlick. (1991). Stimulation of lymphocyte natural cytotoxicity by L-arginine. The Lancet. 337, 645-646;
- Bruno Lamas, Juliette Vergnaud-Gauduchon, Nicolas Goncalves-Mendes, Olivier Perche, Adrien Rossary, et. al.. (2012). Altered functions of natural killer cells in response to L-Arginine availability. Cellular Immunology. 280, 182-190;
- Ioannis Poursaitidis, Xiaomeng Wang, Thomas Crighton, Christiaan Labuschagne, David Mason, et. al.. (2017). Oncogene-Selective Sensitivity to Synchronous Cell Death following Modulation of the Amino Acid Nutrient Cystine. Cell Reports. 18, 2547-2556;
- Naama Kanarek, Heather R. Keys, Jason R. Cantor, Caroline A. Lewis, Sze Ham Chan, et. al.. (2018). Histidine catabolism is a major determinant of methotrexate sensitivity. Nature. 559, 632-636;
- Sidney Farber, Louis K. Diamond, Robert D. Mercer, Robert F. Sylvester, James A. Wolff. (1948). Temporary Remissions in Acute Leukemia in Children Produced by Folic Acid Antagonist, 4-Aminopteroyl-Glutamic Acid (Aminopterin). N Engl J Med. 238, 787-793;
- Hathairat Sawaengsri, Junpeng Wang, Christina Reginaldo, Josiane Steluti, Dayong Wu, et. al.. (2016). High folic acid intake reduces natural killer cell cytotoxicity in aged mice. The Journal of Nutritional Biochemistry. 30, 102-107;
- Aron M. Troen, Breeana Mitchell, Bess Sorensen, Mark H. Wener, Abbey Johnston, et. al.. (2006). Unmetabolized Folic Acid in Plasma Is Associated with Reduced Natural Killer Cell Cytotoxicity among Postmenopausal Women. The Journal of Nutrition. 136, 189-194;
- Clovis Paniz, Juliano Felix Bertinato, Maylla Rodrigues Lucena, Eduardo De Carli, Patrícia Mendonça da Silva Amorim, et. al.. (2017). A Daily Dose of 5 mg Folic Acid for 90 Days Is Associated with Increased Serum Unmetabolized Folic Acid and Reduced Natural Killer Cell Cytotoxicity in Healthy Brazilian Adults. The Journal of Nutrition. 147, 1677-1685.
Содержание
- Стимуляторы тканевого дыхания
- Ангиопротекторы
- Препараты, способствующие рассасыванию
- Антикоагулянты
- Антиагреганты
- Сосудорасширяющие препараты
- Антисклеротические препараты
- Стимулирующие препараты
- Комплексы витаминов
Заболевания сетчатки и хориоидеи могут протекать в острой и хронической формах. К хроническим заболеваниям относят дистрофии и дегенерации (центральные и периферические), различной природы ангиоретинопатии, неактивные и субактивные фазы хориоретинитов.
Терапия указанных заболеваний сводится к регулярному приему назначенных офтальмологом препаратов. Как правило, рекомендуется дважды в год проходить комплексные курсы, которые включают до пяти наименований препаратов нескольких групп. Таким образом получается: 2 месяца лечение, после которого следует четырехмесячный перерыв. Один из ежегодных курсов терапии лучше совместить с местным лечением – субконъюнктивальными и парабульбарными инъекцими, а на второй ежегодный курс оставить местные инстилляции.
Препараты, назначаемые для ежегодных курсов лечения подразделяются на следующие группы: ретинопротекторы, ангиопротекторы, антикоагулянты, стимулирующие, рассасывающие, улучшающие микроциркуляцию, сосудорасширяющие, витамины и препараты, активирующие дыхание тканей. При этом, один препарат может обладать несколькими определенными свойствами и находиться в разных группах. А средства из одной группы могут совершенно различно действовать на организм. К примеру, препараты сосудорасширяющего действия иногда снижают артериальное давление, никак его не изменяют, а в некоторых случаях — повышают. В связи с этим схемы терапевтических курсов выстраиваются с учетом индивидуальных особенностей конкретного пациента. Во избежание полипрагмазии, всегда лучше подобрать 2 или 3 препарата, которые полностью подойдут пациенту и будут оказывать на его организм необходимое комплексное воздействие.
Стимуляторы тканевого дыхания
С этой целью применяют ферментный препарат Цитохром С, который вырабатывается из сердечной мышцы коров. Действующее вещество является участником акта тканевого дыхания, способно ускорять окислительные реакции. Известно как один из компонентов капель Катахром.
Препарат назначается в инъекциях в/м по 5 мл. Перед началом курса выполняется проба, кратность ежедневных инъекций – 1 или 2. Продолжительность лечения – до 20-ти дней.
Проба обязательна перед каждым лечебным курсом. С ее помощью определяется индивидуальная чувствительность пациента. В качестве теста 0,1 мл Цитохром С вводят внутрь кожи и в течение получаса наблюдают. При возникновении покраснения, зуда или аллергических высыпаний, говорят об индивидуальной непереносимости и назначение аннулируют.
Ангиопротекторы
Это вещества способствующие нормализации проницаемости стенок сосудов, уменьшению отека сосудистой ткани, ускорению процессов обмена в сосудистой стенки. Ангиопротекторным действием в полной мере обладают: витамин Р, противовоспалительные нестероидные препараты, а также приведенные ниже медицинские средства.
Доксиум, главное вещество которого – особая форма кальция добезилат, необходимый для укрепления стенок сосудов. Этот препарат нужен для повышения сопротивляемости капилляров, улучшения микроциркуляции крови, стимуляции в лимфатических сосудах дренажной функции. Он разжижает кровь и незначительно уменьшает агрегацию тромбоцитов, что благотворно отражается на состоянии ткани сетчатки. Не оказывает какого-либо влияния на микроаневризмы и не проникает значимо через гематоэнцефалический барьер.
Таблетированная форма препарата назначается из расчета 0,75-1,0 г в сутки, что составляет 3-4 таблетки, которые пьют после еды. Курс приема довольно длителен и может продолжаться год или полтора.
Среди негативных моментов приема препарата, специалисты отмечают явления диспепсии и кожные высыпания аллергического характера. Это является поводом для снижения дозы или полной его отмены. Не назначается во время беременности.
Аскорбиновая кислота – препарат для нормализации проницаемости капиллярной стенки, улучшения окислительно-восстановительных реакций, регуляции углеводного обмена. Кроме того, аскорбиновая кислота способствует снижению в крови уровня холестерина, ускорению тканевой регенерации, а также стимуляции выработки стероидных гормонов. Такое свойство препарата очень важно при необходимости курса терапии стероидами.
Назначается в инъекциях или в таблетках. Дозировка для таблеток: 0,05-0,1 г до 5 раз ежедневно, при в/м введении 5% раствора — 2,0 мл № 20-30. Возможны и внутривенные инъекции в той же дозе, правда нужно учитывать, что в случае тромбозов, тромбофлебитов или при повышенной свертываемости крови, они противопоказаны.
Флавоноид Рутин — препарат уменьшающий ломкость и проницаемость капилляров, (в комбинации с аскорбиновой кислотой особенно). Вместе с ней является участником окислительно-восстановительных реакций, замедляет действие гиалуронидазы.
Суточная доза Рутина, как правило составляет 0,1 г, назначается в комплексе с аскорбиновой кислотой. Массово производятся таблетки Аскорутин, включающие рутин с аскорбиновой кислотой и глюкозой. Терапевтический курс предполагает их прием по 4 штуки в день. Не имеет противопоказаний или побочных действий.
Троксевазин (венорутон) – препарат близкого к рутину действия. Регулирует проницаемость капилляров, борется с отеками и воспалением тканей. В капсулах, назначают по одной во время еды, курсом на 2-4 недели.
Диваскан – препарат гемостатик, снижающий проницаемость микрососудов. Выпускается в таблетках, которые назначают по одной трижды в день. Пациентам с диабетической ретинопатией или внутриглазными кровоизлияниями рекомендуется принимать без перерывов не менее двух лет.
Дицинон (этамзилат) – вещество, повышающее в капиллярной стенке содержание большой молекулярной массы мукополисахаридов, что увеличивает их устойчивость и нормализует проницаемость. Препарат обладает свойством улучшать микроциркуляцию, нормализует адгезию тромбоцитов, оказывает гемостатическое действие, не способствуя образованию тромбов.
Назначается перорально или в/м. Суточная доза в таблетках составляет 1,5-2,0 г, длительность приема 2-3 месяца. В/м инъекции назначаются на 10-14 дней, их можно сочетать с п/б введением этого препарата в дозе 0,5 мл.
Для предупреждения возникновения кровотечений при хирургических вмешательствах, Дицинон вводят внутримышечно до операции и после нее при опасности послеоперационного кровотечения.
Препарат назначают с осторожностью больным с тромбозами и эмболиями. Побочных действий нет.
Продектин (пармидин) является препаратом-ангиопротектором, действие которого направлено на восстановление микроциркуляции. Он способствует снижению агрегации тромбоцитов, активирует фибриногенез, улучшает состояние сосудистого эндотелия. Продектин имеет выраженное антисклеротическое действие, ускоряет исчезновение признаков интоксикации.
Его прием составляет 4 таблетки ежедневно (1,0 г), курсом до 6 месяцев.
Среди побочных действий отмечают тошноту, изредка кожные аллергические высыпания, головную боль. При снижении дозировки или отмене препарата все явления проходят. Противопоказанием для назначения являются болезни печени.
Эмоксипин способствует снижению вязкости крови, уменьшению проницаемости стенок сосудов, рассасыванию кровоизлияний. Он является ретинопротектором и антиоксидантом, защищает сетчатку от негативного действия яркого света (лазеркоагуляция, солнечные ожоги). Его назначают при кровоизлияниях, ретинопатиях, осложненной миопии, дистрофиях сетчатки, тромбозах ее вен, световых или лучевых ожогах глаз, глаукоме. Также он является компонентом комплексного лечения при лазеркоагуляции.
Назначают по одной инъекции в глаз (субконъюктивально, ретробульбарно, парабульбарно) 1% раствора в дозировке 0,5 мл ежесуточно 10-15 дней. Курс лечения при необходимости продлевают до 30 дней и повторяют несколько раз в год. Иногда препарат применяют в виде глазных капель.
Его побочным действием могут быть: зуд, жжение, болезненность, относящиеся к аллергическим реакциям. Они снимаются применением кортикостероидов. Иногда при инъекциях наблюдается уплотнение тканей орбиты, в последствие рассасывающееся самостоятельно.
Препараты, способствующие рассасыванию
Химотрипсин – средство способствующее расщеплению сгустков крови, экссудатов, фибрина. Назначается в виде в/м инъекций по 5-10 мг на физрастворе, длительностью 20-30 дней.
Фибринолизин – препарат с высокой активностью в отношении свежей крови, поэтому если кровоизлияние произошло недавно, с него и начинают лечение. Назначается в виде п/б инъекций в комплексе с фибринолизином и гепарином на 10-15 дней. Если необходимо, после этого может применяться химотрипсин. Если кровоизлияние произошло давно вводить Фибринолизин нецелесообразно.
Еще один препарат этой группы, Лидаза, при недавних кровоизлияниях противопоказана. А при давнем кровоизлиянии способна спровоцировать его вновь, поэтому также противопоказана.
Антикоагулянты
Гепарин, как активное вещество оказывает многокомпонентное действие: рассасывающее, липотропное, антикоагулянтное. Назначается в виде в/м инъекций по следующей схеме: первые 4 дня по 4 ежедневные инъекции, следующие 4 дня — по 3 инъекции, далее, 4 дня по 2 инъекции и еще 4 дня по 1 инъекции.
Дозировка составляет до 5000 ЕД. В больших дозах препарат не применяется так как возможны осложнения.
Препараты йода назначаются с целью повышения фибринолитической активности крови. Кроме того, они снижают содержание в ней b-липидов и холестерина. Назначают внутрь по 5-10 капель в молоке дважды или трижды в день, либо в форме драже дозировкой по 0,0005 г. Курс лечения составляет не менее одного месяца, проводится с перерывами многие годы.
Антиагреганты
Курантил – препарат замедляющий агрегацию тромбоцитов, что препятствует образованию в сосудах тромбов. Он обладает сосудорасширяющим действием, несколько снижает артериальное давление, уменьшает периферическое сопротивление, способствует улучшению мозгового кровообращения.
Назначается как антиагрегант для предотвращения возникновения тромбозов после операций и при тромбах центральной вены сетчатки. Антиагрегационная активность Курантила близка к ацетилсалициловой кислоте. Однако данный препарат переносится лучше, не имеет ульцерогенных свойств.
Курантил назначают внутрь по 25 мг трижды в сутки длительный период.
Существуют побочные явления приема препарата, хотя они очень редки. К ним относят: покраснение лица из-за сосудорасширяющего действия (кратковременное), учащение пульса, аллергическая сыпь. Не назначается при распространенном атеросклерозе коронарных артерий.
Ацетилсалициловая кислота – противовоспалительный препарат с антитромботическим действием и способностью тормозить агрегацию тромбоцитов. Препарат применяется при тромбозах сосудов сетчатки для предупреждения образования сгустков.
Назначают внутрь по 0,125 г или 1/4 таблетки после еды один раз в день. Применяется длительно.
Тиклид (тиклопедин) обладает способностью подавлять агрегацию эритроцитов и тромбоцитов, активирует синтез простациклина и простагландинов Е1 и D2, улучшает микроциркуляцию. Применяется при ретинопатиях — диабетической и посттромботической.
Тиклид принимают внутрь по 0,25 г вместе с едой дважды в день длительно (до 6 месяцев и дольше) под контролем состава крови и функции печени.
При приеме может возникать понос и боли в эпигастрии. Также возможны явления геморрагий, лейкопения, агранулоцитоз.
Препарат не назначают одновременно с антикоагулянтами или антиагрегантами. Он противопоказан при повышенном риске кровотечения, инсульте, обострении язвы желудка, болезнях печени, беременности и лактации.
Сосудорасширяющие препараты
Циннаризин (стугерон) обладает спазмолитическим действием, уменьшает реакцию кровеносных сосудов на сосудосуживающие вещества. Препарат улучшает микроциркуляцию, разжижает кровь, повышает тканевую устойчивость к гипоксии. Также циннаризин имеет противогистаминные свойства; снижает возбудимость вестибулярного аппарата, тем самым подавляя нистагм. Существенно не влияет на системное АД.
Препарат принимают внутрь после еды по 2 таблетки дважды в сутки. Длительность курса лечения может варьироваться от нескольких недель до нескольких месяцев.
Среди побочных действий препарата стоит отметить сухость во рту, сонливость, возможны расстройства ЖКТ. Циннаризин усиливает действие алкоголя и седативных препаратов. Противопоказаний нет.
Сермион – препарат со спазмолитической активностью в отношении сосудов сетчатки. Применяется при диабетической ретинопатии, дистрофиях роговицы, ишемических поражениях зрительного нерва.
Принимают внутрь до еды трижды в день по 10 мг. Лечение длительное – несколько месяцев.
При возникновении таких явлений как гипотензия, расстройства ЖКТ, головокружение, сонливость либо нарушения сна, кожный зуд, покраснение лица или кожи верхней половины тела, дозировку необходимо уменьшить или отменить препарат.
Кавинтон (винпоцетин) – препарат с сосудорасширяющими свойствами и прямым релаксирующим воздействием на гладкие мышцы. Он улучшает кровоток, способствует утилизации глюкозы, разжижает кровь, снижает агрегацию тромбоцитов, в небольшой степени снижает уровень АД.
Назначается внутрь 2 таблетки после еды дважды в день. Курс приема – 60 дней.
Не назначается пациентам с тяжелой ишемий и аритмиями сердца, беременностью. Противопоказан при низком тонусе сосудов и лабильном АД.
Никотиновая кислота – препарат обладает антипеллагрическим действием, нормализует в крови уровень холестерина, влияет на жировой и углеводный обмен, расширяет сосуды, тормозит симпатическую и возбуждает парасимпатическую нервные системы.
Препарат принимают в таблетках дважды или трижды в день по 0,02-0,05 г. кроме того, его могут назначить в инъекциях по 1-2 мл в/м 10-15 дней.
При офтальмологических патологиях никотиновая кислота, как самостоятельный препарат практически не назначается. Однако, она очень часто входит в состав применяемых комплексов: Ксантинола никотинат, Никоверин, Никошпан.
Нигексин препарат с сосудорасширяющим действием без снижения уровня АД. Назначают курсом до 6 недель по 0,25 г трижды в день.
Компламин – обладает сосудорасширяющим действием на периферические сосуды, улучшает периферическое кровообращение и микроциркуляцию в сосудах сетчатки.
Таблетки принимают не разжевывая после еды, 2-3 штуки за раз. Пациентам с острым инфарктом миокарда, тяжелой сердечной недостаточностью и кровотечениями, Компламин не назначается. При приеме следует соблюдать осторожность людям с язвой желудка и лабильным АД.
Трентал (агапурин, пентоксифиллин) препарат с расширяющим сосуды свойством, за счет чего происходит улучшение снабжения кислородом тканей глаз. Он улучшает микроциркуляцию крови и ее реологические свойства, разжижает кровь и влияет на эластичность эритроцитов.
Принимают в форме таблеток, которые пью не разжевывая после еды. Суточная доза составляет 4 таблетки (0,4 г.).
Прием препарата может сопровождаться побочными эффектами: тошнотой, покраснением лица, головокруженем.
У пациентов с недавно произошедшими кровоизлияниями в сетчатку, массивным кровотечением, тяжелым склерозом сосудов, инфарктом, препарат не применяется.
Антисклеротические препараты
Мисклерон имеет свойство снижать уровень липидов и мочевой кислоты в крови, увеличивать ее вязкость и фибринолитическую активность, уменьшать агрегацию тромбоцитов. Благодаря этому, он широко применяется при диабетической ретинопатии, а также иных состояниях, протекающих с гиперлипидемией.
Препарат рекомендуется принимать трижды в день по 2 капсулы во время или после еды. Курсы лечения обычно составляют 20-30 дней, после чего следует равный перерыв, в год целесообразно пройти 4-6 таких курсов.
Прием Мисклерона может сопровождаться: расстройствами ЖКТ, кожным зудом, мышечной слабостью и болями, увеличением массы тела из-за задержки воды. Длительное применение данного препарата может стать причиной возникновения внутрипеченочного холестаза и желчнокаменной болезни. Поэтому многие страны Европы отказались от его производства.
Препарат нельзя принимать людям с заболеваниями печени и почек, а также при беременности и в период лактации. С осторожностью назначается диабетикам.
Метионин – препарат содержащий незаменимые аминокислоты. Его липотропное действие направлено на удаление избытка жира из печени. Кроме того, у него есть свойство активации гормонов, витаминов и ферментов, обезвреживания токсичных веществ. Метионин применяется при токсических поражениях печени, назначается при сахарном диабете, атеросклерозе (для снижение уровня холестерина крови и повышение содержания фосфолипидов).
Его принимают по 2 таблетки (0,5 г) перед едой 3-4 раза ежедневно, длительностью от 10-ти дней до месяца. Иногда, курс лечения бывает более продолжительным: 10 дней приема таблеток, 10 дней отдыха.
Неприятными последствиями лечения Метионином является возникающая рвота, что требует его отмены.
Стимулирующие препараты
ФиБС представляет собой биогенный стимулятор, производящийся из отгона грязи лиманов. Назначается в терапии блефаритов, конъюнктивитов, кератитов, миопии, помутнения стекловидного тела.
Вводится в виде подкожных инъекций по 1 мл, курс лечения — 30 уколов.
АТФ — вещество, регулирующее энергетический обмен клеточных реакций, в основном при синтезе РНК и ДНК. Благодаря его действию купируются процессы альтерации и экссудации, стимулируется окислительно-восстановительные реакции. Субконъюнктивальное введение АТФ дает его накопление в тканях глаза без возникновения осложнений.
Назначается в субконъюнктивально по 0,2 мл или внутримышечно по 1-2 мл. Курс лечения: 15 субконюнктивальных инъекций или 25 внутримышечных.
Торфот является производным отгона торфа. Показания к его применению, дозировка и курс лечения, аналогичны препарату ФиБС.
Экстракт алоэ – препарат весьма эффективный при лечении ряда заболеваний глаз: блефарит, конъюнктивит, кератит, увеит, прогрессирующая миопия, помутнение стекловидного тела и пр.
Назначается в виде подкожных инъекций в дозировке 1 мл.
Не показан пациентам с тяжелыми сердечно-сосудистые заболеваниями, гипертонией, острыми расстройствами ЖКТ, тяжелыми болезнями почек. А также пожилым людям.
Комплексы витаминов
Это медикаментозные препараты, включающие витамины, аминокислоты, полезные глазам макро- и микроэлементы. Их прием благоприятно отражается на процессах метаболизма и улучшает функциональные способности соединительной ткани, активизируя механизмы сопротивляемости неблагоприятным внешним факторам и процессам старения. Эти препараты стимулируют репарацию и регенерацию, пополняют запасы полезных веществ, ускоряют процессы энергетического обмена на клеточном и молекулярном уровнях, защищают ткани от окислительного воздействия свободных радикалов.
Аевит представляет собой масляный раствор с витаминами Е и А. Токоферол или витамин Е – незаменимый участник окислительных реакций, напрямую влияет на липидный и углеводный обмены, снижает проницаемость сосудистой стенки, активизирует кровообращение на местном уровне. Ретинол, известный, как витамин А участвует во всех видах обмена веществ и окислительных реакций. Его роль в зрительной функции просто огромна, так как без него невозможно производство зрительного пурпура. Прием этих витаминов в комплексе взаимно усиливает действие друг друга.
Комплекс Аевит выпускается в капсулах, которые назначаются по 1 штуке дважды в день вместе с едой, курсом 1 или 1,5 месяца.
Препарат с осторожностью назначается беременным женщинам, людям с холециститом и тиреотоксикозом, а также пациентам с высокой проницаемостью сосудов.
Пангексавит необходим при заболеваниях глаз, сопровождающихся снижением остроты зрения. Его принимают трижды в день по 1 таблетке.
Гептавит рекомендован пациентам с тапеторетинальной абиотрофией, кератомаляцией, кератитом, ксерофтальмией и пр. Его нужно принимать дважды в день по таблетке после еды. Курс приема – не менее 20 — 30 дней.
Декамевит способен активировать процессы обмена веществ, повышать иммунитет и улучшать общее состояние у лиц пожилого возраста. Также его назначают при применении антибактериальных средств, при нервном и физическом истощении, после тяжелых болезней.
Принимают во время еды по таблетке дважды в день, не менее 20 дней.
Гексавит – профилактический препарат, повышающий защитные силы организма при инфекционных и воспалительных заболеваниях, длительном приеме антибактериальных средств. Кроме того, он необходим людям, чей труд требует высокой остроты зрения и предполагает длительные зрительные нагрузки.
Его принимают после еды трижды в день по 1 драже.
Существуют и иные поливитаминные комплексы, которые не имеют специальных офтальмологических показаний, однако они положительно воздействуют на весь организм и глаза, в том числе.
Тауфон – раствор серосодержащей аминокислоты. Это соединение синтезируется организмом при превращении цистеина. Тауфон на местном уровне улучшает процессы перехода энергии, стимулируетпроцессы восстановления и репарации, в случае травматических поражений глазных тканей и дистрофий сетчатки. Способствует снижению уровня внутриглазное давление при заболевании глаукомой. Действующее вещество глазных капель является одним из составляющих парных желчных кислот, которые способствуют эмульгированию жиров.
Препарат может назначаться как в форме глазных капель, так и в инъекциях. При назначении субконъюнктивальных или парабульбарных инъекций, их выполняют 4% раствором Тауфона в дозировке 0,3 мл. Как правило, на курс лечения достаточно 10 уколов.
Если препарат назначен в виде глазных капель, то его инстиллируют от 2 до 4 раз в день по 2-3 капли. Терапия продолжается не менее 3 месяцев.
В некоторых случаях может быть назначено форсированное лечение. Тогда инстилляции капель выполняют в течение часа каждые 15 минут (всего 5 капель). Такая терапия проводится в течение месяца дважды в день (специалисты считают, что подобный метод доставки препарата с успехом заменяет инъекции, ведь препарат способен проникать очень глубоко, достигая даже стекловидного тела и сетчатки).
Большинство современных образованных людей, по крайней мере, что-то слышало о том, что богатые антиоксидантами пищевые продукты и добавки полезны для здоровья. Однако многие, возможно, не совсем понимают, – что вообще такое антиоксиданты и как это работает в организме.
В журнале «Biomolecules» была опубликована статья, в которой, кроме прочего, говорилось о самом словечке «антиоксидант»: это один из наиболее туманных и сбивающих с толку научных терминов, который в специальной литературе до настоящего времени не находит четкого определения.
В данном материале попробуем немного глубже, чем обычно это делается, разобраться в сути понятия «антиоксиданты», в механизме их действия и влияния на здоровье.
Что такое антиоксиданты?
Антиоксиданты – это соединения, способные нейтрализовать свободные радикалы и тем самым снизить или предотвратить повреждение клеток. В свою очередь, свободные радикалы представляют собой молекулы, несущие на внешней орбите один или несколько неспаренных электронов, – что делает их нестабильными и очень реактивными. Уточним, что под реактивностью в данном случае понимается способность свободных радикалов вступать в различные биохимические реакции с другими молекулами.
В организме свободные радикалы образуются в ходе нормальных эндогенных (внутренних) метаболических процессов, включая процессы энергообеспечения. Кроме того, организм вырабатывает свободные радикалы в ответ на внешние, средовые воздействия, а также на факторы, связанные с образом жизни: в качестве примера можно привести пребывание под открытым солнцем, курение, потребление спиртосодержащих напитков, психоэмоциональные перегрузки и т.д.
Антиоксиданты ингибируют (подавляют) процессы окисления, т.е. химические реакции соединения с т.н. активным кислородом. Молекула кислорода с неспаренным электроном – это очень активный свободный радикал. В результате реакций с ним повреждаются клетки, организм «закисливается» и появляются новые нестабильные, высоко реактивные и потому опасные молекулы с неспаренными электронами.
Антиоксиданты взаимодействуют с такими молекулами безопасным для тканей образом, нейтрализуя их до того, как будут повреждены молекулы протеинов (белков), липидов (жиров) или ДНК (дезоксирибонуклеиновая кислота, носитель генетической информации).
Оксидативный стресс (от англ. «stress» – удар, сотрясение, перегрузка, давление и т.п.) возникает при наличии чрезмерного количества свободных радикалов. Такой дисбаланс, в свою очередь, может быть обусловлен либо повышенной продукцией свободных радикалов в организме, либо недостаточностью механизмов антиоксидантной защиты.
Подчеркнем: свободные радикалы не хороши и не плохи. В естественных, нормальных для данного организма концентрациях они необходимы для эффективного и здорового протекания физиологических энергообменных процессов. Опасен лишь избыток свободных радикалов: в этом случае повышается риск развития всевозможных хронических заболеваний, в том числе столь серьезных, как, например, сердечнососудистая или опухолевая патология. Кроме того, в последнее время все большее внимание привлекает теория, согласно которой процессы старения представляют собой не что иное, как прогрессирующий оксидативный стресс.
Системы антиоксидантной защиты
Клетки нашего организма обладают определенными биохимическими механизмами, которые позволяют держать под контролем выработку свободных радикалов. Например, в клетках содержатся особые антиоксидантные энзимы (ферменты, т.е. расщепляющие вещества), снижающие концентрацию молекул с непарными электронами. К первичным антиоксидантным энзимам относятся, в частности, супероксиддисмутаза (SOD), каталаза (CAT), глутатионпероксидаза (GPx) и глутатион редуктаза (GRx). Эти вещества представляют собой, так сказать, первый эшелон антиоксидантной обороны. Они регулируют уровень свободных радикалов, вступая с ними (а также с другими молекулами, которые потенциально могут стать свободными радикалами) в безопасные нейтрализующие реакции.
Аналогичные вещества-регуляторы, – метаболические антиоксиданты, – образуются также в сложных биохимических каскадах обмена веществ. К метаболическим антиоксидантам относят липоевую кислоту, глутатион, коэнзим Q10, мелатонин, мочевую кислоту, Л-аргинин, металл-хелатирующие белки, билирубин, трансферрин.
Вместе с тем, ряд необходимых антиоксидантов сам организм не производит, и получить их мы можем только извне, с пищей или пищевыми добавками. К таким антиоксидантам относятся, в частности, каротиноиды, некоторые витамины с антиоксидантным эффектом (напр., витамины С и Е), селен, марганец, цинк, флавоноиды, жирные кислоты омега-3 и омега-6. Пищевые и дополнительные антиоксиданты неизменно находятся в центре внимания диетологической науки, поскольку укрепить антиоксидантную защиту организма способен лишь рацион, богатый перечисленными соединениями,
Естественные пищевые (нутриентные) антиоксиданты в сравнении с пищевыми добавками
Разобраться в тонкостях циркуляции и взаимодействий антиоксидантов-нутриентов весьма непросто, здесь легко запутаться. С одной стороны, множество веществ и соединений антиоксидантного действия естественным образом присутствует в обычных и привычных нам продуктах питания. С другой, – бесчисленные пищевые добавки рекламируются производителями как незаменимые средства повышения антиоксидантной защиты.
Фрукты, овощи, специи, орехи содержат тысячи различных соединений, обладающих антиоксидантным эффектом. Например, в винограде, яблоках, грушах, вишнях, ягодах содержится группа растительных веществ, называемых полифенольными антиоксидантами, – на сегодняшний день известно более восьми тысяч природных полифенолов-антиоксидантов. Другой класс антиоксидантов, – каротиноиды, – в высоких концентрациях содержится, как правило, в ярко окрашенных фруктах и овощах.
Вместе с тем, эти натуральные антиоксиданты, поступающие в организм с пищей, очень отличаются от биоактивных веществ, которые входят в состав пищевых добавок. Скажем, витамин Е (сложный эфирный ацетат альфа-токоферола) существует во многих формах, как природных, так и синтетических, причем эти формы обладают в организме разным эффектом. Возможно, настолько разным, что становится понятно, почему исследования потенциальной пользы витамина Е для здоровья зачастую приносят противоречивые результаты.
Пищевые добавки обычно содержат высокие дозы изолированных антиоксидантных соединений, которые могут влиять на организм иначе, чем самая богатая антиоксидантами пища. Такая диета чрезвычайна питательна и важна для здоровья, в то время как концентрированные антиоксидантные добавки показаны не всем и, более того, могут оказаться вредоносными для некоторых людей.
Могут ли антиоксиданты нанести вред здоровью?
Должно быть совершенно ясно, что рацион, богатый овощами, фруктами и другими естественными контейнерами антиоксидантов, полезен для общего состояния здоровья.
Профилактический эффект антиоксидантных пищевых добавок, т.е. способность последних предотвращать те или иные заболевания, гораздо менее очевиден.
Многие исследования показали, что в определенных аспектах такие концентрированные добавки также могут быть полезны для здоровья. Подобные выводы публиковались, например, в отношении омега-3 жирных кислот, куркумина, селена, ресвератрола, витамина С, – с описанием различных положительных эффектов, наблюдаемых при тех или иных условиях в различных по составу выборках. Однако отсюда вовсе не следует, что прием дополнительных антиоксидантов безопасен или необходим каждому человеку. Напротив, проводились и такие исследования, результаты которых свидетельствуют о способности некоторых синтетических антиоксидантов конфликтовать с естественными сигнальными путями организма, что в конечном счете оказывает негативное влияние на состояние здоровья.
И даже более того: достоверные научные данные говорят о том, что некоторым категориям населения высокодозовые антиоксидантные добавки попросту противопоказаны. Скажем, у здоровых мужчин добавки с высоким содержанием витамина Е повышают риск рака предстательной железы. Подобно этому, бета-каротиновые добавки связаны с повышенным риском рака легких у заядлых курильщиков.
Добавим, что до сих пор ни одно исследование не выявило каких-либо решающих преимуществ антиоксидантных добавок в плане профилактики заболеваний, но зато есть убедительные доказательства того, что концентрированные дозы витамина Е, витамина А и его предшественника бета-каротина могут повышать вероятность преждевременной смерти.
Возьмем на заметку
Вышеизложенное говорит о том, что бесконтрольный и бездумный прием пищевых добавок, содержащих определенные классы антиоксидантов, может разбалансировать естественные, собственные механизмы антиоксидантной защиты организма, что приведет к серьезным последствиям для здоровья.
И напротив, в постоянно расширяемой базе научных знаний до сих пор не появлялось указаний на то, что богатое антиоксидантами питание, включающее овощи, фрукты, специи, рыбу, орехи, чай и прочие природные источники, каким-то образом может быть связано с негативными эффектами или последствиями в плане здоровья. Именно поэтому ведущие эксперты в области диетологии (подчеркнем: особенно независимые эксперты) настоятельно рекомендуют сосредоточиться на нормализации и оптимизации собственного рациона, чтобы обеспечить достаточное поступление природных антиоксидантов с пищей. Крайне не рекомендуется принимать какие бы то ни было концентрированные антиоксидантные добавки, – за исключением тех случаев, когда это в явной форме предписано врачом.
По материалам сайта Medical News Today

Иммунотерапия препаратом Ниволумаб
Обновлено: 28 апреля 2022
27500
Как действует ниволумаб при раке? О клиническом применении препарата Опдиво, его преимуществах и побочных эффектах рассказывает онколог-химиотерапевт высшей категории Круглова Марина Сергеевна
- arrow_forward
Как действует Ниволумаб? - arrow_forward
Преимущества терапии ниволумабом - arrow_forward
Побочные эффекты ниволумаба
Ниволумаб — противоопухолевый препарат из группы ингибиторов контрольных точек и фактический стимулятор иммунитета. Опдиво — это торговое название, присвоенное компанией-производителем моноклональному человеческому антителу ниволумаб. Антитело представляет собой чистейший и абсолютно однородный по свойствам белок.
Как действует Ниволумаб?
Принцип действия Ниволумаба на опухоль диаметрально отличается от всех прочих иммунологических противоопухолевых препаратов. Доставшиеся нам из прошлого века и до настоящего времени используемые в онкологии цитокины — интерферон-альфа и интерлейкин-2 — синтезированные человеком продукты жизнедеятельности лимфоцитов, доставляемые в организм уже в готовом виде.
Ниволумаб также радикально отличается от механизма действия цитостатиков, суть которых уничтожить опухолевую клетку (цитотоксический эффект) или остановить ее пролиферативную активность (цитостатический эффект).
В конечном итоге Опдиво вынуждает лимфоциты вырабатывать цитокины, но не прямым способом, а помогая лимфоциту выйти из оцепенения, в которое его ввергает злокачественный процесс.
Ниволумаб блокирует взаимодействие между рецептором программируемой смерти (PD-1) и его лигандами (PD-L1 и PD-L2).
PD-1-рецептор является негативным регулятором активности Т-клеток. Связывание PD-1 с лигандами PD-L1 и PD-L2, которые способны экспрессироваться клетками опухолей или иными клетками микроокружения опухолей, приводит к ингибированию пролиферации Т-клеток и секреции цитокинов. Ниволумаб потенцирует иммунный ответ посредством блокады связывания PD-1 с лигандами PD-L1 и PD-L2.
Выражаясь простыми словами, взаимодействие ниволумаба с лимфоцитом осуществляет через специальный рецептор на поверхностной мембране. Занятый им рецептор не может связаться с продуцируемыми опухолевыми клетками и их окружением — лигандами.
Лиганды специально синтезируются для обмана лимфоцита, чтобы он не замечал развитие злокачественного процесса. Связывание лигандов со специальным рецептором PD-1 на поверхности лимфоцита приводит к нарушению его работы и воспроизводства. В результате получается, что опухолевые клетки не замечаются «больным» лимфоцитом и могут спокойно воспроизводить себе подобных.
С помощью ниволумаба лимфоцит «прозревает» и вырабатывает смертельные для раковой клетки цитокины. Если интерферон и интерлейкин вводятся в огромных дозах, то активированный опдиво лимфоцит вырабатывает их без превышения своих функциональных возможностей.
О существовании рецептора можно узнать по присутствию специфического белка PD-1, который имеется у 10–15% больных.
Применение Ниволумаба
Ниволумаб при раке доказал свою эффективность в многочисленных клинических исследованиях по всему миру и сегодня зарегистрирован в России для лечения девяти нозологий:
- 1-я линия терапии почечно-клеточного рака;
- 2-я линия терапии почечно-клеточного рака;
- Метастатическая меланома;
- Адъювантная терапия меланомы;
- Опухоли головы и шеи;
- Мелкоклеточный рак легкого;
- Немелкоклеточный рак легкого;
- Рак желудка или пищеводно-желудочного перехода;
- Рак мочевого пузыря;
- Гепатоцеллюлярный рак;
- Колоректальный рак;
- Лимфома Ходжкина.
Преимущества терапии ниволумабом
Преимущество иммунотерапии состоит в том, что при показаниях, ее можно использовать у ослабленных, возрастных пациентов, с выраженной сопутствующей патологией ввиду меньшей токсичности и более легкой переносимостью.
То есть иммунотерапия дает новые возможности пациентам, которым химиотерапия противопоказана по состоянию здоровья.
Еще одним достоинством иммунотерапии является длительность ответа на лечение. Если по результатам контрольных обследований на иммунотерапии возникает регресс опухоли, то зачастую этот ответ может быть очень длительным.
Как проводится лечение Ниволумабом?
Препарат вводится в виде внутривенной инфузии в течение 30 или 60 минут согласно инструкции. Терапия ниволумабом должна продолжаться до прогрессирования или развития непереносимой токсичности.

Возможность назначать препарат одним из трех одобренных способов введения позволяет врачу подобрать оптимальный режим для каждого конкретного пациента:
- 3 мг/кг каждые 2 недели в течение 60 или 30 минут;
- 240 мг каждые 2 недели в течение 60 или 30 минут;
- 480 мг каждые 4 недели в течение 60 или 30 минут.
Отличие иммунотерапии от химиотерапии заключается в отсутствии специальной пре- и постмедикации. Пациент не нуждается в антиэметогенной терапии, глюкокортикостероидах, антигистаминных, гастропротективных препаратах. Не требуется принимать их для профилактики и между курсами иммунотерапии.
Побочные эффекты ниволумаба
Вторая сторона медали современной иммунотерапии – это побочные эффекты, осложнения, а также иммуноопосредованные нежелательные явления.
Токсичность на фоне иммунотерапии имеет другой профиль, нежели стандартная химиотерапия. Побочные действия ниволумаба связаны с аутоиммунными реакциями на фоне «гиперактивного» иммунитета. Они обусловлены избыточной активацией иммунной системы с аутоиммунным поражением нормальных тканей различных органов и систем.
Осложнения на терапии ниволумабом могут появиться уже в течение 1 недели или только через 54 недели от начала терапии, симптомы могут усиливаться в любой момент времени и приводить к фатальным последствиям.
Наиболее частыми побочными эффектами ниволумаба по результатам клинических исследований являются утомляемость (34%), сыпь (19%), зуд (14%), диарея (13%), тошнота (13%) и снижение аппетита (10%), а также – повышение температуры или озноб с лихорадочным состоянием. В большинстве случаев побочные реакции выражаются от легкой до средней степени тяжести.
Все побочные реакции, включая тяжелые, купируются или при помощи симптоматической терапии, или путем отмены иммунотерапии.
Что делать, если на лечении ниволумабом развились нежелательные явления?
Для того, чтобы устранить побочные эффекты иммунотерапии, необходимо не только знать весь анамнез и сопутствующие заболевания конкретного пациента, но и понимать природу и механизм иммуноопосредованной токсичности.
Крайне важно, чтобы лечение ниволумабом осуществлял онколог, который не только имеет опыт проведения иммунотерапии, но и умеет распознавать ее нежелательные явления на ранней стадии. Своевременное выявление осложнений позволит не только их купировать, но и не прерывать противоопухолевое лечение.
Например, когда мы проводим иммунотерапию в клинике, мы осуществляем тщательный мониторинг показателей систем организма, строго по графикам. Также мы информируем и обучаем пациентов, как оперативно выявить и вовремя среагировать на нежелательные явления, так как своевременная диагностика и надлежащая медикаментозная терапия может улучшить результаты и при этом не окажет негативного влияния на активность иммунного препарата.
Мы накопили большой клинический опыт применения ниволумаба и разработали собственные восстановительные программы и этапы действий для успешного устранения побочных эффектов иммунотерапии. Наш подход – сделать лечение не только эффективным, но и максимально комфортным для вас.
Запишитесь на прием к онкологу по телефону +7 (812) 952-83-73, и мы примем вас в день обращения.
Отзывы
Леонова О.П.
21 августа 2020
Хочу выразить благодарность сотрудникам клиники De Vita и особенно врачу-химиотерапевту Кругловой Марине Сергеевне за квалифицированную помощь, человечное отношение, высокий профессионализм. В тяжелые моменты онкологического лечения необходимы грамотные и своевременные консультации, психологическая помощь и поддержка. Все это было сделано в вашей клинике.
Спасибо вам за ваш опыт, профессионализм, грамотность и человеческое отношение. С уважением,
…
Читать полностью
семья Ивановых
20 августа 2020
Благодаря грамотному лечению, профессионализму и внимательному отношению врача с большой буквы Ирины Александровны, я вернулась к жизни! Спасибо Вам большое, что в самое сложное время для нашей семьи Вы были с нами! Отдельное спасибо хирургу Сергею Александровичу и всему медицинскому персоналу! С уважением, семья Ивановых. Желаем здоровья, долголетия и многомонетия!
…
Читать полностью
Замулина И.В.
7 августа 2020
Благодарю за чуткость, профессионализм, доброе отношение в клинике Де Вита. Очень серьезное лечение прошла легко и без побочных эффектов. Отдельное спасибо за профессионализм Анне Игоревне Буйняковой! С благодарностью,
…
Читать полностью
Вот и закончился мой 12-недельный курс химиотерапии в клинике De Vita.
Все это время сотрудники клиники помогали мне пройти лечение без осложнений и максимально комфортно .
Хочу поблагодарить:
— руководство за безупречную организацию работы и замечательно подобранных сотрудников;
— моего лечащего врача Круглову Марину Сергеевну за профессионализм, внимание и доброе отношение благодаря которому я поверила в лечение и смогла его выдержать;
— замечательных медсестер за золотые руки и сердечность, особенно Анастасию;
— улыбчивых и внимательных менеджеров, которые встречали и провожали меня каждый раз.
Желаю всем работникам крепкого здоровья, хорошего настроения и терпения в нелегком труде.
…
Читать полностью
Елена Викторовна
17 июля 2020
Хочу сказать большое спасибо всем сотрудникам клиники De VIta, это замечательные, внимательные, знающие свое дело люди. Отдельное спасибо моему лечащему врачу Буйняковой А.И. за ее помощь, поддержку и внимание. Доктора знаю уже больше 10 лет и очень ей благодарна за маму, которую она подняла на ноги. Судьба меня свела опять с Анной Игоревной, я очень рада, что эта замечательная женщина, мой лечащий врач. Она не просто профессионал своего дела, а красивая, чуткая женщина. И я от всего сердца хочу поблагодарить ее за все усилия и помощь в лечении. Так же огромное спасибо девочкам мед.сестрам и администраторам за четкую, слаженную работу. Всем сотрудникам клиники желаю успехов, процветания и конечно здоровья.
…
Читать полностью
Григорьева Л.Е.
26 июня 2020
Сегодня 26 июня 2020 года — моя последняя капельница!!! Позади долгий непростой путь длиной в 6 месяцев. И все это время я чувствовала огромную поддержку и внимание своего доктора Буйняковой Анны Игоревны.
Уважаемая, дорогая Анна Игоревна! Огромное Вам спасибо и низкий поклон за Вашу отзывчивость, Ваш профессионализм, чуткость, внимательность, ответственность, за позитивный настрой! Хочется поблагодарить медсестру Людмилу за ее «волшебные руки», внимательность, ответственное отношение к больным. Спасибо девушкам администраторам Яне и Марии, Вале за доброжелательность и внимание, четкую слаженную работу, а также психологу А.А. Ястребовой за моральную поддержку. Желаю всем сотрудникам ДеВита успехов, процветания, здоровья!
…
Читать полностью
семья Чаусовых
21 июня 2020
Наша семья выражает благодарность Уваровой Светлане Николаевне, Кругловой Марине Сергеевне и всему персоналу онкологического центра за отзывчивость, доброжелательность, высокий профессионализм. Поздравляем Вас с Днем Медицинского работника! Пусть всё сделанное Вами добро возвращается к Вам многократно в виде здоровья и долголетия!!
…
Читать полностью
Спасибо всей команде De Vita за работу и отношение. Особенно благодарю Андрея Сергеевича за профессионализм и поддержку! Спокойствие и уверенность врача передаётся пациенту, мне это очень помогло. В такой трудной ситуации сходишь с ума, здесь я получила помощь! А также все ответы на свои вопросы, заботу, хорошее лечение и только позитивный заряд. Спасибо!
…
Читать полностью
Поздравляю клинику с днём рождения и хочу сердечно поблагодарить химиотерапевта Анну Игоревну Буйнякову за высокий профессионализм, за помощь и поддержку в непростой «химический» период. Ни один вопрос не остался без ответа, Анна Игоревна практически провела меня за руку через всю химию. Спасибо Вам огромное за это!
Также благодарю и хочу отметить медсестру Людмилу, ее отличную работу и душевность. Очень хорошее и приятное впечатление от всех, с кем пришлось разговаривать и встречаться в клинике. Хорошие и комфортные условия для лечения такого коварного заболевания. Вы даёте уверенность в победе! Низкий поклон вам!
Татьяна, Великий Новгород.
…
Читать полностью
Юдина Наталия Андреевна
15 мая 2020
Всех сотрудников De Vita хочу поблагодарить за внимательное и чуткое отношение к запросам и потребностям клиентов. Отдельная огромная-преогромная благодарность лечащему врачу Буйняковой Анне Игоревне за профессионализм, отзывчивость, внимательность, за веру в возможности пациента, за готовность прийти на помощь а любое время суток. Здоровья Вам, успехов, всех благ.! Спасибо Вам большое.
С уважением,
…
Читать полностью