Иринэкс — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-006083
Торговое наименование:
Иринэкс
Международное непатентованное наименование:
эренумаб
Лекарственная форма:
раствор для подкожного введения
Состав
1 мл препарата содержит:
действующее вещество: эренумаб 70 мг;
вспомогательные вещества: сахароза, полисорбат-80, уксусная кислота ледяная, натрия гидроксид, вода для инъекций.
Описание
Раствор от бесцветного до светло-желтого цвета.
Характеристика препарата
Эренумаб представляет собой человеческое моноклональное антитело класса G2 (IgG2), с высокой аффинностью связывающееся с рецептором кальцитонин-ген-родственного пептида (CGRP). Эренумаб состоит из 2 тяжелых цепей, в каждой из которых содержится по 456 аминокислот и 2 легких цепей подкласса лямбда, состоящих из 216 аминокислот. Приблизительная молекулярная масса составляет 150 кДа. Эренумаб производятся по технологии рекомбинантной ДНК в клетках яичников китайского хомячка (СНО).
Фармакотерапевтическая группа:
Прочие противомигренозные препараты.
Код ATX:
N02CX07
Фармакологические свойства
Механизм действия
Эренумаб – это человеческое моноклональное антитело, являющееся антагонистом рецептора CGRP, и не обладает значимой фармакологической активностью в отношении рецепторов адреномедуллина, кальцитонина и амилина, а также агонистической активностью в отношении рецептора CGRP.
CGRP – это нейропептид, модулирующий передачу ноцицептивных сигналов, и вазодилататор, связанный с патофизиологией мигрени. Показано, что в отличие от других нейропептидов, концентрация CGRP значительно увеличивается во время приступа мигрени и возвращается к норме после его разрешения. Внутривенное (в/в) введение CGRP вызывает у пациентов мигренеподобную головную боль, из чего можно предположить, что CGRP может являться причиной возникновения мигрени.
Рецептор к CGRP локализуется на участках, имеющих отношение к патофизиологии мигрени. Эренумаб является мощным и специфичным конкурентом CGRP за связывание с рецептором и тем самым подавляет его действие на рецептор.
Фармакодинамика
В рандомизированном двойном слепом плацебо-контролируемом исследовании по оценке эффективности однократного в/в введения эренумаба в дозе 140 мг у пациентов со стабильной стенокардией не отмечалось снижения переносимости физической нагрузки при нагрузочной ЭКГ-пробе (на тредмил-тесте) по сравнению с плацебо и усугубления ишемии миокарда.
Клинические данные
Эренумаб оценивался в 3 базовых исследованиях по изучению профилактического лечения эпизодической и хронической мигрени. В исследования были включены пациенты с мигренью с аурой или без ауры в анамнезе в соответствии с диагностическими критериями Международной классификации головной боли (the International Classification of Headache Disorders, ICHD-III).
Эренумаб продемонстрировал статистически и клинически значимые улучшения ключевых показателей эффективности по сравнению с плацебо.
Хроническая мигрень
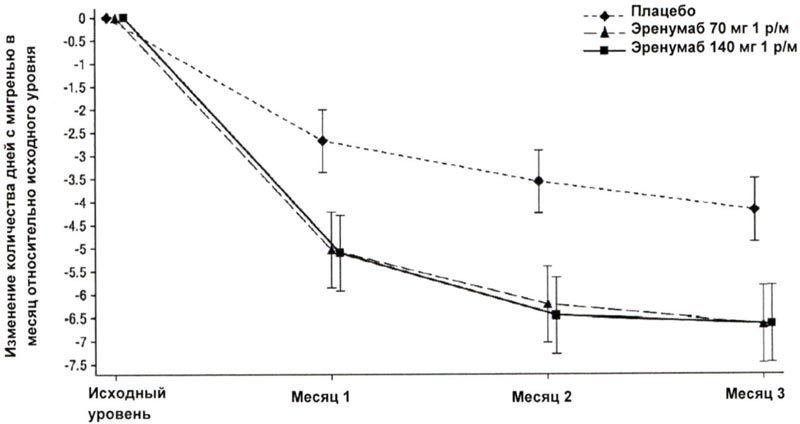
В клиническом исследовании пациентов с хронической мигренью эффективность применения препарата оценивалась на основании изменения количества дней с мигренью в течение месяца (ДММ) к 3 месяцу по сравнению с таковым показателем до лечения эренумабом (исходный уровень). Вторичными показателями эффективности служили снижение количества ДММ на 50-100% относительно исходного уровня (ответ ≥50%), изменение относительно исходного уровня количества дней в течение месяца, в которые пациенты применяли специфические препараты для купирования приступа мигрени. На рисунке 1 и в таблице 1 приведены ключевые результаты исследования. Анализ ежемесячных изменений показал, что среднемесячное количество дней с мигренью снизилось по сравнению с плацебо уже в первый месяц, а последующий анализ еженедельных изменений показал, что эффект эренумаба развивался уже на первой неделе после инъекции.
Рисунок 1. Динамика изменения количества ДММ относительно исходного уровня у пациентов с хронической мигренью.
a Представлены среднеквадратичные средние значения и 95%-ные доверительные интервалы.
Все p-значения для разницы в среднеквадратичных средних между группами эренумаба и плацебо, которые оценивали в месяц 3 (главный показатель эффективности), составляли <0,001.
Таблица 1. Конечные точки эффективности в месяц 3 в исследовании у пациентов с хронической мигренью.
| Эренумаб 70 мг (n=188) | Эренумаб 140 мг (n = 187) | Плацебо (n = 281) | Межгрупповая разница/ Отношение шансов | pa | |
| ДММ | |||||
| Среднее изменениеb (95% ДИ) | -6,64
(-7,47; -5,81) |
-6,63
(-7,45; -5,80) |
-4,18
(-4,86; -3,50) |
70 мг -2,46 (-3,52; -1,39) 140 мг -2,45 (-3,51; -1,38) |
<0,001 |
| Пациенты, у которых показатель ДММ изменился на ≥50% | |||||
| % | 39,9 | 41,2 | 23,5 | ||
| Отношение шансовc (95% ДИ) | 70 мг 2,18 (1,46; 3,27) 140 мг 2,34 (1,56; 3,51) |
<0,001 | |||
| Пациенты, у которых показатель ДММ изменился на ≥75%d | |||||
| % | 17,0 | 20,9 | 7,8 | ||
| Отношение шансов (95% ДИ) | 70 мг 2,43 (1,36; 4,33) 140 мг 3,13 (1,78; 5,48) |
Не применимо | |||
| Количество дней в течение месяца, в которые пациенты применяли специфические препараты для купирования приступа мигрениe | |||||
| Среднее изменениеb (95% ДИ) | -3,45
(-4,02; -2,87) |
-4,13
(-4,70; -3,56) |
-1,58
(-2,05;-1,11) |
70 мг -1,86 (-2,60; -1,13) 140 мг -2,55 (-3,28; -1,82) |
<0,001 |
| Результаты субъективных ответов пациентов | |||||
| HIT 6 | |||||
| Среднее изменениеb (95% ДИ) | -5,6
(-6,5; -4,6) |
-5,6
(-6,5;-4,6) |
-3,1
(-3,9; -2,3) |
70 мг -2,5 (-3,7; -1,2) 140 мг -2,5 (-3,7; -1,2) |
Не применимо |
| Суммарный показатель MIDAS | |||||
| Среднее изменениеb (95% ДИ) | -19,41
(-25,19; -13,62) |
-19,76
(-25,56; -13,97) |
-7,54
(-12,40; -2,69) |
70 мг -11,86 (-19,34; -4,39) 140 мг -12,22 (-19,64; -4,75) |
Не применимо |
ДИ – доверительный интервал; ДММ – количество дней с мигренью в течение месяца.
a Все p-значения представлены в виде нескорректированных значений и после коррекции на множественность сравнений являются статистически значимыми.
b Среднеквадратичное среднее изменение к месяцу 3 относительно исходного уровня, межгрупповая разница и p-значение основаны на линейной модели смешанных эффектов, в которую включены исследуемая группа, среднемесячное значение на исходном уровне, факторы стратификации (регион [Северная Америка или Европа] и злоупотребление лекарственными препаратами [имеется или отсутствует]), плановый визит и взаимодействие «исследуемая группа-плановый визит»; вменения отсутствующих данных не проводили.
c Отношение шансов и p-значение для пациентов с ответом ≥50% к 3 месяцу основано на стратифицированном критерии Кохрана-Мэнтела-Ханцеля после вменения отсутствующих данных, которые считались отсутствием ответа.
d Апостериорный анализ; никакой проверки гипотезы не проводили.
e К специфическим препаратам от мигрени относятся триптаны и производные эрготамина.
У пациентов, у которых не было достигнуто клинического ответа на один или несколько методов профилактической терапии, разница в сокращении ДММ, наблюдаемая между дозой 140 мг и плацебо, составляла -3,3 дня (95% ДИ: -4,6; -2,1), а между дозой 70 мг и плацебо – -2,5 дня (95% ДИ: -3,8; -1,2). У пациентов, у которых не было достигнуто клинического ответа на два или более метода профилактической терапии, разница ДММ составляла -4,3 дня (95% ДИ: -5,8; -2,8) между дозой 140 мг и плацебо и -2,7 дня (95% ДИ: -4,2; -1,2) между дозой 70 мг и плацебо соответственно. Доля пациентов, получавших эренумаб, которые достигли по меньшей мере 50% сокращения ДММ, была выше по сравнению с группой плацебо среди пациентов, не достигших клинического ответа на один или несколько методов профилактической терапии (40,8% для дозы 140 мг и 34,7% для дозы 70 мг против 17,3% для плацебо), с отношением шансов 3,3 (95% ДИ: 2,0; 5,5) для дозы 140 мг и 2,6 (95% ДИ: 1,6; 4,5) для дозы 70 мг. У пациентов, не достигших клинического ответа после применения двух или более методов профилактической терапии, доля составила 41,3% для дозы 140 мг и 35,6% для дозы 70 мг против 14,2% для плацебо с отношением шансов 4,2 (95% ДИ: 2,2; 7,9) и 3,5 (95% ДИ: 1,8; 6,6) соответственно.
Эпизодическая мигрень
В клиническом исследовании пациентов с эпизодической мигренью эффективность применения препарата оценивалась на основании изменения среднемесячного количества дней с мигренью в течение месяцев 4-6 относительно исходного уровня. Вторичными показателями эффективности служили снижение на 50-100% относительно исходного уровня среднего количества ДММ (ответ ≥50%), изменение относительно исходного уровня среднего количества дней в течение месяца, в которые пациенты применяли специфические препараты для купирования приступа мигрени, и изменение относительно исходного уровня показателей по двум доменам опросника MPFID (Дневник влияния мигрени на физическую активность), связанных с ухудшением физического состояния (УФС) и повседневной активностью (ПА). Опросник MPFID – это инструмент для оценки исходов, сообщаемых пациентами, который позволяет измерить влияние мигрени на физическое функционирование (физическую активность). Он содержит 13 пунктов для оценки влияния мигрени в течение прошедших 24 часов на два аспекта физического функционирования, представляющих интерес – влияние на повседневную активность (ПА: 7 пунктов, например трудности с выполнением действий, требующих концентрации внимания) и ухудшение физического состояния (УФС: 5 пунктов, например трудности с выполнением действий, требующих физических усилий), а также один общий пункт для оценки влияния на повседневную активность в целом. Пациенты ежедневно оценивают время, в течение которого они ощущали влияние мигрени, или уровень затруднений, связанных с мигренью. Показатели по шкале MPFID за месяц усредняются по дням с мигренью и без мигрени; при этом чем выше показатель, тем в большей степени мигрень влияет на домены ПА и УФС.
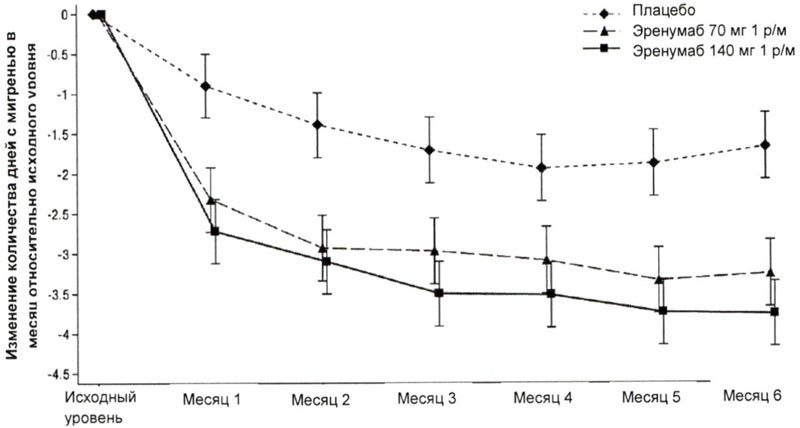
На рисунке 2 и в таблице 2 приведены ключевые результаты исследования.
Рисунок 2. Динамика изменения количества дней с мигренью в течение месяца относительно исходного уровня в исследовании пациентов с эпизодической мигренью.
Таблица 2. Конечные точки эффективности в месяцы 4-6 исследования пациентов с эпизодической мигренью.
| Эренумаб 70 мг (n = 312) | Эренумаб 140 мг (n = 318) | Плацебо (n = 316) | Межгрупповая разница/ Отношение шансов | р-значениеa | |
| Количество дней с мигренью в течение месяца (ДММ) | |||||
| Среднее изменениеb 95% ДИ | -3,23
(-3,58; -2,88) |
-3,67
(-4,02, -3,33) |
-1,83
(-2,18, -1,48) |
70 мг 1,40 (-1,88; -0,92) 140 мг -1,85 (-2,33; -1,37) |
<0,001 |
| Пациенты, у которых показатель ДММ изменился на ≥50% | |||||
| % | 43,3 | 50,0 | 26,6 | ||
| Отношение шансовc 95% ДИ | 70 мг 2,13 (1,52; 2,98) 140 мг 2,81 (2,01; 3,94) |
<0,001 | |||
| Пациенты, у которых показатель ДММ изменился на ≥75%d | |||||
| % | 20,8 | 22,0 | 7,9 | ||
| Отношение шансов 95% ДИ | 70 мг 3,14 (1,91; 5,18) 140 мг 3,35 (2,05; 5,49) |
Не применимо | |||
| Количество дней в течение месяца, в которые пациенты применяли специфические препараты для купирования приступа мигрениe | |||||
| Среднее изменениеb 95% ДИ | -1,13
(-1,34; -0,92) |
-1,61
(-1,83; -1,40) |
-0,20
(-0,41; 0,02) |
70 мг -0,94 (-1,23; -0,64) 140 мг -1,42 (-1,71; -1,12) |
<0,001 |
| Показатель по домену ухудшения физического состояния шкалы MPFID | |||||
| Среднее изменениеb 95% ДИ | -4,24 (-5,02; -3,45) |
-4,81
(-5,59; -4,03) |
-2,38
(-3,16; -1,59) |
70 мг -2,22 (-3,28; -1,16) 140 мг |
<0,001 |
| Влияние на показатель по домену повседневной активности шкалы MPFID | |||||
| Среднее изменениеb 95% ДИ | -5,52 (-6,28; -4,75) |
-5,86
(-6,62; -5,10) |
-3,30
(-4,06; -2,53) |
-2,22 (-3,28, -1,16) -2,57 (-3,62; -1,51) |
<0,001 |
| HIT 6 | |||||
| Среднее изменение 95% ДИ | -6,7
(-7,4; -6,0) |
-6,9
(-7,6; -6,3) |
-4,6
(-5,3; -4,0) |
70 мг -2,1 (-3,0; -1,1) 140 мг -2,3 (-3,2; -1,3) |
Не применимо |
| Суммарный показатель MIDAS | |||||
| Среднее изменение 95% ДИ | -6,7
(-7,6; -5,9) |
-7,5
(-8,3; -6,6) |
-4,6
(-5,5; -3,8) |
70 мг -2,1 (-3,3; -0,9) 140 мг -2,8 (-4,0; -1,7) |
Не применимо |
| Ответ по домену ухудшения физического состояния шкалы MPFID | |||||
| %f | 39,1 | 42,5 | 30,1 | ||
| Отношение шансов 95% ДИ | 70 мг 1,49 (1,07; 2,08) 140 мг 1,73 (1,24; 2,40) |
||||
| Ответ по влиянию на показатель по домену повседневной активности шкалы MPFID | |||||
| %f | 49,0 | 50,3 | 34,5 | ||
| Отношение шансов 95% ДИ | 70 мг 1,83 (1,33; 2,52) 140 мг 1,93 (1,40; 2,67) |
ДИ – доверительный интервал; ДММ – количество дней с мигренью в течение месяца; MPFID – дневник влияния мигрени на физическую активность
a Все p-значения представлены в виде нескорректированных значений и после коррекции на множественность сравнений являются статистически значимыми.
b Среднеквадратичное среднее изменение в месяцы 4-6 относительно исходного уровня, межгрупповая разница и p-значение основаны на линейной модели смешанных эффектов, в которую включены исследуемая группа, значение на исходном уровне, факторы стратификации (регион [Северная Америка или другой] и применение в прошлом лекарственных препаратов для профилактики мигрени [применялись, применялись в прошлом, применяются в настоящее время в качестве сопутствующих препаратов]), плановый визит и взаимодействие «исследуемая группа-плановый визит»; вменения отсутствующих данных не проводили.
c Отношение шансов и p-значение для пациентов с ответом ≥50% в месяцы 4-6 основано на стратифицированном критерии Кохрана-Мэнтела-Ханцеля после вменения отсутствующих данных, которые считались отсутствием ответа.
d Апостериорный анализ; никакой проверки гипотезы не проводили.
e К специфическим препаратам от мигрени относятся триптаны и производные эрготамина.
f Снижение на ≥5 среднего месячного показателя УФС и ПА по сравнению с исходным показателем.
У пациентов, у которых не было достигнуто клинического ответа на один или несколько методов профилактического лечения, разница сокращения ДММ, наблюдаемая между дозой 140 мг и плацебо, составила -2,5 (95% ДИ: -3,4; -1,7) и между дозой 70 мг и плацебо -2,0 (95% ДИ: -2,8; -1,2). Также доля пациентов, у которых достигнуто сокращение ДММ на 50% была больше по сравнению с группой плацебо (39,7% для 140 мг и 38,6% для 70 мг, при отношении шансов 3,1 [95% ДИ: 1,7; 5,5] и 2,9 [95% ДИ: 1,6; 5,3] соответственно).
Фармакокинетика
Эренумаб характеризуется нелинейной кинетикой, что обусловлено его связыванием с рецептором CGRP. У здоровых добровольцев, которым подкожно (п/к) вводили препарат в дозе 70 мг или 140 мг, среднее значение максимальной концентрации (Сmax) составляло соответственно 6,1 мкг/мл и 15,8 мкг/мл (стандартное отклонение [SD]) 2,1 мкг/мл и 4,8 мкг/мл), а среднее значение площади под кривой “концентрация-время” (AUClast – 159 сут*мкг/мл и 505 сут*мкг/мл (SD 58 сут*мкг/мл и 139 сут*мкг/мл) соответственно.
У пациентов, получавших препарат в дозе 70 мг или 140 мг п/к каждые 4 недели, минимальная концентрация (Cmin) в сыворотке крови со временем увеличивалась менее чем в 2 раза (Cmin [SD] 5,7 [3,1] и 6,2 [2,9] мкг/мл для пациентов с эпизодической и хронической мигренью, получавших 70 мг, соответственно, Cmin [SD] 12,8 [6,53] и 14,9 [6,45] мкг/мл для пациентов с эпизодической и хронической мигренью, получавших 140 мг, соответственно) и достигала равновесного состояния через 12 недель после начала лечения. Эффективный период полувыведения эренумаба составляет 28 дней.
Всасывание
У здоровых добровольцев взрослого возраста, получавших однократную п/к инъекцию эренумаба в дозе 70 мг или 140 мг, медиана Сmax в плазме крови достигалась приблизительно через 6 дней, а расчетная абсолютная биодоступность составляла 82%.
Распределение
После однократного в/в введения в дозе 140 мг средний объем распределения в терминальной фазе выведения (Vz) составлял около 3,86 л (SD = 0,77).
Метаболизм и выведение
Выведение эренумаба описывается двухфазной кривой. При низких концентрациях выведение происходит преимущественно за счет насыщаемого связывания с мишенью (рецептором CGRP), в то время как при более высоких концентрациях – преимущественно за счет неспецифического ненасыщаемого протеолиза.
Фармакокинетика у особых групп пациентов
По данным популяционного фармакокинетического анализа у групп пациентов, которым показан эренумаб, его фармакокинетические параметры не зависели от возраста, пола, расы, подтипа мигрени (эпизодическая или хроническая) или клиренса креатинина.
Показания к применению
Препарат применяется для профилактики мигрени у взрослых, которые имеют по крайней мере 4 дня мигрени в течение месяца.
Противопоказания
Повышенная чувствительность к действующему или вспомогательным веществам, входящим в состав препарата.
Опыт медицинского применения у детей отсутствует.
Применение при беременности и в период грудного вскармливания
Беременность
Адекватных и строго контролируемых исследований по применению эренумаба у беременных женщин не проводилось. В исследовании репродуктивной токсичности у яванских макак, в которых животные получали эренумаб во время беременности, а его экспозиция (оцениваемая по AUC) в 40 или 17 раз превышала таковую у пациентов, получающих эренумаб в дозе 70 мг или 140 мг 1 раз в месяц соответственно, не было выявлено никаких эффектов в отношении беременности, эмбриофетального или постнатального развития (до 6-месячного возраста). У только что родившихся обезьян определялись существенные концентрации эренумаба в сыворотке крови, подтверждая, что эренумаб, как и другие антитела IgG класса, проникает через плацентарный барьер.
Повреждающее действие эренумаба на плод в случае его применения у женщин во время беременности неизвестно, так как исследования на животных не всегда позволяют предсказать эффект лекарственного препарата у человека. В качестве меры предосторожности желательно избегать применения препарата во время беременности.
Применение эренумаба во время беременности возможно только в случае, если ожидаемая польза для матери превышает возможный риск для плода.
Период грудного вскармливания
Неизвестно, проникает ли эренумаб в грудное молоко у человека. Отсутствуют данные о влиянии эренумаба на ребенка, находящегося на грудном вскармливании, или на продукцию грудного молока у матери. Ввиду того, что многие лекарственные препараты проникают в грудное молоко, а также возможного развития нежелательных реакций на препарату младенцев, находящихся на грудном вскармливании, решение о прекращении кормления грудью или об отмене препарата следует принимать с учетом потенциальной пользы от применения эренумаба для матери и потенциальной пользы от грудного вскармливания для ребенка.
Фертильность
Данных по влиянию эренумаба на репродуктивную функцию человека нет. При системных экспозициях эренумаба у половозрелых обезьян, до 283 или 123 раз превышающих экспозицию (оцениваемую по AUC для сыворотки крови) у человека, достигаемую в случае применения препарата в клинической дозе 70 мг или 140 мг 1 раз в месяц, никаких нежелательных действий в отношении суррогатных маркеров фертильности (патологоанатомических или гистопатологических изменений репродуктивных органов) не наблюдалось.
Способ применения и дозы
Лечение должно начинаться врачами, имеющими опыт диагностики и лечения мигрени. Рекомендуемая доза – 70 мг 1 раз в 4 недели (в месяц). У некоторых пациентов клинический эффект может достигаться при применении дозы 140 мг 1 раз в 4 недели (в месяц).
Клинические исследования показали, что у большинства пациентов, отвечающих на терапию, эффект наступает в течение 3 месяцев. Следует рассмотреть возможность прекращения лечения у пациентов, у которых не получен ответ после 3 месяцев терапии.
Рекомендуется регулярно оценивать необходимость продолжения лечения.
При пропуске очередной дозы рекомендуется возобновить лечение как можно раньше. В дальнейшем препарат применяется 1 раз в 4 недели (в месяц), начиная с последней полученной дозы.
Препарат Иринэкс следует вводить подкожно (п/к).
Препарат Иринэкс предназначен для самостоятельного введения пациентом.
Введение должно осуществляться лицом, обученным технике введения препарата. Для введения дозы 140 мг следует провести две последовательные подкожные инъекции препарата Иринэкс по 70 мг каждая.
Подробные указания по хранению препарата, обращению с ним и технике введения приведены в разделе «Указания по применению препарата Иринэкс».
Особые группы пациентов
Применение у пациентов с нарушением функции почек
Не требуется коррекции дозы при применении препарата у пациентов с нарушением функции почек легкой или средней степеней тяжести. Не выявлены различия в фармакокинетике эренумаба у пациентов с нарушением функции почек легкой или средней степеней тяжести и пациентами с нормальной функцией почек по данным популяционного фармакокинетического анализа. У пациентов с нарушением функции почек тяжелой степени (рСКФ <30 мл/мин/1,73 м²) исследований не проводилось.
Применение у пациентов с нарушением функции печени
Клинических исследований у пациентов с нарушением функции печени не проводилось. Эренумаб, как и другие моноклональные антитела, не метаболизируется изоферманами системы цитохрома Р450. Выведение через печень не является основным способом введения эренумаба.
Применение у пациентов в возрасте 65 лет и старше
В клинических исследованиях эренумаба участвовало недостаточное количество пациентов в возрасте 65 лет и старше для выявления различий в ответе на лечение между пожилыми пациентами и пациентами более молодого возраста. Коррекция дозы у пациентов в возрасте 65 лет и старше не требуется.
Применение у пациентов в возрасте младше 18 лет
Безопасность и эффективность препарата Иринэкс у данной категории пациентов не установлена.
Побочное действие
Для оценки безопасности эренумаба в течение 12 недель после начала лечения по сравнению с плацебо были объединены данные 2 клинических исследований II фазы и 2 клинических исследований III фазы у пациентов с мигренью.
В целом, в эти исследования было включено 2656 пациентов (1613 получали эренумаб, 1043 – плацебо). Из них 893 пациентов получали эренумаб в дозе 70 мг и 507 – в дозе 140 мг.
Общая выборка для оценки безопасности, учитывающая продолжающиеся открытые фазы дополнительных исследований, включает 2537 пациентов (2310,3 пациенто-лет), получивших по крайней мере 1 дозу эренумаба: 2066 пациентов получали препарат по крайней мере 6 месяцев, а 1213 пациентов – по крайней мере 12 месяцев.
Сводные данные по нежелательным реакциям (HP)
Все HP, зарегистрированные у пациентов, получавших эренумаб в 12-недельный плацебо-контролируемый период клинических исследований, приведены в таблице 1. Большинство HP были легкой или средней степени тяжести.
Ниже HP сгруппированы в соответствии с классификацией органов и систем органов MedDRA, и перечислены в порядке уменьшения частоты встречаемости.
Частота встречаемости оценивалась следующим образом: «очень часто» – ≥10%, «часто» – ≥1-<10%, «нечасто» – ≥0,1%-<1%, «редко» – ≥0,01-<0,1%, «очень редко» – <0,01%, включая отдельные сообщения, «частота неизвестна» – не может быть определена по имеющимся данным. В пределах каждой частотной категории HP распределены в порядке уменьшения частоты встречаемости.
Таблица 1. HP, возникавшие на фоне применения эренумаба
| Системно-органный класс | HP | Категория частоты |
| Нарушения со стороны иммунной системы | Реакции гиперчувствительности, включая сыпь, отек и крапивницу | Часто |
| Общие расстройства и нарушения в месте введения | Реакции в месте введенияa | Часто |
| Нарушения со стороны желудочно-кишечного тракта | Запор | Часто |
| Нарушения со стороны костно-мышечной системы и соединительной ткани | Мышечный спазм | Часто |
| Нарушения со стороны кожи и подкожных тканей | Зудb | Часто |
a Термин «реакции в месте введения» включает в себя несколько предпочтительных терминов, в частности боль в месте введения и эритема в месте введения.
b Термин «зуд» включает такие предпочтительные термины, как генерализованный зуд, зуд и зудящая сыпь.
Описание отдельных нежелательных реакций
Реакции в месте введения
В объединенном анализе 12-недельного плацебо-контролируемого периода клинических исследований наиболее частыми реакциями в месте введения у пациентов, получавших эренумаб, были боль в месте введения, эритема в месте введения и зуд в месте введения.
Большинство реакций в месте введения были 1 степени тяжести (легкие) и проходящие. Как правило боль в месте инъекции проходит в течение 1 часа после инъекции. У одного пациента, получившего эренумаб в дозе 70 мг п/к, препарат был отменен в связи с развитием сыпи в месте введения. Ни у одного из пациентов, получавших эренумаб в дозе 140 мг п/к, препарат не был отменен по причине реакций в месте введения по данным 12-недельного плацебо-контролируемого периода исследований.
Иммуногенность
Как и все белки, обладающие терапевтическим эффектом, эренумаб может вызывать иммунный ответ. Иммуногенность оценивали с использованием метода иммуноанализа для обнаружения связывающих антител против эренумаба. Для пациентов, в сыворотках которых при скрининговом иммуноанализе были обнаружены антитела к эренумабу, проводили биологический анализ in vitro для обнаружения нейтрализующих антител.
В 4 исследованиях профилактического лечения мигрени на протяжении двойной слепой фазы исследования частота образования антител к эренумабу у пациентов, получавших эренумаб в дозе 70 мг и 140 мг, составила 6,3% (56/884, при этом у 3 пациентов нейтрализующая активность определялась in vitro) и 2,6% (13/504, при этом in vitro нейтрализующая активность не определялась ни у одного пациента). Образование антител к эренумабу не влияло на его эффективность или безопасность.
Определяемая частота образования антител к лекарственному препарату в значительной степени зависит от чувствительности и специфичности анализа. Кроме того, частота обнаружения в сыворотке крови антител (в том числе, нейтрализующих) может зависеть от целого ряда факторов, к которым относятся метод анализа, способ и время получения образцов, сопутствующие терапия и заболевания. По этим причинам сравнение частоты образования антител к эренумабу с частотой образования антител к другим препаратам может привести к неверным выводам.
Если любые из указанных в инструкции побочных эффектов усугубляются, или Вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
Передозировка
В клинических исследованиях не было выявлено случаев передозировки эренумаба у человека. В клинических исследованиях эренумаб применяли п/к в дозах до 280 мг без каких-либо признаков дозоограничивающей токсичности. В случае передозировки следует проводить поддерживающую и симптоматическую терапию по мере необходимости.
Взаимодействие с другими лекарственными препаратами
В открытом исследовании фармакокинетического лекарственного взаимодействия эренумаба и комбинированных пероральных контрацептивов у здоровых женщин эренумаб (однократная п/к инъекция в дозе 140 мг) не влиял на фармакокинетику комбинированных пероральных контрацептивов, содержащих этинилэстрадиол и норгестимат.
В рандомизированном двойном слепом плацебо-контролируемом исследовании у здоровых добровольцев эренумаб (однократное в/в введение в дозе 140 мг), применяемый одновременно с суматриптаном, никак не влиял на показатели артериального давления в покое по сравнению с суматриптаном в качестве монотерапии. Эренумаб не оказывал влияния на фармакокинетику суматриптана.
Эренумаб не метаболизируется изоферментами цитохрома Р450; также маловероятно, что он может вызывать заметные изменения концентрации провоспалительных цитокинов, которые способны влиять на экспрессию или активность изоферментов цитохрома Р450. По этой причине лекарственные взаимодействия при одновременном применении препаратов, которые являются субстратами, индукторами или ингибиторами изоферментов цитохрома Р450, представляются маловероятными.
Влияние на результаты лабораторных и диагностических исследований
Влияние эренумаба на результаты лабораторных и/или диагностических исследований не изучалось.
Особые указания
Пациенты с некоторыми основными сердечно-сосудистыми заболеваниями были исключены из клинических исследований, в связи с чем данные по безопасности у этих пациентов отсутствуют.
Пациенты с гиперчувствительностью к латексу
Съемная крышка предварительно заполненного шприца и автоинжектора (шприц-ручки) содержит сухой натуральный каучуковый латекс, который может вызывать аллергические реакции у лиц, чувствительных к латексу.
Влияние на способность управлять транспортными средствами и/или механизмами
Препарат Иринэкс не оказывает значительного влияния на способность управлять транспортными средствами и/или механизмами.
Форма выпуска
Раствор для подкожного введения, 70 мг/мл.
Первичная упаковка
По 1 мл в предварительно заполненный шприц из стекла I гидролитического класса с иглой из нержавеющей стали и колпачком иглы из резины, содержащей латекс,
или
по 1 мл предварительно заполненный шприц из стекла I гидролитического класса с иглой из нержавеющей стали и колпачком иглы из резины, содержащей латекс, в автоинжекторе (шприц-ручке).
Вторичная упаковка: один предварительно заполненный шприц или две предварительно заполненные шприц-ручки вместе с инструкцией по медицинскому применению лекарственного препарата помещают в пачку картонную с контролем первичного вскрытия.
Условия хранения
При температуре от 2 до 8 °С. Не замораживать.
Хранить предварительно заполненные шприцы/ шприц-ручки в оригинальной картонной пачке для защиты от воздействия света.
Хранить в недоступном и невидном для детей месте.
Срок годности
2 года.
Не применять после истечения срока годности.
Условия отпуска
Отпускают по рецепту.
Наименование и адрес юридического лица, на имя которого выдано регистрационное удостоверение
«Сандоз Фармасьютикалс д.д.», Веровшкова 57, 1000 Любляна, Словения/ Sandoz
Pharmaceuticals d.d., Verovskova 57, 1000 Ljubljana, Slovenia
Производитель
Производство готовой лекарственной формы, первичная упаковка
«Амджен Мэньюфэкчуринг Лимитед», Роуд 31, Км 24.6, Джанкос, Пуэрто-Рико 00777, Соединенные Штаты Америки/ Amgen Manufacturing Limited, Carr 31, Km 24.6, Juncos, Puerto Rico (PR), 00777, USA
Вторичная (потребительская) упаковка, выпускающий контроль качества
«Амджен Европа Б.В.», Минервум 7061, 4817 ZK Бреда, Нидерланды/ Amgen Europe B.V., Minervum 7061,4817 ZK, Breda, Netherlands
Получить дополнительную информацию о препарате, а также направить претензии и информацию о нежелательных явлениях можно по следующему адресу в России:
ООО «Новартис Фарма»
125315, г. Москва, Ленинградский проспект, дом 72, корпус 3
Инструкция по применению предварительно заполненного шприца препарата Иринэкс, раствор для подкожного введения 70 мг/мл
Купить Иринэкс в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Фармакологическое действие
Эренумаб – это человеческое моноклональное антитело, являющееся антагонистом рецептора CGRP, и не обладает значимой фармакологической активностью в отношении рецепторов адреномедуллина, кальцитонина и амилина, а также агонистической активностью в отношении рецептора CGRP.
CGRP – это нейропептид, модулирующий передачу ноцицептивных сигналов, и вазодилататор, связанный с патофизиологией мигрени. Показано, что в отличие от других нейропептидов, концентрация CGRP значительно увеличивается во время приступа мигрени и возвращается к норме после его разрешения. Внутривенное (в/в) введение CGRP вызывает у пациентов мигренеподобную головную боль, из чего можно предположить, что CGRP может являться причиной возникновения мигрени. Рецептор к CGRP локализуется на участках, имеющих отношение к патофизиологии мигрени. Препарат является мощным и специфичным конкурентом CGRP за связывание с рецептором и тем самым подавляет его действие на рецептор.
Фармакокинетика
Характеризуется нелинейной кинетикой, что обусловлено его связыванием с рецептором CGRP. У здоровых добровольцев, которым подкожно (п/к) вводили препарат в дозе 70 мг или 140 мг, среднее значение Сmax составляло соответственно 6.1 мкг/мл и 15.8 мкг/мл (стандартное отклонение [SD]) 2.1 мкг/мл и 4.8 мкг/мл), а среднее значение площади под кривой “концентрация-время” (AUClast – 159 сут×мкг/мл и 505 сут×мкг/мл (SD 58 сут×мкг/мл и 139 сут×мкг/мл) соответственно.
У пациентов, получавших препарат в дозе 70 мг или 140 мг п/к каждые 4 недели, Cmin в сыворотке крови со временем увеличивалась менее чем в 2 раза (Cmin [SD] 5.7 [3.1] и 6.2 [2.9] мкг/мл для пациентов с эпизодической и хронической мигренью, получавших 70 мг, соответственно, Cmin [SD] 12.8 [6.53] и 14.9 [6.45] мкг/мл для пациентов с эпизодической и хронической мигренью, получавших 140 мг, соответственно) и достигала равновесного состояния через 12 недель после начала лечения. Эффективный T1/2 составляет 28 дней.
У здоровых добровольцев взрослого возраста, получавших однократную п/к инъекцию в дозе 70 мг или 140 мг, медиана Сmax в плазме крови достигалась приблизительно через 6 дней, а расчетная абсолютная биодоступность составляла 82%.
После однократного в/в введения в дозе 140 мг средний объем распределения в терминальной фазе выведения (Vz) составлял около 3.86 л (SD = 0.77).
Выведение описывается двухфазной кривой. При низких концентрациях выведение происходит преимущественно за счет насыщаемого связывания с мишенью (рецептором CGRP), в то время как при более высоких концентрациях – преимущественно за счет неспецифического ненасыщаемого протеолиза.
Показания активного вещества
ЭРЕНУМАБ
Профилактика мигрени у взрослых, которые имеют по крайней мере 4 дня мигрени в течение месяца.
Режим дозирования
П/к введение. Режим дозирования индивидуальный, в зависимости от показаний, возраста пациента и клинической ситуации.
Побочное действие
Со стороны иммунной системы: реакции гиперчувствительности, включая сыпь, отек и крапивницу.
Со стороны сердечно-сосудистой системы: риск развития артериальной гипертензии.
Со стороны пищеварительной системы: запор.
Со стороны костно-мышечной системы: мышечный спазм.
Со стороны кожи и подкожных тканей: зуд.
Противопоказания к применению
Повышенная чувствительность, детский и подростковый возраст до 18 лет, беременность и период лактации (грудного вскармливания), тяжелая почечная и печеночная недостаточность.
Применение при беременности и кормлении грудью
Препарат противопоказан для применения в период беременности и в период грудного вскармливания.
Применение при нарушениях функции печени
Препарат противопоказан для применения при тяжелых нарушении функции печени.
Применение при нарушениях функции почек
Препарат противопоказан для применения при тяжелых нарушениях функции почек.
Применение у детей
Препарат противопоказан для применения у детей и подростков в возрасте до 18 лет.
Применение у пожилых пациентов
Препарат разрешен для применения у пожилых пациентов.
Особые указания
Данные по безопасности у пациентов с некоторыми сердечно-сосудистыми заболеваниями отсутствуют.
Эренумаб
Erenumab
Фармакологическое действие
Эренумаб — это человеческое моноклональное антитело, являющееся антагонистом рецептора CGRP, и не обладает значимой фармакологической активностью в отношении рецепторов адреномедуллина, кальцитонина и амилина, а также агонистической активностью в отношении рецептора CGRP.
CGRP — это нейропептид, модулирующий передачу ноцицептивных сигналов, и вазодилататор, связанный с патофизиологией мигрени. Показано, что в отличие от других нейропептидов, концентрация CGRP значительно увеличивается во время приступа мигрени и возвращается к норме после его разрешения. Внутривенное (в/в) введение CGRP вызывает у пациентов мигренеподобную головную боль, из чего можно предположить, что CGRP может являться причиной возникновения мигрени.
Рецептор к CGRP локализуется на участках, имеющих отношение к патофизиологии мигрени. Эренумаб является мощным и специфичным конкурентом CGRP за связывание с рецептором и тем самым подавляет его действие на рецептор.
Фармакодинамика
В рандомизированном двойном слепом плацебо-контролируемом исследовании по оценке эффективности однократного в/в введения эренумаба в дозе 140 мг у пациентов со стабильной стенокардией не отмечалось снижения переносимости физической нагрузки при нагрузочной ЭКГ-пробе (на тредмил-тесте) по сравнению с плацебо и усугубления ишемии миокарда.
Клинические данные
Эренумаб оценивался в 3 базовых исследованиях по изучению профилактического лечения эпизодической и хронической мигрени. В исследования были включены пациенты с мигренью с аурой или без ауры в анамнезе в соответствии с диагностическими критериями Международной классификации головной боли (the International Classification of Headache Disorders, ICHD-III).
Эренумаб продемонстрировал статистически и клинически значимые улучшения ключевых показателей эффективности по сравнению с плацебо.
Хроническая мигрень
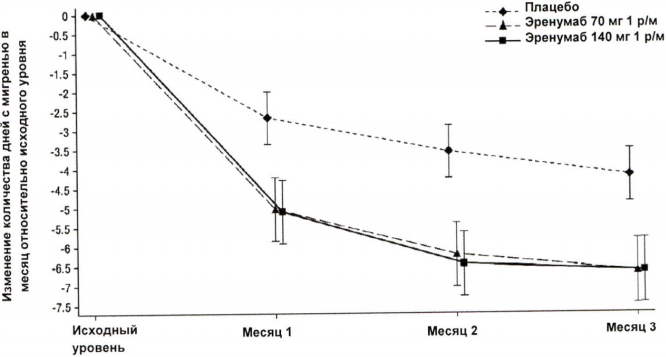
В клиническом исследовании пациентов с хронической мигренью эффективность применения препарата оценивалась на основании изменения количества дней с мигренью в течение месяца (ДММ) к 3 месяцу по сравнению с таковым показателем до лечения эренумабом (исходный уровень). Вторичными показателями эффективности служили снижение количества ДММ на 50–100 % относительно исходного уровня (ответ ≥50 %), изменение относительно исходного уровня количества дней в течение месяца, в которые пациенты применяли специфические препараты для купирования приступа мигрени. На рисунке 1 и в таблице 1 приведены ключевые результаты исследования. Анализ ежемесячных изменений показал, что среднемесячное количество дней с мигренью снизилось по сравнению с плацебо уже в первый месяц, а последующий анализ еженедельных изменений показал, что эффект эренумаба развивался уже на первой неделе после инъекции.
Рисунок 1. Динамика изменения количества ДММ относительно исходного уровня у пациентов с хронической мигренью.
a Представлены среднеквадратичные средние значения и 95%-ные доверительные интервалы.
Все p-значения для разницы в среднеквадратичных средних между группами эренумаба и плацебо, которые оценивали в месяц 3 (главный показатель эффективности), составляли <0,001.
| Эренумаб 70 мг (n = 188) | Эренумаб 140 мг (n = 187) | Плацебо (n = 281) | Межгрупповая разница/ Отношение шансов | pa | |
|---|---|---|---|---|---|
| ДММ | |||||
| Среднее изменениеb (95 % ДИ) | -6,64
(-7,47; -5,81) |
-6,63
(-7,45; -5,80) |
-4,18
(-4,86; -3,50) |
70 мг -2,46 (-3,52; -1,39) 140 мг -2,45 (-3,51; -1,38) |
<0,001 |
| Пациенты, у которых показатель ДММ изменился на ≥50 % | |||||
| % | 39,9 | 41,2 | 23,5 | ||
| Отношение шансовc (95 % ДИ) | 70 мг 2,18 (1,46; 3,27) 140 мг 2,34 (1,56; 3,51) |
<0,001 | |||
| Пациенты, у которых показатель ДММ изменился на ≥75 %d | |||||
| % | 17,0 | 20,9 | 7,8 | ||
| Отношение шансов (95 % ДИ) | 70 мг 2,43 (1,36; 4,33) 140 мг 3,13 (1,78; 5,48) |
Не применимо | |||
| Количество дней в течение месяца, в которые пациенты применяли специфические препараты для купирования приступа мигрениe | |||||
| Среднее изменениеb (95 % ДИ) | -3,45
(-4,02; -2,87) |
-4,13
(-4,70; -3,56) |
-1,58
(-2,05;-1,11) |
70 мг -1,86 (-2,60; -1,13) 140 мг -2,55 (-3,28; -1,82) |
<0,001 |
| Результаты субъективных ответов пациентов | |||||
| HIT 6 | |||||
| Среднее изменениеb (95 % ДИ) | -5,6
(-6,5; -4,6) |
-5,6
(-6,5;-4,6) |
-3,1
(-3,9; -2,3) |
70 мг -2,5 (-3,7; -1,2) 140 мг -2,5 (-3,7; -1,2) |
Не применимо |
| Суммарный показатель MIDAS | |||||
| Среднее изменениеb (95 % ДИ) | -19,41
(-25,19; -13,62) |
-19,76
(-25,56; -13,97) |
-7,54
(-12,40; -2,69) |
70 мг -11,86 (-19,34; -4,39) 140 мг -12,22 (-19,64; -4,75) |
Не применимо |
ДИ — доверительный интервал; ДММ — количество дней с мигренью в течение месяца.
a Все p-значения представлены в виде нескорректированных значений и после коррекции на множественность сравнений являются статистически значимыми.
b Среднеквадратичное среднее изменение к месяцу 3 относительно исходного уровня, межгрупповая разница и p-значение основаны на линейной модели смешанных эффектов, в которую включены исследуемая группа, среднемесячное значение на исходном уровне, факторы стратификации (регион [Северная Америка или Европа] и злоупотребление лекарственными препаратами [имеется или отсутствует]), плановый визит и взаимодействие «исследуемая группа-плановый визит»; вменения отсутствующих данных не проводили.
c Отношение шансов и p-значение для пациентов с ответом ≥50 % к 3 месяцу основано на стратифицированном критерии Кохрана-Мэнтела-Ханцеля после вменения отсутствующих данных, которые считались отсутствием ответа.
d Апостериорный анализ; никакой проверки гипотезы не проводили.
e К специфическим препаратам от мигрени относятся триптаны и производные эрготамина.
У пациентов, у которых не было достигнуто клинического ответа на один или несколько методов профилактической терапии, разница в сокращении ДММ, наблюдаемая между дозой 140 мг и плацебо, составляла -3,3 дня (95 % ДИ: -4,6; -2,1), а между дозой 70 мг и плацебо — -2,5 дня (95 % ДИ: -3,8; -1,2). У пациентов, у которых не было достигнуто клинического ответа на два или более метода профилактической терапии, разница ДММ составляла -4,3 дня (95 % ДИ: -5,8; -2,8) между дозой 140 мг и плацебо и -2,7 дня (95 % ДИ: -4,2; -1,2) между дозой 70 мг и плацебо соответственно. Доля пациентов, получавших эренумаб, которые достигли по меньшей мере 50 % сокращения ДММ, была выше по сравнению с группой плацебо среди пациентов, не достигших клинического ответа на один или несколько методов профилактической терапии (40,8% для дозы 140 мг и 34,7 % для дозы 70 мг против 17,3 % для плацебо), с отношением шансов 3,3 (95% ДИ: 2,0; 5,5) для дозы 140 мг и 2,6 (95 % ДИ: 1,6; 4,5) для дозы 70 мг. У пациентов, не достигших клинического ответа после применения двух или более методов профилактической терапии, доля составила 41,3 % для дозы 140 мг и 35,6 % для дозы 70 мг против 14,2 % для плацебо с отношением шансов 4,2 (95 % ДИ: 2,2; 7,9) и 3,5 (95 % ДИ: 1,8; 6,6) соответственно.
Эпизодическая мигрень
В клиническом исследовании пациентов с эпизодической мигренью эффективность применения препарата оценивалась на основании изменения среднемесячного количества дней с мигренью в течение месяцев 4–6 относительно исходного уровня. Вторичными показателями эффективности служили снижение на 50–100 % относительно исходного уровня среднего количества ДММ (ответ ≥50 %), изменение относительно исходного уровня среднего количества дней в течение месяца, в которые пациенты применяли специфические препараты для купирования приступа мигрени, и изменение относительно исходного уровня показателей по двум доменам опросника MPFID (Дневник влияния мигрени на физическую активность), связанных с ухудшением физического состояния (УФС) и повседневной активностью (ПА). Опросник MPFID — это инструмент для оценки исходов, сообщаемых пациентами, который позволяет измерить влияние мигрени на физическое функционирование (физическую активность). Он содержит 13 пунктов для оценки влияния мигрени в течение прошедших 24 часов на два аспекта физического функционирования, представляющих интерес — влияние на повседневную активность (ПА: 7 пунктов, например трудности с выполнением действий, требующих концентрации внимания) и ухудшение физического состояния (УФС: 5 пунктов, например трудности с выполнением действий, требующих физических усилий), а также один общий пункт для оценки влияния на повседневную активность в целом. Пациенты ежедневно оценивают время, в течение которого они ощущали влияние мигрени, или уровень затруднений, связанных с мигренью. Показатели по шкале MPFID за месяц усредняются по дням с мигренью и без мигрени; при этом чем выше показатель, тем в большей степени мигрень влияет на домены ПА и УФС.
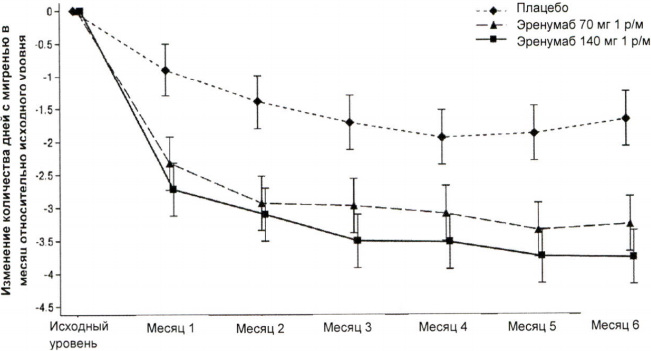
На рисунке 2 и в таблице 2 приведены ключевые результаты исследования.
Рисунок 2. Динамика изменения количества дней с мигренью в течение месяца относительно исходного уровня в исследовании пациентов с эпизодической мигренью.
| Эренумаб 70 мг (n = 312) | Эренумаб 140 мг (n = 318) | Плацебо (n = 316) | Межгрупповая разница/ Отношение шансов | р-значениеa | |
|---|---|---|---|---|---|
| Количество дней с мигренью в течение месяца (ДММ) | |||||
| Среднее изменениеb 95 % ДИ | -3,23
(-3,58; -2,88) |
-3,67
(-4,02, -3,33) |
-1,83
(-2,18, -1,48) |
70 мг 1,40 (-1,88; -0,92) 140 мг -1,85 (-2,33; -1,37) |
<0,001 |
| Пациенты, у которых показатель ДММ изменился на ≥50 % | |||||
| % | 43,3 | 50,0 | 26,6 | ||
| Отношение шансовc 95 % ДИ | 70 мг 2,13 (1,52; 2,98) 140 мг 2,81 (2,01; 3,94) |
<0,001 | |||
| Пациенты, у которых показатель ДММ изменился на ≥75 %d | |||||
| % | 20,8 | 22,0 | 7,9 | ||
| Отношение шансов 95 % ДИ | 70 мг 3,14 (1,91; 5,18) 140 мг 3,35 (2,05; 5,49) |
Не применимо | |||
| Количество дней в течение месяца, в которые пациенты применяли специфические препараты для купирования приступа мигрениe | |||||
| Среднее изменениеb 95 % ДИ | -1,13
(-1,34; -0,92) |
-1,61
(-1,83; -1,40) |
-0,20
(-0,41; 0,02) |
70 мг -0,94 (-1,23; -0,64) 140 мг -1,42 (-1,71; -1,12) |
<0,001 |
| Показатель по домену ухудшения физического состояния шкалы MPFID | |||||
| Среднее изменениеb 95 % ДИ | -4,24 (-5,02; -3,45) |
-4,81
(-5,59; -4,03) |
-2,38
(-3,16; -1,59) |
70 мг -2,22 (-3,28; -1,16) 140 мг |
<0,001 |
| Влияние на показатель по домену повседневной активности шкалы MPFID | |||||
| Среднее изменениеb 95 % ДИ | -5,52 (-6,28; -4,75) |
-5,86
(-6,62; -5,10) |
-3,30
(-4,06; -2,53) |
-2,22 (-3,28, -1,16) -2,57 (-3,62; -1,51) |
<0,001 |
| HIT 6 | |||||
| Среднее изменение 95 % ДИ | -6,7
(-7,4; -6,0) |
-6,9
(-7,6; -6,3) |
-4,6
(-5,3; -4,0) |
70 мг -2,1 (-3,0; -1,1) 140 мг -2,3 (-3,2; -1,3) |
Не применимо |
| Суммарный показатель MIDAS | |||||
| Среднее изменение 95 % ДИ | -6,7
(-7,6; -5,9) |
-7,5
(-8,3; -6,6) |
-4,6
(-5,5; -3,8) |
70 мг -2,1 (-3,3; -0,9) 140 мг -2,8 (-4,0; -1,7) |
Не применимо |
| Ответ по домену ухудшения физического состояния шкалы MPFID | |||||
| %f | 39,1 | 42,5 | 30,1 | ||
| Отношение шансов 95 % ДИ | 70 мг 1,49 (1,07; 2,08) 140 мг 1,73 (1,24; 2,40) |
||||
| Ответ по влиянию на показатель по домену повседневной активности шкалы MPFID | |||||
| %f | 49,0 | 50,3 | 34,5 | ||
| Отношение шансов 95 % ДИ | 70 мг 1,83 (1,33; 2,52) 140 мг 1,93 (1,40; 2,67) |
ДИ — доверительный интервал; ДММ — количество дней с мигренью в течение месяца; MPFID — дневник влияния мигрени на физическую активность.
a Все p-значения представлены в виде нескорректированных значений и после коррекции на множественность сравнений являются статистически значимыми.
b Среднеквадратичное среднее изменение в месяцы 4–6 относительно исходного уровня, межгрупповая разница и p-значение основаны на линейной модели смешанных эффектов, в которую включены исследуемая группа, значение на исходном уровне, факторы стратификации (регион [Северная Америка или другой] и применение в прошлом лекарственных препаратов для профилактики мигрени [применялись, применялись в прошлом, применяются в настоящее время в качестве сопутствующих препаратов]), плановый визит и взаимодействие «исследуемая группа-плановый визит»; вменения отсутствующих данных не проводили.
c Отношение шансов и p-значение для пациентов с ответом ≥50 % в месяцы 4–6 основано на стратифицированном критерии Кохрана-Мэнтела-Ханцеля после вменения отсутствующих данных, которые считались отсутствием ответа.
d Апостериорный анализ; никакой проверки гипотезы не проводили.
e К специфическим препаратам от мигрени относятся триптаны и производные эрготамина.
f Снижение на ≥5 среднего месячного показателя УФС и ПА по сравнению с исходным показателем.
У пациентов, у которых не было достигнуто клинического ответа на один или несколько методов профилактического лечения, разница сокращения ДММ, наблюдаемая между дозой 140 мг и плацебо, составила -2,5 (95 % ДИ: -3,4; -1,7) и между дозой 70 мг и плацебо -2,0 (95 % ДИ: -2,8; -1,2). Также доля пациентов, у которых достигнуто сокращение ДММ на 50 % была больше по сравнению с группой плацебо (39,7 % для 140 мг и 38,6 % для 70 мг, при отношении шансов 3,1 [95 % ДИ: 1,7; 5,5] и 2,9 [95 % ДИ: 1,6; 5,3] соответственно).
Фармакокинетика
Эренумаб характеризуется нелинейной кинетикой, что обусловлено его связыванием с рецептором CGRP. У здоровых добровольцев, которым подкожно (п/к) вводили препарат в дозе 70 мг или 140 мг, среднее значение максимальной концентрации (Cmax) составляло соответственно 6,1 мкг/мл и 15,8 мкг/мл (стандартное отклонение [SD]) 2,1 мкг/мл и 4,8 мкг/мл), а среднее значение площади под кривой «концентрация-время» (AUClast — 159 сут × мкг/мл и 505 сут × мкг/мл (SD 58 сут × мкг/мл и 139 сут × мкг/мл) соответственно.
У пациентов, получавших препарат в дозе 70 мг или 140 мг п/к каждые 4 недели, минимальная концентрация (Cmin) в сыворотке крови со временем увеличивалась менее чем в 2 раза (Cmin [SD] 5,7 [3,1] и 6,2 [2,9] мкг/мл для пациентов с эпизодической и хронической мигренью, получавших 70 мг, соответственно, Cmin [SD] 12,8 [6,53] и 14,9 [6,45] мкг/мл для пациентов с эпизодической и хронической мигренью, получавших 140 мг, соответственно) и достигала равновесного состояния через 12 недель после начала лечения. Эффективный период полувыведения эренумаба составляет 28 дней.
Всасывание
У здоровых добровольцев взрослого возраста, получавших однократную п/к инъекцию эренумаба в дозе 70 мг или 140 мг, медиана Cmax в плазме крови достигалась приблизительно через 6 дней, а расчётная абсолютная биодоступность составляла 82 %.
Распределение
После однократного в/в введения в дозе 140 мг средний объём распределения в терминальной фазе выведения (Vz) составлял около 3,86 л (SD = 0,77).
Метаболизм и выведение
Выведение эренумаба описывается двухфазной кривой. При низких концентрациях выведение происходит преимущественно за счёт насыщаемого связывания с мишенью (рецептором CGRP), в то время как при более высоких концентрациях — преимущественно за счёт неспецифического ненасыщаемого протеолиза.
Фармакокинетика у особых групп пациентов
По данным популяционного фармакокинетического анализа у групп пациентов, которым показан эренумаб, его фармакокинетические параметры не зависели от возраста, пола, расы, подтипа мигрени (эпизодическая или хроническая) или клиренса креатинина.
Показания
Профилактика мигрени у взрослых, которые имеют по крайней мере 4 дня мигрени в течение месяца.
Противопоказания
Гиперчувствительность.
Беременность и грудное вскармливание
Применение при беременности
Категория действия на плод по FDA — N.
Адекватных и строго контролируемых исследований по применению эренумаба у беременных женщин не проводилось. В исследовании репродуктивной токсичности у яванских макак, в которых животные получали эренумаб во время беременности, а его экспозиция (оцениваемая по AUC) в 40 или 17 раз превышала таковую у пациентов, получающих эренумаб в дозе 70 мг или 140 мг 1 раз в месяц соответственно, не было выявлено никаких эффектов в отношении беременности, эмбриофетального или постнатального развития (до 6-месячного возраста). У только что родившихся обезьян определялись существенные концентрации эренумаба в сыворотке крови, подтверждая, что эренумаб, как и другие антитела IgG класса, проникает через плацентарный барьер.
Повреждающее действие эренумаба на плод в случае его применения у женщин во время беременности неизвестно, так как исследования на животных не всегда позволяют предсказать эффект лекарственного препарата у человека. В качестве меры предосторожности желательно избегать применения препарата во время беременности.
Применение эренумаба во время беременности возможно только в случае, если ожидаемая польза для матери превышает возможный риск для плода.
Применение в период грудного вскармливания
Неизвестно, проникает ли эренумаб в грудное молоко у человека. Отсутствуют данные о влиянии эренумаба на ребёнка, находящегося на грудном вскармливании, или на продукцию грудного молока у матери. Ввиду того, что многие лекарственные препараты проникают в грудное молоко, а также возможного развития нежелательных реакций на препарату младенцев, находящихся на грудном вскармливании, решение о прекращении кормления грудью или об отмене препарата следует принимать с учётом потенциальной пользы от применения эренумаба для матери и потенциальной пользы от грудного вскармливания для ребёнка.
Фертильность
Данных по влиянию эренумаба на репродуктивную функцию человека нет. При системных экспозициях эренумаба у половозрелых обезьян, до 283 или 123 раз превышающих экспозицию (оцениваемую по AUC для сыворотки крови) у человека, достигаемую в случае применения препарата в клинической дозе 70 мг или 140 мг 1 раз в месяц, никаких нежелательных действий в отношении суррогатных маркеров фертильности (патологоанатомических или гистопатологических изменений репродуктивных органов) не наблюдалось.
Применение в детском возрасте
Опыт медицинского применения у детей отсутствует.
Способ применения и дозы
Подкожно — 70 мг 1 раз в месяц.
Побочные действия
Для оценки безопасности эренумаба в течение 12 недель после начала лечения по сравнению с плацебо были объединены данные 2 клинических исследований II фазы и 2 клинических исследований III фазы у пациентов с мигренью.
В целом, в эти исследования было включено 2656 пациентов (1613 получали эренумаб, 1043 — плацебо). Из них 893 пациентов получали эренумаб в дозе 70 мг и 507 — в дозе 140 мг.
Общая выборка для оценки безопасности, учитывающая продолжающиеся открытые фазы дополнительных исследований, включает 2537 пациентов (2310,3 пациенто-лет), получивших по крайней мере 1 дозу эренумаба: 2066 пациентов получали препарат по крайней мере 6 месяцев, а 1213 пациентов — по крайней мере 12 месяцев.
Сводные данные по нежелательным реакциям (HP)
Все HP, зарегистрированные у пациентов, получавших эренумаб в 12-недельный плацебо-контролируемый период клинических исследований, приведены в таблице 1. Большинство HP были лёгкой или средней степени тяжести.
Ниже HP сгруппированы в соответствии с классификацией органов и систем органов MedDRA, и перечислены в порядке уменьшения частоты встречаемости.
Частота встречаемости оценивалась следующим образом: «очень часто» — ≥10 %, «часто» — ≥1–<10 %, «нечасто» — ≥0,1 %–<1 %, «редко» — ≥0,01–<0,1 %, «очень редко» — <0,01 %, включая отдельные сообщения, «частота неизвестна» — не может быть определена по имеющимся данным. В пределах каждой частотной категории HP распределены в порядке уменьшения частоты встречаемости.
| Системно-органный класс | HP | Категория частоты |
|---|---|---|
| Нарушения со стороны иммунной системы | Реакции гиперчувствительности, включая сыпь, отёк и крапивницу | Часто |
| Общие расстройства и нарушения в месте введения | Реакции в месте введенияa | Часто |
| Нарушения со стороны желудочно-кишечного тракта | Запор | Часто |
| Нарушения со стороны костно-мышечной системы и соединительной ткани | Мышечный спазм | Часто |
| Нарушения со стороны кожи и подкожных тканей | Зудb | Часто |
a Термин «реакции в месте введения» включает в себя несколько предпочтительных терминов, в частности боль в месте введения и эритема в месте введения.
b Термин «зуд» включает такие предпочтительные термины, как генерализованный зуд, зуд и зудящая сыпь.
Описание отдельных нежелательных реакций
Реакции в месте введения
В объединённом анализе 12-недельного плацебо-контролируемого периода клинических исследований наиболее частыми реакциями в месте введения у пациентов, получавших эренумаб, были боль в месте введения, эритема в месте введения и зуд в месте введения.
Большинство реакций в месте введения были 1 степени тяжести (лёгкие) и проходящие. Как правило боль в месте инъекции проходит в течение 1 часа после инъекции. У одного пациента, получившего эренумаб в дозе 70 мг п/к, препарат был отменен в связи с развитием сыпи в месте введения. Ни у одного из пациентов, получавших эренумаб в дозе 140 мг п/к, препарат не был отменен по причине реакций в месте введения по данным 12-недельного плацебо-контролируемого периода исследований.
Иммуногенность
Как и все белки, обладающие терапевтическим эффектом, эренумаб может вызывать иммунный ответ. Иммуногенность оценивали с использованием метода иммуноанализа для обнаружения связывающих антител против эренумаба. Для пациентов, в сыворотках которых при скрининговом иммуноанализе были обнаружены антитела к эренумабу, проводили биологический анализ in vitro для обнаружения нейтрализующих антител.
В 4 исследованиях профилактического лечения мигрени на протяжении двойной слепой фазы исследования частота образования антител к эренумабу у пациентов, получавших эренумаб в дозе 70 мг и 140 мг, составила 6,3 % (56/884, при этом у 3 пациентов нейтрализующая активность определялась in vitro) и 2,6 % (13/504, при этом in vitro нейтрализующая активность не определялась ни у одного пациента). Образование антител к эренумабу не влияло на его эффективность или безопасность.
Определяемая частота образования антител к лекарственному препарату в значительной степени зависит от чувствительности и специфичности анализа. Кроме того, частота обнаружения в сыворотке крови антител (в том числе, нейтрализующих) может зависеть от целого ряда факторов, к которым относятся метод анализа, способ и время получения образцов, сопутствующие терапия и заболевания. По этим причинам сравнение частоты образования антител к эренумабу с частотой образования антител к другим препаратам может привести к неверным выводам.
Передозировка
В клинических исследованиях не было выявлено случаев передозировки эренумаба у человека. В клинических исследованиях эренумаб применяли п/к в дозах до 280 мг без каких-либо признаков дозоограничивающей токсичности. В случае передозировки следует проводить поддерживающую и симптоматическую терапию по мере необходимости.
Взаимодействие
В открытом исследовании фармакокинетического лекарственного взаимодействия эренумаба и комбинированных пероральных контрацептивов у здоровых женщин эренумаб (однократная п/к инъекция в дозе 140 мг) не влиял на фармакокинетику комбинированных пероральных контрацептивов, содержащих этинилэстрадиол и норгестимат.
В рандомизированном двойном слепом плацебо-контролируемом исследовании у здоровых добровольцев эренумаб (однократное в/в введение в дозе 140 мг), применяемый одновременно с суматриптаном, никак не влиял на показатели артериального давления в покое по сравнению с суматриптаном в качестве монотерапии. Эренумаб не оказывал влияния на фармакокинетику суматриптана.
Эренумаб не метаболизируется изоферментами цитохрома P450; также маловероятно, что он может вызывать заметные изменения концентрации провоспалительных цитокинов, которые способны влиять на экспрессию или активность изоферментов цитохрома P450. По этой причине лекарственные взаимодействия при одновременном применении препаратов, которые являются субстратами, индукторами или ингибиторами изоферментов цитохрома P450, представляются маловероятными.
Влияние на результаты лабораторных и диагностических исследований
Влияние эренумаба на результаты лабораторных и/или диагностических исследований не изучалось.
Меры предосторожности
Пациенты с некоторыми основными сердечно-сосудистыми заболеваниями были исключены из клинических исследований, в связи с чем данные по безопасности у этих пациентов отсутствуют.
Влияние на способность к вождению автотранспорта и управлению механизмами
Не оказывает значительного влияния на способность управлять транспортными средствами и/или механизмами.
Классификация
-
АТХ
N02CX07, N02CD01
-
Фармакологическая группа
-
Коды МКБ 10
-
Категория при беременности по FDA
N
(не классифицировано FDA)
Информация о действующем веществе Эренумаб предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения о применении препаратов, содержащих активное вещество Эренумаб, содержатся в инструкции производителя, прилагаемой к упаковке.
Что такое моноклональные антитела и как они помогают лечить мигрень.
О каких препаратах идет речь?
Эренумаб (Иринэкс в России, Aimovig на Западе), Фреманезумаб (Аджови, Ajovy), Галканезумаб (Эмгалити, Emgality) и Эптинезумаб (Vyepti). В России в 2020 году выходят первые два из списка, остальные должны появиться через 1-2 года.
Что такое моноклональные антитела? Это что-то связанное с иммунитетом?
И да и нет. Мы все знаем, что антитела – это особые молекулы нашей иммунной системы, которые борются с вирусами и бактериями. Их ключевая особенность – высокая специфичность (избирательность) в отношении какой-то одной мишени, против которой они были созданы организмом.
Именно поэтому мы можем болеть гриппом каждый год, даже если уже болели им раньше: вирус гриппа всегда чуть-чуть меняется от года к году, а наши старые антитела уже его не узнают. А прививка от кори или краснухи действует очень долго, так как эти вирусы не подвержены изменениям и наши антитела хорошо их узнают.
Именно избирательность антител, то есть, то, что они как ключ к замку подходят только к одной цели, позволила использовать их в медицине. Если мы знаем какую-ту особенную мишень в заболевании (например особенность раковой клетки), то можем создать антитела в лаборатории именно против этой раковой клетки и не будет необходимости «выжигать» химиотерапией все клетки подряд. Именно поэтому терапия моноклональными антителами впервые появилась в онкологии в конце 20-го века.
Затем, по мере того, как ученые стали узнавать биологические основы других болезней, этот подход к лечению стал проникать и в другие области медицины. Сейчас моноклональные антитела успешно используют в лечении псориаза, рассеянного склероза, ревматических заболеваний, астмы, а теперь – и мигрени.
И на какие мишени мы можем действовать моноклональными антителами при мигрени?
При мигрени мы можем заблокировать специальный белок CGRP или его рецептор.
Что такое CGRP?
Аббревиатура расшифровывается как Calcitonin gene-related peptide (Кальцитонин-ген родственный пептид). Это один из медиаторов боли, который выделяется в системе тройничного нерва и отвечает за головную боль при приступе мигрени. Можно сказать, что CGRP ручки громкости: чем его больше выделилось, тем сильнее и мучительнее боль.
Как связаны тройничный нерв и мигрень? Мигрень – это же изменение тонуса сосудов?
Как раз сосуды при мигрени почти или совсем ни при чем. «Сосудистая» теория мигрени была актуальна в середине прошлого века. В последние 20-30 лет стало ясно, что причина мигрени в нарушении работы головного мозга, точнее, отдельных его частей (система тройничного нерва, гипоталамус, кора головного мозга). Ученые обнаружили вещества, концентрация которых повышается при приступе мигрени (CGRP, PACAP, VIP) и придумали новые революционные препараты.
Как действуют эти препараты?
Они блокируют путь возникновения боли, в котором участвует белок CGRP. Есть две схемы: по одной работают препараты фреманезумаб, галканезумаб, эптинезумаб. Они блокируют сам белок. Эренумаб работает по-другому: влияет на рецептор, особую зону на поверхности клетки, чувствительную к этому белку. Но в целом принцип работы у препаратов общий – прервать “путь боли” с участием белка CGRP. Мы можем повлиять на этот путь или заблокировав сам белок CGRP с помощью фреманезумаба, галканезумаба и эптинезумаба, или заблокировав действие CGRP на его рецептор (особую зону на поверхности клетки) с помощью Эренумаба.
Как вводят моноклональные антитела от мигрени?
С помощью простой подкожной инъекции: (Ajovy, Иринэкс, Aimovig и Emgality) или внутривенно (Vyepti).
Какой эффект я почувствую?
Основная задача этой терапии – профилактика приступов мигрени. Мы не можем (никто в мире не может) излечить мигрень полностью, так как это врожденная особенность вашего мозга, но мы можем взять ее под контроль и сделать приступы слабее и реже. Лечение, цель которого – сократить частоту приступов, и называется профилактической терапией мигрени.
У меня полностью пройдет мигрень?
Это возможно с вероятностью примерно 20%. Именно у такого количества людей, которые участвовали в исследовании, приступы мигрени полностью заканчивались к концу года применения терапии. На 75% меньше приступов стало примерно у 45% участников исследований, а на 50% – у ⅔ пациентов. Это очень хорошие результаты по сравнению с тем лечением мигрени, которое было доступно ранее (противоэпилептические препараты, бета-блокаторы, кандесартан, антидепрессанты и ботулинический токсин).
Как часто надо применять эти лекарства?
Препараты вводят подкожно каждый месяц (Иринэкс, Аджови/Ajovy, Эмгалити/Emgality) или раз в три месяца (Аджови/Ajovy и Vyepti).
И их нужно будет колоть всю жизнь?
Конечно нет. Задача профилактической терапии мигрени: взять мигрень под контроль и сделать ее редкой, хорошо отвечающей на лечение обезболивающими. Обычно профилактику назначают на 6 или 12 месяцев – этого периода обычно достаточно, чтобы «перезагрузить» головной мозг, после чего приступов станет меньше или они совсем пропадут.
А как понять, что я в числе людей, которым это лечение помогает?
По рекомендациям европейских и американских ассоциаций по лечению головной боли мы можем оценить, работает ли лечение, через 3 месяца (если препарат вводят раз в месяц) или через 6 месяцев (если препарат вводят раз в три месяца).
А что с побочками? Наверняка что-то ужасное?
Совсем нет. Из самых частых побочных эффектов (их испытывали около 20% участников исследований) – это реакции в месте введения (покраснение, боль, жжение, отек). Это быстро проходит. В остальном серьезных нежелательных явлений исследования не показали.
Как давно появились?
Первые препараты (Аймовиг и Аджови) появились в продаже в США в 2018 году. В нашей Университетской клинике головной боли проходили исследования всех четырех препаратов еще с 2016 года.
Какие препараты есть у нас?
В России зарегистрированы два из четырех препаратов – Иринэкс (в других странах он называется Аймовиг) и Аджови.
Как получить лечение с помощью моноклональных антител к CGRP или рецептору к CGRP?
Вы можете приобрести препарат в аптеке или в специализированной клинике (такой, как наша). Препарат рекомендуют вводить под наблюдением врача.
Сколько стоит эта терапия?
Стоимость лечения с помощью препарата Иринэкс в нашей клиники составляет 22000 рублей. Стоимость лечения с помощью препарата Аджови – 23000 рублей. Перед введением необходима консультация с врачом.
Сколько стоит лечение препаратом Иринэкс?
Стоимость инъекции Иринэкса – 22.000 рублей + стоимость консультации врача.
Консультация нужна только перед первым введением. При курсовом лечении в дальнейшем вы платите только за инъекцию.
Сколько стоит лечение препаратом Аджови?
Стоимость инъекции Аджови – 23.000 рублей + стоимость консультации врача.
Консультация нужна только перед первым введением. При курсовом лечении в дальнейшем вы платите только за инъекцию.
Как записаться на прием и ввести Иринэкс или Аджови?
Если вы не наблюдаетесь в нашей клинике, записывайтесь на первичный прием к любому специалисту на удобное для вас время. Если врач подтвердит диагноз и то, что вам подходят эти препараты, ввести Иринэкс или Аджови можно будет сразу же.
Если вы уже наблюдаетесь у нас в клинике с диагнозом «мигрень» – записывайтесь на короткий повторный приём (30 минут) к докторам Анне Сергеевне Галаниной, Эльдару Замировичу Мамхегову или Дарье Захаровне Коробковой. При записи скажите, что вас интересует инъекция Иринэкса или Аджови. В случае, если предыдущий ваш визит был не более 2 месяцев назад, оплатить нужно будет только препарат, без консультации.
Больше статей о головной боли читайте в нашем Телеграм-канале.
Чтобы записаться к врачу, звоните: +7 499 938-53-01 или нажмите кнопку «Запись на прием», выберите доктора и нужное время в его расписании.
В мае 2018 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило к применению «Аймовиг» (Aimovig, международное непатентованное наименование — эренумаб) — первое полностью человеческое антитело для лечения мигрени. Это лекарство, разработанное совместными усилиями фармацевтических компаний Novartis и Amgen, имеет принципиально иной механизм действия, чем традиционно используемые при лечении мигрени препараты. Сможет ли «Аймовиг» значительно снизить симптомы и улучшить качество жизни страдающих мигренью людей? Попробуем разобраться.
Современные лекарства
Спецпроект о современных лекарствах, истории их создания, методах разработки и тенденциях развития.
Партнер спецпроекта — компания Cytiva — образовалась в результате продажи подразделения GE Healthcare Biopharma корпорации Danaher Corporation. Cytiva — глобальный поставщик технологий и услуг, которые продвигают и ускоряют разработку и производство терапевтических средств. У компании богатое наследие, насчитывающее сотни лет. Клиенты Cytiva проводят мероприятия по спасению жизни, начиная от фундаментальных биологических исследований и заканчивая разработкой инновационных вакцин, биологических препаратов и новейших клеточных и генных терапий. Задача компании — предоставить инструменты и услуги, которые им необходимы, чтобы они работали лучше, быстрее и безопаснее, что приведет к лучшим результатам для пациентов.
Первые две статьи нашего спецпроекта «Современные лекарства» были посвящены общим вопросам того, как развивалась лекарственная индустрия [1], и тому, как ученые ищут новые мишени для лекарственных средств [2]. Эта статья открывает ряд новостных материалов об интересных современных лекарствах.
Как велика проблема?
Мигрень — неврологическое заболевание, характерное в первую очередь сильными приступами головной боли, — известно уже более 3000 лет [3]. Однако несмотря на хорошую изученность симптомов и проявлений, причины мигрени до конца не установлены до сих пор. Ранее считали, что мигрень вызывается изменениями мозгового кровообращения, но сейчас многие исследователи предполагают, что это не главная причина [4].
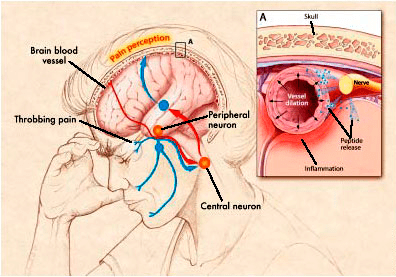
Современное понимание патогенеза мигрени связано с вовлечением определенных нервных путей и нейропептидов, в особенности тройничного нерва и CGRP — пептида, связанного с геном кальцитонина (calcitonin gene-related peptide). Исследования показали, что возбужденные нервные клетки могут активировать тройничный нерв, что приводит к выделению CGRP и других нейропептидов. CGRP сильно расширяет сосуды, вызывая локальный отек, а это привлекает клетки, участвующие в процессе воспаления. При воспалении сосудов черепа и твердой мозговой оболочки провоспалительные молекулы стимулируют болевые окончания мозговых оболочек, что и приводит к мигрени (рис. 1) [5–8].
Такое возбуждение нервных клеток, запускающее мигрень, связано с наследственностью и физиологией, однако сегодня его причины определены далеко не точно [3]. Известно только, что этот процесс может провоцироваться самыми разными факторами: от банальных стрессов, усталости и недостаточного сна до текущего гормонального фона, депрессивных состояний и приема медикаментов [9].
Рисунок 1. Патогенез мигрени
При этом мигрень проявляется не только головной болью: симптомы этой серьезной болезни гораздо разнообразнее, а зачастую и более болезненны. Изнурительные приступы мигрени могут быть мучительными и невыносимыми и подчас продолжаются от нескольких часов до нескольких дней, сопровождаясь тошнотой, рвотой и повышенной чувствительностью к свету, звукам и запахам [3], [10]. Такие приступы лишают возможности нормально мыслить, жить и работать миллионы людей во всем мире. Считается, что от мигрени сегодня страдает каждый седьмой житель планеты, а в рейтинге причин, ограничивающих трудоспособность, это заболевание заняло второе место в мире (по данным 2016 года) [11], [12].
Неудивительно, что мигрень была включена Всемирной организацией здравоохранения в список заболеваний, в наибольшей степени нарушающих социальную адаптацию пациентов [3].
Лечение мигрени сегодня
К сожалению, сегодня не существует лекарства , позволяющего раз и навсегда избавиться от мигрени. Применяющиеся препараты позволяют в основном снизить интенсивность и количество приступов или уменьшить симптомы и облегчить возникшую боль. В связи с этим терапию такими препаратами делят на две группы:
- Абортивная (острая) терапия — для снятия или уменьшения симптомов при уже появившейся мигрени.
- Профилактическое лечение — для снижения интенсивности, продолжительности или частоты возникновения приступов.
В этой статье мы рассказываем о медикаментозном лечении и профилактике, но оставляем «за кадром» разнообразное нефармакологическое лечение мигрени: от методик релаксации до когнитивно-поведенческой психотерапии и транскраниальной электростимуляции. Между тем, эти методы в ряде случаев могут быть эффективной альтернативой медикаментам при невосприимчивости или противопоказаниях к лекарственной терапии, а иногда и эффективно дополнять ее при комбинированном лечении мигреней [13].
Абортивная терапия
При лечении легкой и средней мигрени назначают различные анальгетики и НПВП (нестероидные противовоспалительные препараты), в том числе и широко известные парацетомол, ацетилсалициловая кислота и ибупрофен, иногда в сочетании с кофеином, кодеином или психотропными веществами в составе комбинированных лекарств [14], [15]. Существенный недостаток — возможный обратный эффект при неконтролируемом использовании анальгетиков: усугубление головной боли, которая в таких условиях может стать ежедневной [8], [15].
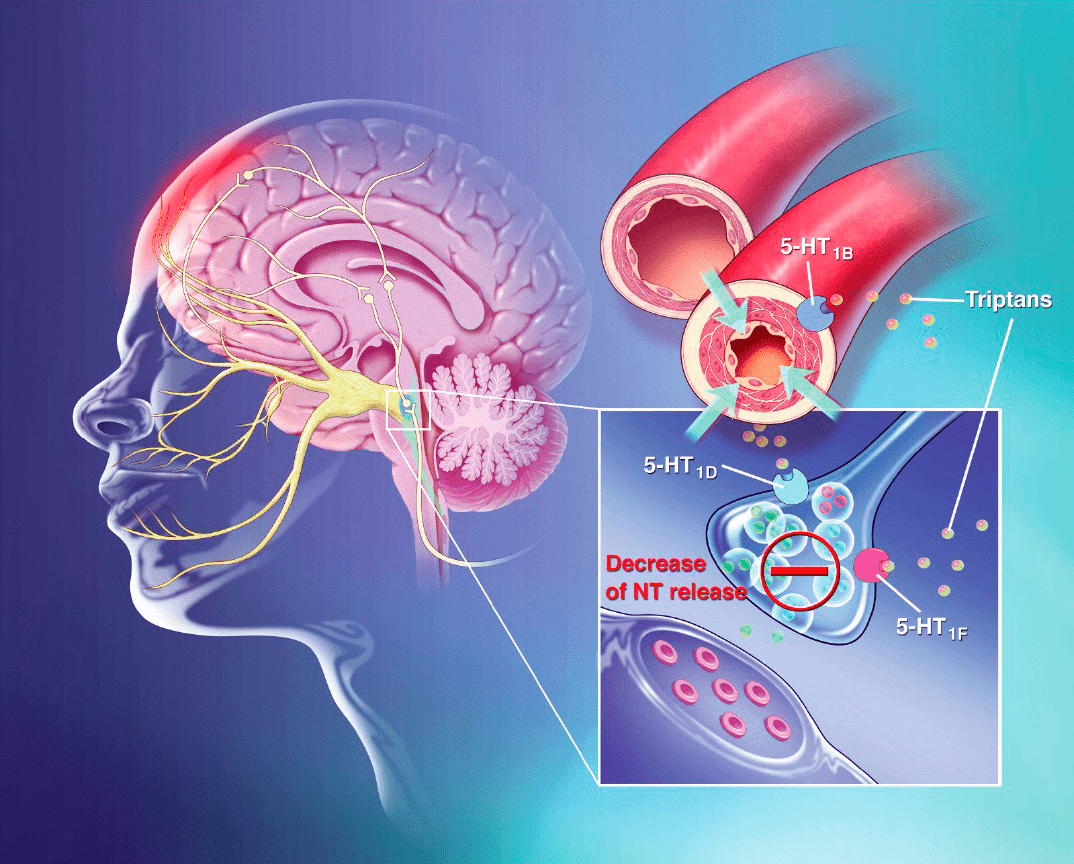
Когда же бороться приходится с более тяжелыми и продолжительными приступами мигренозной боли, в дело вступает «тяжелая артиллерия», а именно алкалоиды спорыньи и триптаны. Триптаны были первыми препаратами, созданными специально для лечения мигрени; их начали разрабатывать еще в далеком 1972 году. Уже тогда было известно, что алкалоид спорыньи эрготамин способен уменьшить приступы мигрени, что связывали с его сосудосуживающим действием [16]. Этот препарат оставался единственным специфичным средством лечения мигрени, пока в 1991 году рациональный поиск не привел, наконец, к появлению суматриптана — первого препарата нового класса, который действует схожим с эрготамином образом, однако более эффективен и безопасен (рис. 2) [16].
В отличие от своего знаменитого производного — ЛСД, — сам эрготамин не обладает галлюциногенными свойствами.
Рисунок 2. Триптаны — лекарства, применяемые для облегчения мигрени, — селективные агонисты серотониновых рецепторов. Они связываются с определенными подтипами таких рецепторов (5HT1B, 5HT1D и 5HT1F) и активируют их. Это приводит к ингибированию выделения нейромедиаторов из пресинаптической мембраны окончаний тройничного нерва (показан желтым цветом), располагающихся в сосудах головы. При этом ингибируется и выделение уже упомянутого CGRP — ключевого нейромедиатора, вызывающего мигрень. Этот «нейронный» механизм действия, как считается, блокирует основное патологическое звено в развитии мигрени. Известно также, что прием триптанов избирательно сужает сосуды твердой мозговой оболочки, снижает проницаемость сосудистой стенки и уменьшает отек. Так или иначе, эти лекарства эффективны — они уменьшают воспаление и боль, а также интенсивность сопутствующих симптомов мигрени [17]. Похожим образом действуют и алкалоиды спорыньи эрготамин и дигидроэрготамин, правда, они менее селективны — могут связываться с дофаминовыми и адренорецепторами, из-за чего их эффективность и безопасность ниже.
Однако несмотря на хороший профиль эффективности и безопасности, триптаны теоретически могут быть опасны для пациентов с ишемической болезнью сердца из-за своего сосудосуживающего действия, что сдерживает их широкое назначение в качестве терапии при мигрени [16].
Профилактическая терапия
Медикаментозная профилактика показана, когда мигрени регулярны (более 2–3 раз в месяц), и надо сказать, что сегодня такая терапия не совсем безопасна и эффективна: ее связывают со значительными побочными эффектами и развитием быстрой толерантности к лечению (тахифилаксией) [14]. При этом используют несколько классов лекарств, изначально разработанных для других показаний, и пока что во многом с неясным механизмом действия при мигрени. Из этих лекарств можно отметить: трициклические антидепрессанты, противоэпилептические препараты, бета-блокаторы, блокаторы кальциевых каналов, ингибиторы АПФ и некоторые другие [14], [19].
Кстати, о многих перечисленных лекарствах, их прямых показаниях, истории появления и механизме действия можно прочитать в первой статье нашего цикла «Три поколения лекарств» [1].
Таргетная терапия мигрени: решение проблемы?
Поскольку мигрень — хроническое заболевание, а эффективность и безопасность используемых для профилактики препаратов оставляет желать лучшего, очевидно, что в этой области есть неудовлетворенная потребность; при этом специально разработанных для этого показания новых лекарств существует немного [14].
Прорывом сегодня могут похвастаться Amgen и Novartis, получившие в мае 2018 года одобрение на применение таргетного препарата «Аймовиг» (антитела erenumab) для профилактики мигрени у взрослых пациентов [20]. Это первое появившееся на рынке полностью человеческое антитело, профилактическое действие которого обусловлено связыванием и блокированием рецептора CGRP, роль которого в развитии мигрени считается критически важной (рис. 3).
Рисунок 3. «Аймовиг» специфически связывается с CGRP-рецептором, предотвращая связывание с ним CGRP. Связывание CGRP со своим рецептором в молекулярный комплекс (на рисунке слева) приводит к передаче ассоциированных с мигренью болевых сигналов. У людей с мигренью уровни CGRP повышены при болевом приступе и возвращаются к нормальному уровню, когда мигренозная боль отступает.
«Аймовиг» был одобрен после трех серий клинических испытаний, результаты которых хоть и несколько разнились, но были сходны в одном: препарат показывал достоверное снижение числа дней с приступами и общей длительности мигренозной боли. При этом в испытаниях фазы III у 50% пациентов, принимавших по 140 мг «Аймовига», число болезненных дней снизилось в сравнении с плацебо аж вдвое, а безопасность и переносимость препарата оказалась как раз-таки вполне подобной плацебо [21], [22]. Такие результаты весьма обнадеживают, и очевидно, что хоть «Аймовиг» и не является панацеей, его применение определенно изменит к лучшему жизнь пациентов, страдающих частыми и тяжелыми формами мигрени.
«Аймовиг» и конкуренты
Надо сказать, что в поле таргетной противомигренозной терапии у Novartis и Amgen уже появились серьезные конкуренты: Eli Lilly выпустила Emgality, а Teva Pharmaceutical — Ajovy. Эти препараты — гуманизированные моноклональные антитела, нацеленные на лиганд, а не на рецептор CGRP, и этим отличаются от «Аймовига», уступая последнему также как минимум в переносимости. При применении Ajovy 43–45% пациентов столкнулись с болью, покраснениями и зудом в месте инъекции, при использовании Emgality — 18% больных испытали подобные симптомы, а «Аймовиг» вызвал такие реакции только в 5–6% случаев. При этом «Аймовиг» еще и удобнее для использования, поскольку из трех перечисленных препаратов только он поставляется в виде автоинъектора — устройства, напоминающего инсулиновую шприц-ручку, — пользоваться которым надо лишь раз в месяц. Перечисленные преимущества, вкупе с тем, что «Аймовиг» стал первым таргетным препаратом для лечения мигрени и сразу же занял на рынке пустующую нишу, скорее всего обеспечат ему светлое финансовое будущее: по прогнозам экспертов, его доля на рынке в 2024 году составит $2 млрд, в то время как прогнозируемые доли конкурентов приблизительно вдвое меньше [20].
Успеху «Аймовига», по всей видимости, не сможет помешать даже крайне высокая цена ($575 в месяц по прайс-листу Amgen — правда, в США у многих пациентов препарат покрывается страховкой), которую, кстати, некоторые эксперты считают неразумной [11]. Компания проводит исследование «Аймовига» и в России, но когда препарат появится на рынке, сколько будет стоить и кем оплачиваться — пока неизвестно.
Заключение
Мигрень сегодня — серьезнейшая проблема: эта болезнь нарушает трудоспособность и снижает качество жизни огромного числа людей во всем мире. При этом ее лечение остается непростой задачей: длительное изучение болезни и испытания множества лекарств и нефармакологических средств лечения пока не привело к победе над недугом. Однако появление на рынке современных таргетных препаратов уже вывело лечение многих болезней на совершенно новый уровень [23], и потому создание точечно действующего лекарства против мигрени — определенно, шаг в верном направлении.
«Аймовиг» уже сейчас улучшает лечение мигрени, а вот смогут ли будущие препараты насовсем избавить человечество от этого хронического заболевания, покажет только время…
- Три поколения лекарств;
- Поиск лекарственных мишеней;
- Саноева М.Ж. и Саидвалиев Ф.С. (2016). Мигрень — вчера, сегодня, завтра. Современный взгляд на проблему. «Международный неврологический журнал». 8, 72–78;
- How a migraine happens. Johns Hopkins Medicine;
- Migraine headaches. (2018). WebMD;
- Paul L. Durham. (2006). Calcitonin Gene-Related Peptide (CGRP) and Migraine. Headache. 46, S3-S8;
- What to know about the new anti CGRP migraine treatment options. (2018). American Migraine Foundation;
- Silberstein S.D. (2016). Мигрень. Справочник MSD;
- Migraine triggers: your personal checklist. (2019). WebMD;
- Русакова Е. (2018). FDA одобрило препарат для предотвращения мигрени. N+1;
- Kolata G. (2018). F.D.A. approves first drug designed to prevent migraines. The New York Times;
- Theo Vos, Amanuel Alemu Abajobir, Kalkidan Hassen Abate, Cristiana Abbafati, Kaja M Abbas, et. al.. (2017). Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet. 390, 1211-1259;
- Francesca Puledda, Kevin Shields. (2018). Non-Pharmacological Approaches for Migraine. Neurotherapeutics. 15, 336-345;
- Doodipala Samba Reddy. (2013). The pathophysiological and pharmacological basis of current drug treatment of migraine headache. Expert Review of Clinical Pharmacology. 6, 271-288;
- Ogbru A. and Ogbru O. Prescription migraine medications. RxList;
- Boyce S., Ali Z., Hill R.G. (2001). New developments in analgesia. Drug Discovery World;
- Азимова Ю.Э. (2017). Триптаны: эра специфического лечения мигрени. «Нервные болезни». 1, 10–14;
- Ameri M. and Lewis H. (2018). The evolution of transdermal drug delivery and treating migraine. Drug Discovery World;
- Migraine medications. (2013). TMedWeb;
- Дмитриев Р. (2019). «Аймовиг» превратит хроническую мигрень в эпизодическую. «Мосмедпрепараты»;
- Aimovig (erenumab) for the treatment of episodic migraine. Clinical Trials Arena;
- Хоружая А. (2018). Новый препарат против мигрени выходит в продажу. «Нейроновости»;
- Таргетная терапия — прицельный удар по болезни.