Самые безопасные статины для снижения холестерина
Дата публикации: 22.06.2021
Высокое давлениеДля сердца и сосудовИнсультПри диабетеСердечная недостаточностьТаблеткиТаблеткиХолестерин
Содержание статьи
- Когда холестерин становится опасен
- Если повышен холестерин в крови: что делать
- Как снизить холестерин в крови
- Задайте вопрос эксперту по теме статьи
Каждая клетка практически всех живых организмов содержит холестерин (ХС) – жироподобную субстанцию, передающуюся по системе кровообращения. Без этого вещества невозможно нормальное функционирование нервной, иммунной, пищеварительной систем. Но при повышенных показателях ХС начинает откладываться на сосудистых стенках. Это приводит к образованию бляшек, сужающих сосуды и нарушающих их эластичность. Почему же растет уровень холестерина и как с ним бороться?
Когда холестерин становится опасен
Большая часть вещества (около 70-80%) вырабатывается организмом, и только его небольшая часть поступает извне. Но вредит здоровью не весь холестерин, а только «плохой» – липопротеид низкой плотности (ЛПНП). «Хороший» же необходим для транспортировки избыточного ХС из тканей к печени для переработки и выведения. Поэтому большая концентрация «хорошего» ХС полезна для организма.
При увеличении показателей ЛПНП переработка и выведение избытков ХС нарушается. Постепенно откладывающиеся на сосудистых стенках излишки вызывают атеросклероз, от которого страдают сосуды, снабжающие кровью почки, кишечник, нижние конечности. Повреждения сосудов, питающих мозг, вызывают такие симптомы, как головокружения, обмороки, а затем развивается инсульт. Опасен атеросклероз и для сердечно-сосудистой системы. Ухудшение проходимости сосудов приводит к ИБС (ишемическая болезнь сердца), а в будущем – к инфаркту миокарда.
Высокая концентрация ХС до момента развития серьезных патологий никак не отражается на самочувствии. Поэтому даже молодым людям рекомендуется периодически сдавать анализ на общий холестерин. И при отклонениях от нормы срочно принимать меры.
Если повышен холестерин в крови: что делать
Решать проблему нужно комплексно. Для выбора оптимальных методов борьбы с повышенным ХС обязательно проконсультируйтесь с кардиологом. На начальных стадиях снижения показателей нередко удается добиться без применения медикаментов. В зависимости от степени риска, врач может посоветовать:
- Отказаться от плохих привычек – курение и алкоголь в больших количествах негативно влияют на сосуды, поэтому не стоит создавать для них дополнительную нагрузку.
- Повысить физическую активность – самый простой способ поддерживать хорошее состояние сосудов. Полезна ежедневная кардионагрузка продолжительностью не менее 30 минут: ходьба, бег трусцой, велосипед. Выработать привычку больше двигаться помогут фитнес-часы.
- Снизить вес – высокий ХС – частый спутник повышенной массы тела. Ожирение увеличивает риск диабета, гипертонии, болезней сердца. Чтобы защитить себя от этих болезней, нужно постараться сбросить лишние килограммы.
- Пересмотреть рацион – отказаться от продуктов, в состав которых входят трансжиры (фастфуд, продукты вторичной переработки), употреблять побольше клетчатки, ввести в меню морскую рыбу, заменить черный чай зеленым. Также лучше отказаться от продуктов с высоким содержанием животных жиров: сливочное масло, жирное мороженое, сосиски и колбасы.
- Скорректировать режим. В исследовании, опубликованном SleepTrusted Source, исследователи обнаружили, что слишком большое или малое количество сна негативно влияет на уровень холестерина. Они обследовали группу из 1666 мужчин и 2329 женщин старше 20 лет. Сон менее пяти часов повышал уровень триглицеридов и снижал ЛПВП у женщин. Сон более восьми часов дал аналогичный результат. Мужчины оказались не так чувствительны к чрезмерному сну, как женщины.
В зависимости от состояния и результатов обследования, пациенту также может быть предложено медикаментозное лечение.
Нет времени читать длинные статьи? Подписывайтесь на нас в соцсетях: слушайте фоном видео и читайте короткие заметки о красоте и здоровье.
Мегаптека в соцсетях: ВКонтакте, Telegram, OK, Viber
Как снизить холестерин в крови
Для снижения ХС существует несколько групп препаратов, но стандартом лечения фактически считаются статины. В инструкции к средствам, содержащим эти вещества, говорится, что они снижают ЛПНП на 40-60% и способствуют повышению «хорошего» холестерина. Но при достаточно высокой эффективности, статины вызывают множество негативных реакций. Другая отрицательная сторона – принимать их после назначения придется постоянно. Поэтому врачи относятся к их применению с большой осторожностью, после всесторонней оценки всех рисков.
При каком холестерине надо начинать пить статины? Ответить на этот вопрос может только специалист после всестороннего обследования пациента. Идеальный уровень общего ХС не должен превышать 5,2 ммоль/л, а ЛПНП – 130 мг/дл. Но даже при повышенных показателях статины назначаются не всегда. При отсутствии высокой вероятности инфаркта или инсульта препараты не применяются. Если же в анамнезе присутствует сердечный приступ, они могут быть назначены даже при нормальном ЛПНП.
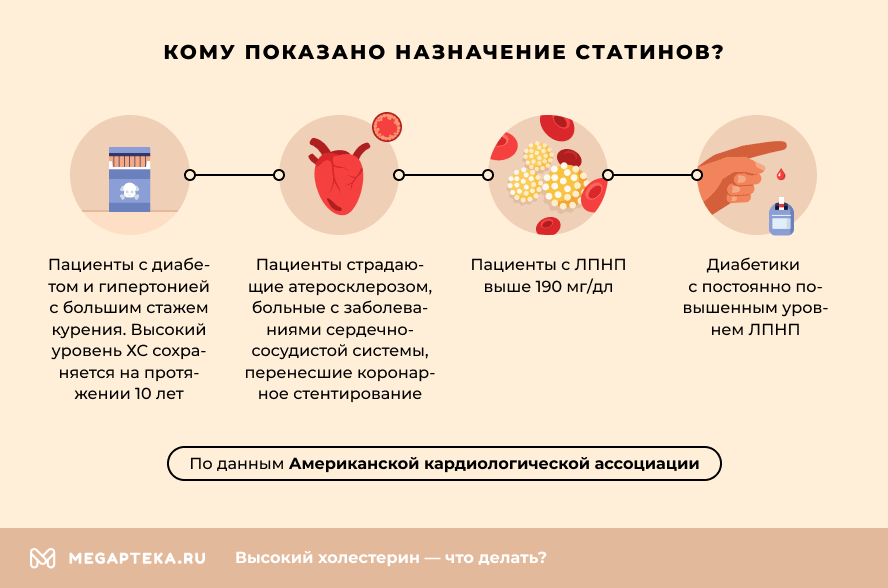
Американская кардиологическая ассоциация выделяет 4 группы пациентов, которым показано назначение этих лекарств. К ним относятся пациенты:
- С диабетом и гипертонией с большим стажем курения, у которых высокий уровень ХС сохраняется на протяжении последних 10 лет.
- Страдающих от атеросклероза. Также в эту группу входят больные с заболеваниями сердечно-сосудистой системы (ССС), перенесшие коронарное стентирование.
- С ЛПНП выше 190 мг/дл.
- Диабетики с постоянно повышенным уровнем ЛПНП.
Если пациент относится к одной или нескольким из этих групп, ему нужно принимать статины, начиная с низкой или средней дозировки. Возможно, изменив свой образ жизни и пересмотрев рацион, вам удастся снизить ХС без препаратов. Но, если статины были назначены, отказываться от их приема без консультации с кардиологом нельзя.
Относитесь к своему здоровью с максимальной ответственностью. Помните, что осложнения, вызываемые атеросклерозом, необратимы, полностью вылечить их невозможно. Лекарства не избавляют от уже имеющихся проблем, а лишь предотвращают развитие новых.
- «Cholesterol Medications», Американская кардиологическая ассоциация
- «Medicines for high cholesterol», Национальная служба здравоохранения Великобритании
- «Cholesterol-lowering Medicine», Центры по контролю и профилактике заболеваний США
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Там же Вы можете поделиться своим опытом с другими читателями Мегасоветов.
Выпускающий редактор
Эксперт-провизор
Поделиться мегасоветом
Понравилась статья? Расскажите маме, папе, бабушке и тете Гале из третьего подъезда
Гид по аналогам за подписку
подпишитесь на соцсети и напишите в сообщения «аналоги»

Товары из категории — Препараты для лечения онкологических заболеваний
Инструкция по применению
Цена в интернет-аптеке WER.RU: от 175 350
Фармакологические свойства
Кстанди – медицинский препарат, который предназначен для терапии опухолей и новообразований предстательной железы в тяжелой форме, когда оперативное вмешательство или лечение медикаментами не помогает и не способствует понижению андрогенов.
Активный действующий компонент медикамента – энзалутамид. Это искусственно созданный антиандроген, действие которого направлено на блокировку использования организмом любых гормонов, вырабатываемых мужскими и женскими половыми железами, и корой надпочечников.
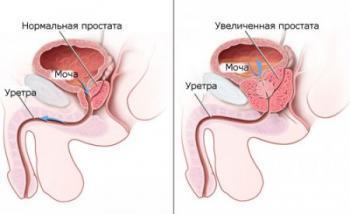
Рак предстательной железы – заболевание, которое характерно для представителей мужского пола, опухоль формируется ниже мочевика непосредственно перед прямой кишкой. Под воздействием мужского гормона тестостерона и других гормонов репродуктивной системы опухоль растет и развивается.
Если терапевтическое действие направить на понижение числа андрогенов в организме мужчины, то можно добиться уменьшения новообразования и замедления ее развития вплоть до полной остановки. Кстанди способствует понижению активной деятельности половых гормонов, и как следствие, замедляет рост и развитие опухоли.
После проведенных многочисленных исследований препарата было установлено, что он эффективно борется с раковыми опухолями, уменьшая риск их развития. Прием препарата, содержащего энзалутамид, способствует уменьшению смертности из-за онкологических заболеваний предстательной железы. Многим пациентам, которые вовремя начали прием медикамента, не понадобилось лечение инфекционных, опухолевых заболеваний с помощью воздействия на больные участки химическими препаратами.
Состав и форма выпуска
Медикаментозное средство выпускается в виде непрозрачных капсул, имеющих белый цвет. На одной из сторон таблетки имеется гравировка черного цвета в виде буквенных изображений. Внутри каждой капсулы содержится действующее вещество в виде тягучей маслообразной жидкости желтоватого оттенка.
В состав препарата входят:
Препарат продается в картонных упаковках по 28 таблеток в блистере. В комплекте идет инструкция.
Показания к применению
Медикаментозное средство используется для терапии опухолей предстательной железы в тяжелой форме. Производитель гарантирует эффективность лекарственного средства в борьбе с раком простаты, когда хирургическое вмешательство не приносит результатов или не может быть выполнено.
Международная классификация болезней (МКБ-10)
С.61. Злокачественное новообразование предстательной железы;
С79.8. Вторичное злокачественное новообразование других уточненных локализаций.
Побочные эффекты
Прием медикаментозного средства Кстанди может привести к проявлению ряда побочных признаков:
При появлении следующих симптоматических признаков стоит прекратить прием медикамента, содержащего энзалутамид:
Прием медикамента может привести к снижению скорости реакции, потери сознания и рассеянности, поэтому следует воздержаться от управления транспортными средствами и выполнения работы, требующей концентрации внимания.
Перед приёмом медикамента необходимо сообщить лечащему врачу о наличии следующих проблем со здоровьем: заболевания сердечно-сосудистой системы, эпилептические припадки, перенесенные травматические повреждения головы, острое нарушение мозгового кровообращения, опухоли мозга, непроизвольные сокращения мышц.
Противопоказания
Медикаментозное средство не рекомендуется принимать пациентам, у которых обнаружена непереносимость к энзалутамиду или другим компонентам препарата. С осторожностью следует принимать медикамент детям, пожилым людям, пациентам с почечными и печеночными заболеваниями, так как нет клинических данных и показаний о воздействии медикамента на эти группы больных.
Применение при беременности
Медикаментозное средство предназначено для лечения представителей мужского пола, однако прием медикамента мужчиной во время зачатия ребенка может оказать влияние на плод и привести к риску возникновения врожденных дефектов и отставанию в развитии плода. Во время применения медикамента, а также спустя три месяца после, следует использовать надежные средства контрацепции.
Способ и особенности применения
Медикаментозное средство следует принимать только по назначению лечащего врача, после проведения всех необходимых медицинских обследований, сдачи всех анализов, а также точного определения клинической картины заболевания.
Согласно инструкции по применению, рекомендуемая суточная доза составляет четыре таблетки по 40 мг. ежедневно. Принимают медикамент независимо от времени употребления пищи внутрь, запивая достаточным количеством жидкости.
При пропуске таблетки необходимо восполнить пробел в этот же день, если прошло больше суток, то не стоит увеличивать ежедневную дозировку.
Точную дозировку и продолжительность курса лечения назначает пациенту лечащий врач.
Взаимодействие с другими лекарствами
При приеме других медикаментов следует сообщить об этом лечащему врачу, который примет решение о возможности совмещения препаратов или об отмене одного из них в случае несовместимости. Это касается не только сильнодействующих лекарственных препаратов, но и биологически активных добавок, витаминов, гомеопатических средств.
При приеме следующих видов лекарственных средств и Кстанди следует соблюдать осторожность и находиться под наблюдением медицинского персонала:
Передозировка
При передозировке медикаментозным средством или энзалутамидом следует незамедлительно сообщить об этом лечащему врачу. При чрезмерном употреблении медикамента следует незамедлительно прекратить его применение. Полный вывод средства из организма происходит в течение 6 дней. Передозировка медикаментом может привести к риску проявления побочных эффектов в острой форме, а также к судорогам.
Аналоги
Аналогами медикамента Кстанди по составу, а также фармакологическому воздействию являются:
Решение о замене медикамента, а также его отмене принимает исключительно лечащий врач.
Условия продажи
Медикаментозное средство продается в аптечных пунктах по назначению лечащего врача при наличии рецептурного листа.
Условия хранения
Медикамент Кстанди следует хранить в недоступном для доступа детей месте при комнатной температуре, не превышающей 30 ° С. В инструкции содержатся более подробные сведения о нормах и правилах хранения медикамента в открытом и запечатанном виде.
Цены на Кстанди в Москве
Заберите заказ в в аптеке
WER (г. Москва)
Цена: от 175 350 руб.
Сертификаты и лицензии
Кстанди — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер :
ЛП-003605
Действующее вещество :
Энзалутамид
Лекарственная форма :
капсулы
Состав :
На 1 капсулу:
Раствор-наполнитель
Действующее вещество: энзалутамид (MDV3100) 40,0 мг;
Вспомогательные вещества: каприлокапроил макроголглицериды 905,81 мг, бутилгидроксианизол 0,095 мг, бутилгидрокситолуол 0,095 мг; гелевая масса 444,3 мг (желатин 260,6 мг, вода очищенная 191,7 мг, раствор сорбитола и сорбитана 90,3 мг, глицерин 90,3 мг, титана диоксид 3,10 мг); черные чернила — незначительное количество (этанол безводный, этилацетат, пропиленгликоль, краситель железа оксид черный, поливинилацетатфталат, вода очищенная, изопропиловый спирт, макрогол 400, раствор аммиака концентрированный).
Описание :
Непрозрачная, продолговатая мягкая желатиновая капсула от белого до почти белого цвета с маркировкой «ENZ» черными чернилами на одной стороне.
Содержимое капсулы — маслянистая жидкость светло-жёлтого цвета.
Фармакотерапевтическая группа :
Антиандроген
АТХ :
L.02.B.B.04
Фармакодинамика :
Механизм действия
Рак предстательной железы зависит от наличия андрогенов и реагирует на подавление активности андрогенных рецепторов. Несмотря на низкие или даже неопределяемые уровни андрогенов в плазме крови, активность андрогенных рецепторов на клетках опухоли продолжает способствовать прогрессированию болезни. Стимуляция роста опухолевых клеток с помощью андрогенных рецепторов требует их транслокации в ядро клетки и связывания с ДНК.
Энзалутамид является мощным ингибитором андрогенных рецепторов, который блокирует несколько этапов сигнального пути андрогенных рецепторов.
Энзалутамид конкурентно ингибирует связывание андрогенов с андрогенными рецепторами, угнетает ядерную транслокацию активированных рецепторов и ингибирует связывание активированных рецепторов андрогенов с ДНК даже в условиях избыточной экспрессии андрогенных рецепторов и в клетках опухоли, резистентных к антиандрогенам. Лечение энзалутамидом подавляет рост клеток опухоли предстательной железы и может индуцировать гибель клеток и регрессию опухоли.
В доклинических исследованиях у энзалутамида отсутствовала активность агониста андрогенных рецепторов.
Фармакодинамика
В ходе клинического исследования III фазы у пациентов после неэффективности химиотерапии доцетакселом, у 54% пациентов, получавших
энзалутамид, по сравнению с 1,5% пациентов, получавших плацебо, наблюдалось, по крайней мере, 50%-ное снижение уровня ПСА по сравнению с исходным уровнем.
Клиническая эффективность и безопасность
Эффективность энзалутамида была установлена в двух рандомизированных, плацебо-контролируемых, многоцентровых клинических исследованиях III фазы [CRPC2 (AFFIRM), MDV3100-03 (PREVAIL)] у пациентов с прогрессирующим метастатическим раком предстательной железы, у которых прогрессия заболевания наблюдалась на фоне антиандрогенной терапии [при использовании аналога лютеинизирующего гормона рилизинг-гормона (ЛГРГ) или после билатеральной орхиэктомии]. В исследовании PREVAIL принимали участие пациенты, не получавшие лечения с использованием химиотерапии; при этом в исследовании AFFIRM принимали участие пациенты, получавшие до этого химиотерапию с использованием доцетаксела. Все пациенты продолжали прием аналогов ЛГРГ или перенесли билатеральную орхиэктомию.
Исследование MDV3100-03 (PREVAIL) (пациенты, не получавшие химиотерапию)
1717 пациентов без симптомов или с умеренно выраженными симптомами были рандомизированы 1:1 в группы энзалутамида в дозе 160 мг 1 раз в день (N = 872) либо плацебо 1 раз в день (N = 845).
При проведении предварительно запланированного промежуточного анализа для общей выживаемости было показано, что лечение энзалутамидом приводило к статистически достоверному увеличению общей выживаемости по сравнению с плацебо со снижением риска смерти на 29,4%, [отношение рисков (ОР) = 0,706 (95% ДИ: 0,596; 0,837), р <0,0001]. На момент проведения промежуточного анализа 27,6% (241 из 872) пациентов в группе энзалутамида умерли по сравнению с 35,4% (299 из 845) пациентов в группе плацебо. Расчетная медиана общей выживаемости составила 32,4 месяца (95% ДИ: 30,1, не достигнута) в группе энзалутамида и 30,2 месяца (95% ДИ: 28,0, не достигнута) в группе плацебо. Кроме того, 40% пациентов в группе энзалутамида и 70% пациентов в группе плацебо получали последующие варианты терапии с доказанным увеличением общей выживаемости.
При проведении запланированного анализа рБПВ было продемонстрировано статистически достоверное улучшение между группами лечения со снижением риска радиографической прогрессии или смерти на 81,4% в группе энзалутамида [ОР = 0,186 (95% ДИ: 0,149, 0,231), р < 0,0001]. Прогрессия отмечалась у ста восемнадцати (14%) пациентов в группе энзалутамида и у 321 (40%) пациентов в группе плацебо. Медиана рБПВ не была достигнута (95% ДИ: 13.8, не достигнута) в группе энзалутамида и составила 3.9 месяцев (95% ДИ: 3,7, 5,4) в группе плацебо. Одинаковое улучшение рБПВ наблюдалось среди всех заранее определенных подгрупп пациентов (возраст, исходный статус ECOG, исходный уровень ПСА и ЛДГ, балл Глисона на момент диагноза, висцеральное заболевание при скрининге). При проведении запланированного анализа рБПВ во время наблюдения, который основывался на оценке радиографической прогрессии исследователем, было продемонстрировано статистически достоверное улучшение между группами лечения со снижением риска радиографической прогрессии или смерти на 69,3% в группе энзалутамида [ОР = 0,307 (95% ДИ: 0.267, 0,353), р < 0,0001]. Медиана рБПВ составила 19,7 месяца в группе энзалутамида и 5,4 месяца в группе плацебо.
В дополнение к составным первичным показателям эффективности статистически достоверное улучшение было продемонстрировано в отношении следующих проспективно определенных конечных точек.
Медиана времени до начала цитотоксической химиотерапии составила 28,0 месяцев в группе энзалутамида и 10,8 месяцев в группе плацебо (ОР = 0,350, 95% ДИ: [0,303, 0,403], р< 0,0001).
Процент пациентов в группе энзалутамида с исходно определявшимся заболеванием и имевших объективный ответ со стороны мягких тканей составил 58,8% (95% ДИ: 53,8, 63,7) по сравнению с 5,0% (95% ДИ: 3,0, 7,7) пациентов в группе плацебо. Абсолютное различие в объективном ответе со стороны мягких тканей между группами энзалутамида и плацебо составило 53,9% (95% ДИ: 48,5%, 59,1%, р < 0,0001). Полный ответ был отмечен у 19,7% пациентов в группе энзалутамида по сравнению с 1,0% пациентов в группе плацебо, и частичный ответ был отмечен у 39,1% пациентов в группе энзалутамида против 3,9% пациентов в группе плацебо.
Энзалутамид достоверно снижал риск первого костного осложнения на 28% [ОР = 0,718 (95% ДИ: 0,610, 0,844) р < 0,0001]. У пациентов, получавших
энзалутамид, отмечался достоверно более высокий ПСА-ответ (определялся как снижение > 50% от исходного уровня), по сравнению с пациентами, получавшими плацебо, 78,0% против 3,5% (различие = 74,5%, р < 0,0001).
Медиана времени до ПСА-прогрессии по критериям PCWG2 составила 11.2 месяца для пациентов в группе энзалутамида и 2,8 месяца для пациентов в группе плацебо [ОР = 0,169, (95% ДИ: 0,147, 0,195), р < 0,0001].
Лечение энзалутамидом снижало риск ухудшения по шкале FACT-Р на 37,5% по сравнению с плацебо (р < 0,001). Медиана времени до ухудшения по шкале FACT-P составила 11,3 месяцев в группе энзалутамида и 5,6 месяцев в группе плацебо.
Исследование CRPC2 (AFFIRM) (пациенты, получавшие химиотерапию)
Эффективность и безопасность энзалутамида у пациентов с метастатическим кастрационно-резистентным раком предстательной железы (КРРПЖ), которые получали
доцетаксел и использовали аналог ЛГРГ или перенесли орхиэктомию, оценивалась в рандомизированном, плацебо-контролируемом, многоцентровом клиническом исследовании III фазы. 1199 пациентов были рандомизированы 2:1 в группы энзалутамида в дозе 160 мг 1 раз в день (N = 800) либо плацебо 1 раз в день (N = 399).
Запланированный по протоколу промежуточный анализ после 520 смертей продемонстрировал статистически значимое превосходство в общей выживаемости у пациентов, получавших
энзалутамид, по сравнению с пациентами из группы плацебо: медиана выживаемости 18,4 и 13,6 месяцев соответственно (ОР = 0,631 95% ДИ: [0,529, 0,752], р< 0,0001).
Радиографическая выживаемость без прогрессии (оценка исследователей с использованием критериев оценки ответа солидных опухолей на терапию (RESICT) версии 1.1 для мягких тканей и появление 2 или более поражений костей на остеосцинтиграфии) составила 8,3 месяца у пациентов, получавших
энзалутамид, и 2,9 месяца у пациентов, получавших плацебо (ОР = 0,404, 95% ДИ: [0,350, 0,466], р < 0,0001). Анализ включал 216 смертей без документированного прогрессирования и 645 документально подтвержденных случаев прогрессии, 303 из которых (47%) были связаны с прогрессированием в мягких тканях, 268 (42%) были обусловлены прогрессированием костных метастазов и 74 (11%) были связаны с поражением мягких и костных тканей. Подтвержденное снижение уровня ПСА на 50% или 90% наблюдалось у 54,0% и 24,8% пациентов, которые получали
энзалутамид, и у 1,5% и 0,9% пациентов, которые получали плацебо (р<0,0001). Медиана времени до ПСА-прогрессии составила 8,3 месяца у пациентов, которые получали
энзалутамид, и 3,0 месяца у пациентов из группы плацебо (ОР = 0,248, 95% ДИ: [0,204, 0,303], р < 0,0001).
Медиана времени до появления первого костного осложнения составила 16,7 месяцев у пациентов, получавших
энзалутамид, и 13,3 месяца у пациентов, получавших плацебо (ОР = 0,688, 95% ДИ: [0,566, 0,835], р <0,0001). Эффективность энзалутамида у пациентов, получавших
абиратерон, не была изучена.
Пожилые люди
Из 1671 пациента, получавшего
энзалутамид в исследованиях фазы III, 1261 пациент (75%) был в возрасте 65 лет и старше и 516 пациентов (31%) были в возрасте 75 лет и старше. У данных пожилых пациентов и более молодых пациентов не отмечалось каких-либо различий в безопасности и эффективности.
Фармакокинетика:
Энзалутамид плохо растворим в воде. В данном препарате растворимость энзалутамида увеличена благодаря использованию каприлокапроил макроголглицеридов и эмульгатора/сурфактанта. В доклинических исследованиях абсорбция энзалутамида увеличивалась при растворении в каприлокапроил макроглицеридах.
Фармакокинетика энзалутамида была изучена у больных раком предстательной железы и у здоровых добровольцев. Средний период полувыведения (Т1/2) энзалутамида у пациентов после однократного перорального приема составляет 5,8 суток (от 2,8 до 10,2 дней), а равновесная концентрация достигается примерно через месяц. При ежедневном пероральном введении
энзалутамид аккумулируется примерно в 8,3 раз быстрее разовой дозы. Суточные колебания концентрации в плазме крови незначительные (соотношение от пика до минимума 1,25). Выведение энзалутамида, главным образом, осуществляется путем печеночного метаболизма с образованием активного метаболита, который является столь же активным, как и
энзалутамид и циркулирует в плазме примерно в той же концентрации, что и
энзалутамид.
Абсорбция
Максимальная концентрация в плазме (Сmах) энзалутамида у пациентов наблюдалась через 1-2 часа после приема. На основе изучения баланса массы у людей, всасывание при пероральном приеме энзалутамида оценивается, по меньшей мере, на уровне 84,2%.
Энзалутамид не является субстратом эффлюксных транспортеров Р-гликопротеина или BCRP. Стабильный уровень, среднее значение Сmах энзалутамида и его активного метаболита составляет 16,6 пг/мл (коэффициент вариации [CV] 23%) и 12,7 пг/мл (CV 30%) соответственно.
Прием пищи не оказывает значимого влияния на степень абсорбции энзалутамида. В клинических исследованиях Кстанди применялся независимо от приема пищи.
Распределение
Средний объем распределения энзалутамида у пациентов после однократного перорального приема составляет 110 л (CV 29%). Объем распределения энзалутамида больше, чем объем общего количества жидкости в организме, что указывает на активное распределение в периферических тканях. Исследования на грызунах показали, что
энзалутамид и его активный метаболит может проникать через гематоэнцефалический барьер.
Энзалутамид на 97-98% связывается с белками плазмы, в первую очередь с альбумином. Активный метаболит связывается с белками плазмы на 95%. В исследованиях in vitro не отмечалось замещения связывания с белками плазмы между энзалутамидом и другими препаратами с высокой связывающей способностью (
варфарин,
ибупрофен и
салициловая кислота).
Метаболизм
Энзалутамид активно метаболизируется. В плазме крови человека присутствуют два основных метаболита: N-десметил
энзалутамид (активный) и производное соединение карбоновой кислоты (неактивный).
Энзалутамид метаболизируется ферментами CYP2C8 и, в меньшей степени, CYP3A4/5, которые играют важную роль в формировании активного метаболита. В исследовании in vitro N-десметил
энзалутамид метаболизируется до метаболита карбоновой кислоты за счет карбоксилэстеразы 1, которая также играет небольшую роль в метаболизме энзалутамида до метаболита карбоновой кислоты. N-десметил
энзалутамид не метаболизировался ферментами CYP in vitro.
В условиях клинического применения
энзалутамид является сильным индуктором фермента CYP3A4, умеренным индуктором ферментов CYP2C9 и CYP2C19, и не имеет клинически значимого влияния на фермент CYP2C8.
Выведение
Средний кажущийся клиренс энзалутамида у пациентов составляет от 0,520 и 0,564 л/час. При пероральном приеме меченного 14С-энзалутамида к 77 дню выводилось приблизительно 84,6% радиоактивной дозы: 71,0% выводился почками (в первую очередь как неактивный метаболит с незначительным количеством энзалутамида и активного метаболита), и 13,6% выводился через кишечник (0,39% дозы энзалутамида в неизмененном виде).
Данные лабораторных исследований показывают, что
энзалутамид не является субстратом для ОАТР1В1, ОАТР1В3 или ОСТ1; и N-десметил
энзалутамид не является субстратом для Р-гликопротеина и BCRP.
Данные лабораторных исследований показывают, что
энзалутамид и его основные метаболиты не ингибируют следующие транспортеры при клинически значимых концентрациях: ОАТР1В1, ОАТР1В3, ОСТ2 или ОАТ1.
Линейность
В диапазоне доз от 40 до 160 мг серьезных отклонений от пропорциональности дозы не наблюдается. Значения стабильного уровня Cmin энзалутамида и его активного метаболита у отдельных пациентов оставались неизменными в течение более одного года продолжительной терапии, демонстрируя временную линейную фармакокинетику после достижения стабильного уровня концентрации.
Особенности фармакокинетики у отдельных категорий пациентов
Пациенты с почечной недостаточностью
Исследования по применению энзалутамида у пациентов с почечной недостаточностью не проводились. Пациенты с уровнем сывороточного креатинина > 177 мкмоль/л (2 мг/дл) были исключены из клинических исследований. Основываясь на популяционном анализе фармакокинетики, для пациентов со значениями клиренса креатинина > 30 мл/мин (по формуле Кокрофт и Голт) коррекция дозы не требуется.
Энзалутамид не изучался у пациентов с тяжелой почечной недостаточностью (клиренс креатинина < 30 мл/мин) или терминальной стадией почечной недостаточности, поэтому при лечении этих пациентов рекомендуется назначать препарат с осторожностью. Маловероятно, что
энзалутамид будет значительно выводиться с помощью интермиттирующего гемодиализа или постоянного амбулаторного перитонеального диализа.
Пациенты с печеночной недостаточностью
Фармакокинетика энзалутамида была изучена у пациентов с исходной легкой (N = 6) или умеренной (N = 
Пациенты с исходной тяжелой печеночной недостаточностью (класс С по шкале Чайлд-Пью) были исключены из клинических исследований.
Расовая принадлежность
Большинство пациентов, участвовавших в клинических исследованиях (>84%), были европейцами. По данным исследования фармакокинетики у пациентов с раком предстательной железы в Японии не отмечалось клинически значимых различий в фармакокинетике между европейцами и японцами. Данных для оценки потенциальных различий фармакокинетики энзалутамида между другими расами недостаточно.
Пожилые люди
Не было отмечено клинически значимого влияния возраста на фармакокинетику энзалутамида. Коррекция дозы у пожилых людей не требуется.
Показания к применению
Кстанди показан для лечения метастатического кастрационно-резистентного рака предстательной железы.
Противопоказания
Гиперчувствительность к активному компоненту или к любому из вспомогательных веществ препарата.
Противопоказано женщинам и детям.
Тяжелое нарушение функции печени.
С осторожностью :
Риск развития судорог
Кстанди следует применять с осторожностью у пациентов, страдающих эпилептическими припадками или другими предрасполагающими факторами, включая, но не ограничиваясь, травмы головного мозга, инсульт, первичные опухоли головного мозга или метастазы в головной мозг, алкоголизм. Кроме того, риск развития судорог может быть повышен у пациентов, получающих сопутствующую терапию лекарственными средствами, которые снижают судорожный порог.
Синдром задней обратимой энцефалопатии
В ходе применения пациентами препарата Кстанди были зарегистрированы редкие сообщения о развитии синдрома задней обратимой энцефалопатии (PRES). Синдром задней обратимой энцефалопатии — это редкое обратимое неврологическое заболевание, которое может характеризоваться быстро развивающимися симптомами, такими как судороги, головная боль, спутанность сознания, слепота и другие зрительные и неврологические расстройства, сопровождаемые или несопровождаемые гипертензией. Диагноз синдром задней обратимой энцефалопатии должен быть подтвержден результатами томографии головного мозга, лучше всего результатами МРТ. Рекомендуется прекратить прием препарата Кстанди при подтвержденном диагнозе.
Одновременное применение с другими лекарственными средствами
Энзалутамид является мощным индуктором ферментов и может привести к снижению эффективности многих часто используемых лекарственных средств. Поэтому, начиная лечение энзалутамидом, необходимо провести анализ сопутствующих лекарственных средств. Следует избегать одновременного применения энзалутамида с лекарственными средствами, которые являются чувствительными субстратами многих метаболизирующих ферментов или транспортеров, если их терапевтическое воздействие имеет большое значение для пациента, а также если на основании контроля эффективности или концентрации в плазме невозможно скорректировать дозу.
Следует избегать одновременного применения с варфарином и кумарин-подобными антикоагулянтами. Если Кстанди используется совместно с антикоагулянтом, который метаболизируется ферментом CYP2C9 (например,
варфарин или
аценокумарол), требуется дополнительный контроль международного нормализованного отношения (МНО).
Почечная недостаточность
С осторожностью следует назначать пациентам с тяжелой почечной недостаточностью, так как действие энзалутамида в этой группе пациентов не изучено.
Печеночная недостаточность
С осторожностью следует назначать пациентам с умеренной печеночной недостаточностью (класс В по шкале Чайлд-Пью), так как отсутствуют конечные данные о применении препарата у пациентов с умеренной печеночной недостаточностью. Поскольку нет данных о применении препарата у пациентов с тяжелой печеночной недостаточностью, и
энзалутамид выводится, главным образом, через печень, Кстанди не рекомендуется применять у пациентов с тяжелой печеночной недостаточностью (класс С по шкале Чайлд-Пью).
Недавно перенесенные сердечно-сосудистые заболевания
В исследования III фазы не были включены пациенты, которые недавно перенесли инфаркт миокарда (в течение последних 6 месяцев) или страдают нестабильной стенокардией (в течение последних 3 месяцев), сердечной недостаточностью класса III или IV по шкале Нью-Йоркской кардиологической ассоциации (NYHA) за исключением пациентов с фракцией выброса левого желудочка (ФВЛЖ) более 45%, брадикардией или неконтролируемой артериальной гипертензией. Это необходимо принять во внимание при назначении Кстанди таким пациентам.
Андрогендепривационная терапия может удлинять интервал QT
У пациентов с наличием удлиненного интервала QT или с предрасполагающими факторами и у пациентов, получающих сопутствующую терапию препаратами, которые могут удлинять интервал QT, врачи перед назначением Кстанди должны оценить соотношение пользы и риска, включая возможность возникновения желудочковой тахикардии типа «пируэт».
Применение с химиотерапией
Безопасность и эффективность одновременного применения Кстанди с цитотоксической химиотерапией не установлена. Одновременное назначение энзалутамида не имеет клинически значимого эффекта на фармакокинетику доцетаксела, вводимого внутривенно; однако увеличение частоты нейтропении, вызванной приемом доцетаксела, нельзя исключать.
Вспомогательные вещества
Кстанди содержит
сорбитол (Е420). Пациентам с редкой наследственной непереносимостью фруктозы не следует принимать этот лекарственный препарат.
Беременность и лактация :
Женщины детородного возраста
Нет данных о применении Кстанди у женщин во время беременности, и это лекарственное средство не предназначено для использования у женщин детородного возраста.
Контрацепция для мужчин и женщин
Нет данных, присутствует ли
энзалутамид или его метаболиты в сперме. Если пациент имеет сексуальный контакт с беременной женщиной, во время и в течение 3 месяцев после лечения энзалутамидом требуется использование презерватива. Если пациент имеет сексуальный контакт с женщиной детородного возраста, необходимо использовать презерватив наряду с другими эффективными методами контрацепции во время и в течение 3 месяцев после лечения. Исследования на животных показали репродуктивную токсичность препарата.
Беременность и лактация
Энзалутамид не был изучен у женщин.
Энзалутамид противопоказан беременным женщинам и женщинам детородного возраста.
Способность к зачатию
Исследования на животных показали, что
энзалутамид оказывает воздействие на репродуктивную систему у самцов крыс и собак.
Способ применения и дозы
Дозы
Рекомендуемая суточная доза Кстанди составляет 160 мг (четыре капсулы по 40 мг) 1 раз в день. Капсулы следует проглатывать целиком, запивая водой, их можно принимать независимо от приема пищи.
Медикаментозная кастрация с использованием аналога ЛГРГ должна быть продолжена во время лечения у пациентов, не прошедших хирургическую кастрацию.
Если пациент пропустил прием Кстанди в обычное время, предписанную дозу следует принять как можно ближе к обычному времени. Если пациент пропустил прием препарата в течение целого дня, лечение следует возобновить на следующий день с обычной суточной дозы.
Если у пациента развивается токсичность 3 степени и выше или опасные нежелательные реакции, прием препарата необходимо отменить на одну неделю или до снижения симптомов до уровня 2 степени и ниже, а затем, если это оправдано, возобновить прием в такой же или уменьшенной дозировке (120 или 80 мг).
Одновременное применение с сильными ингибиторами фермента CYP2C8
По возможности, следует избегать одновременного применения сильных ингибиторов фермента CYP2C8. Если пациент должен одновременно принимать сильный ингибитор фермента CYP2C8, дозу энзалутамида необходимо снизить до 80 мг один раз в день. Если применение сильного ингибитора фермента CYP2C8 прекращено, дозу энзалутамида следует повысить до первоначального уровня.
Детский возраст
Энзалутамид противопоказан детям до 18 лет.
Побочное действие
Наиболее частыми нежелательными реакциями являются астения/усталость, «приливы», головная боль и гипертония. Другие важные нежелательные реакции включают падения, непатологические переломы, когнитивные расстройства и нейтропению.
Судороги наблюдались у 0,4% пациентов в группе энзалутамида и у 0,1% пациентов в группе плацебо.
Ниже приведены и распределены по частоте нежелательные реакции, наблюдавшиеся в ходе клинических исследований . Категории частоты распределены следующим образом: очень часто (?1/10); часто (от ?1/100 до <1/10); нечасто (от ?1/1000 до <1/100), редко (от ?1/10 000 до <1/1, 000), очень редко (<1/10 000); неизвестно (невозможно оценить на основании имеющихся данных). Все нежелательные реакции в каждой группе представлены в порядке убывания серьезности.
|
Система органов |
Частота |
|
Нарушения со стороны кроветворной и лимфатической системы |
нечасто: лейкопения, нейтропения |
|
Нарушения со стороны иммунной системы |
неизвестно*: отек языка, отек губ, отек глотки |
|
Системные нарушения |
очень часто: астения/у стал ость |
|
Психические расстройства |
часто: чувство страха нечасто: визуальные галлюцинации |
|
Нарушения со стороны нервной системы |
очень часто: головная боль часто: ухудшение памяти, потеря памяти, нарушение внимания, синдром беспокойных ног нечасто: когнитивные расстройства, судороги неизвестно*: синдром задней обратимой энцефалопатии |
|
Нарушения со стороны репродуктивной системы и молочной железы |
часто: гинекомастия |
|
Нарушение деятельности сердечно-сосудистой системы |
очень часто: «приливы», гипертония неизвестно*: удлинение интервала QT |
|
Нарушения со стороны желудочно-кишечного тракта |
неизвестно*: тошнота, рвота |
|
Нарушения со стороны кожи и подкожных тканей |
часто: сухость кожи, кожный зуд неизвестно*: сыпь |
|
Нарушения со стороны костно-мышечной системы и соединительной ткани |
часто: переломы** неизвестно*: миалгия, мышечный спазм, мышечная слабость, боль в спине |
|
Травмы, отравления и осложнения, вызванные проведением исследовательских процедур |
часто: падения |
* Сообщения, полученные в постмаркетинговый период
** Любые переломы, за исключением патологических
Судороги
В ходе клинических исследований III фазы судороги отмечались у 7 пациентов (0,4%) из 1671 пациента, которые ежедневно принимали
энзалутамид в дозе 160 мг, и у 1 пациента (<0,1%), получавшего плацебо. Доза представляется важным предиктором риска развития судорог, о чем свидетельствуют данные доклинических исследований и данные исследований с увеличением дозы. Из обоих исследованиях III фазы исключались пациенты с судорогами в анамнезе или факторами риска возникновения судорог.
В исследовании AFFIRM судороги наблюдались у шести из 800 пациентов (0,8%), которые принимали 160 мг энзалутамида в сутки после перенесенной химиотерапии, в то время как у пациентов, получавших плацебо, судорог не наблюдалось. Потенциально способствующие факторы, которые могли увеличить риск развития судорог, присутствовали у некоторых из этих пациентов. В исследовании PREVAIL судороги наблюдались у одного из 871 пациента (0,1%), не получавших химиотерапию, которые принимали 160 мг энзалутамида в сутки, и у одного пациента (0,1%), получавшего плацебо.
Механизм, посредством которого
энзалутамид может снижать судорожный порог, неизвестен. Однако он может быть связан с данными исследований in vitro, которые показали, что
энзалутамид и его активный метаболит связываются и могут ингибировать активность хлорных каналов ГАМК-рецепторов.
Передозировка :
Антидотов энзалутамида не существует. В случае передозировки лечение энзалутамидом следует прекратить и принять общие меры с учетом периода полувыведения 5,8 суток. После передозировки у пациентов может быть повышенный риск развития судорог.
Взаимодействие
Ингибиторы и индукторы CYP2C8
Фермент CYP2C8 играет важную роль в выведении энзалутамида и в формировании его активного метаболита. После перорального применения сильного ингибитора CYP2C8 гемфиброзила (600 мг дважды в день) у здоровых пациентов мужского пола AUC энзалутамида увеличилась на 326%, тогда как Сmах энзалутамида уменьшилась на 18%. На сумму несвязанного энзалутамида плюс несвязанный активный метаболит, AUC увеличилась на 77%, в то время как Сmax снизилась на 19%. Во время лечения энзалутамидом следует избегать приема сильных ингибиторов (например, гемфиброзил) или индукторов (например,
рифампицин) фермента CYP2C8, или применять их с осторожностью. Если пациентам необходимо совместно применять сильный ингибитор CYP2C8, дозу энзалутамида следует снизить до 80 мг один раз в день.
Ингибиторы и индукторы CYP3A4
Фермент CYP3A4 играет незначительную роль в метаболизме энзалутамида. После приема сильного ингибитора фермента CYP3A4 итраконазола (200 мг один раз в день) здоровыми добровольцами, AUC энзалутамида увеличилась на 41%, в то время как Сmах не изменилась. На сумму несвязанного энзалутамида плюс несвязанный активный метаболит, AUC увеличилась на 27%, тогда как Сmax снова осталась без изменений. При совместном применении Кстанди с ингибиторами или индукторами CYP3A4 коррекция дозы не требуется.
Индукция ферментов
Энзалутамид является мощным индуктором ферментов и повышает синтез многих ферментов и транспортеров, поэтому он взаимодействует со многими обычными лекарственными средствами, которые являются субстратами ферментов или транспортерами. Снижение концентрации в плазме может быть существенным и вести к потере или уменьшению клинического эффекта. Существует также риск образования активных метаболитов. К ферментам, образование которых может быть индуцировано, относятся CYP3A в печени и кишечнике, CYP2C9, CYP2C19, CYP1B6 и уридин-5′-дифосфат глюкуронозилтрансфераза. Также возможна индукция транспортного белка Р-гликопротеина и других транспортеров, а также, например, белка множественной лекарственной резистентности 2 (MRP2), белка резистентности рака молочной железы (BCRP) и органического анион-транспортирующего полипептида 1В1 (ОАТР1В1). Исследования in vivo показали, что
энзалутамид является сильным индуктором CYP3A4 и умеренным индуктором CYP2C9 и CYP2C19. Совместное применение энзалутамида (160 мг один раз в день) у больных раком предстательной железы привело к 86%-ному снижению AUC мидазолама (субстрат CYP3A4), 56%-ному снижению AUC S-варфарина (субстрат CYP2C9) и 70%-ному снижению AUC омепразола (субстрата CYP2C19). Также возможна индукция UGT1A1. В клиническом исследовании у пациентов с метастатическим КРРПЖ прием Кстанди (160 мг один раз в день) не имел клинически значимого эффекта на фармакокинетику доцетаксела, вводимого внутривенно (75 мг/м2 в/в каждые 3 недели). AUC доцетаксела снизилась на 12% [среднее геометрическое отношение (СТО) = 0,882 (90% ДИ: 0,767, 1,02)], тогда как Сmах снизилась на 4% [СТО = 0,963 (90% ДИ: 0,834, 1,11)].
Также препарат взаимодействует с определенными лекарственными средствами, которые выводятся в процессе метаболизма или активного транспорта. Если их терапевтический эффект имеет большое значение для пациента и коррекцию дозы на основе контроля эффективности или концентрации в плазме сделать не так просто, приема этих лекарственных средств следует избегать или применять их с осторожностью. Предполагается, что, риск повреждения печени после приема парацетамола выше у пациентов, которым одновременно вводили индукторы ферментов.
К группе лекарственных средств, которые могут взаимодействовать с препаратом, относятся, не ограничиваясь:
— Анальгетики (например, фентанил, трамадол)
— Антибиотики (например, кларитромицин, доксициклин)
— Противоопухолевые агенты (например, кабазитаксел)
— Антикоагулянты (например, аценокумарол, варфарин)
— Антиэпилептики (например, карбамазепин, клоназепам, фенитоин, примидон, вальпроевая кислота)
— Нейролептики (например, галоперидол)
— Бета-блокаторы (например, бисопролол, пропранолол)
— Блокаторы кальциевых каналов (например, дилтиазем, фелодипин, никардипин, нифедипин, верапамил)
— Сердечные гликозиды (например, дигоксин)
— Кортикостероиды (например, дексаметазон, преднизолон)
— Антивирусные препараты для лечения ВИЧ-инфекции (например, индинавир, ритонавир)
— Снотворные средства (например, диазепам, мидазолам, золпидем)
— Статины, метаболизируемые с участием фермента CYP3A4 (например, аторвастатин, симвастатин)
— Тиреоидные средства (например, левотироксин)
Все индукционные возможности энзалутамида могут проявиться приблизительно через 1 месяц после начала лечения, после достижения стабильной плазменной концентрации энзалутамида, хотя некоторые индукционные эффекты могут стать заметными и раньше. У пациентов, принимающих лекарственные препараты, которые являются субстратами ферментов CYP2B6, CYP3A4, CYP2C9, CYP2C19, or UGT1A1, следует оценивать возможное снижение фармакологического воздействия (или увеличение воздействия в случае образования активных метаболитов) в течение первого месяца лечения энзалутамидом и соответствующим образом корректировать дозу. Учитывая длительный период полувыведения энзалутамида (5,8 суток), влияние на образование ферментов может сохраняться в течение одного месяца и более после прекращения применения энзалутамида. При прекращении лечения энзалутамидом может потребоваться постепенное снижение дозы сопутствующих лекарственных средств.
Субстраты CYP2C8
Энзалутамид (160 мг один раз в день) не вызывает клинически значимых изменений в AUC или С max пиоглитазона (субстрат CYP2C8). AUC пиоглитазона увеличилась на 20%, в то время как Сmах снизилась на 18%. Если субстрат CYP2C8 применяют совместно с Кстанди, коррекция дозы не требуется.
Субстраты Р-гликопротеина
Данные in vitro показывают, что
энзалутамид может быть ингибитором эффлюксного транспортера Р-гликопротеина. Действие энзалутамида на субстраты Р-гликопротеина in vivo не оценивали, однако в условиях клинического применения
энзалутамид может быть индуктором Р-гликопротеина через активацию ядерного прегнан-рецептора (прегнан-Х-рецептор). Лекарственные препараты с узким терапевтическим диапазоном, являющиеся субстратами для Р-гликопротеина (например,
колхицин, дабигатран этексилат,
дигоксин), при одновременном применении с Кстанди следует применять с осторожностью, а для поддержания оптимальной концентрации в плазме может потребоваться коррекция дозы.
Субстраты белков резистентности рака молочной железы (BCRP), белков множественной лекарственной резистентности 2 (MRP2), транспортеры органических анионов человека 3 типа (ОАТ3) и транспортера органических катионов человека 1 (ОСТ1)
На основе данных лабораторных исследований, нельзя исключить ингибирования BCRP и MRP2 (в кишечнике), а также транспортеров органических анионов человека 3 типа (ОАТ3) и транспортеров органических катионов человека 1 (ОСТ1) (системного). Теоретически, индукция этих транспортеров также возможна, и суммарный эффект в настоящее время неизвестен.
Препараты, удлиняющие интервал QT
В связи с тем, что андрогендепривационная терапия может удлинять интервал QT, должно быть тщательно оценено одновременное применение Кстанди вместе с препаратами, удлиняющими интервал QT, а также препаратами, которые могут вызывать возникновение желудочковой тахикардии типа «пируэт», такими как антиаритмические препараты класса IA (например,
хинидин, дизопирамид) или класса III (например,
амиодарон,
соталол, дофетилид, ибутилид), метадон,
моксифлоксацин, нейролептики и др.
Влияние пищи на воздействие энзалутамида
Прием пищи не имеет клинически значимого влияния на степень воздействия энзалутамида. В клинических исследованиях Кстанди применяли независимо от приема пищи.
Особые указания :
Энзалутамид может иметь умеренное влияние на способность управлять автомобилем и работать с механизмами, так как были зарегистрированы психические и неврологические нарушения, включая судороги. Пациенты с судорогами или другими предрасполагающими факторами в анамнезе должны быть предупреждены о риске при вождении или эксплуатации механизмов. Исследований с целью определения воздействия применения энзалутамида на способность управлять автомобилем и работать с механизмами не проводилось.
Форма выпуска :
Капсулы, 40 мг.
Упаковка :
По 28 капсул в блистере из ПВХ/ПХТФЭ/алюминиевой фольги.
По 1 блистеру в картонный футляр.
По 4 картонных футляра (112 капсул) вместе с инструкцией по медицинскому применению в картонной пачке.
Условия хранения :
Хранить при температуре не выше 25°С.
Хранить в недоступном для детей месте.
Срок годности :
3 года.
Препарат не следует применять после срока годности, указанного на упаковке.
Условия отпуска из аптек :
По рецепту
Владелец регистрационного удостоверения :
Владелец Регистрационного удостоверения:Астеллас Фарма Юроп Б.В.
Производитель
ASTELLAS PHARMA EUROPE, B.V. Нидерланды
АСТЕЛЛАС ФАРМА ЮРОП Б.В.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Описание препарата Урсофальк (капсулы, 250 мг) основано на официальной инструкции, утверждено компанией-производителем в 2017 году
Дата согласования: 05.07.2017
Особые отметки:
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
- Отзывы
Фотографии упаковок

05.07.2017
Действующее вещество
ATX
Фармакологическая группа
Состав
| Капсулы | 1 капс. |
| активное вещество: | |
| урсодезоксихолевая кислота | 250 мг |
| вспомогательные вещества: крахмал кукурузный — 73 мг; кремния диоксид коллоидный — 5 мг; магния стеарат — 2 мг; титана диоксид — 1,94 мг; желатин — 80,51 мг; вода очищенная — 14,55 мг; натрия лаурилсульфат — 0,2 мг |
| Cуспензия для приема внутрь | 5 мл |
| активное вещество: | |
| урсодезоксихолевая кислота | 250 мг |
| вспомогательные вещества: кислота бензойная — 7,5 мг; вода очищенная — 2875,5 мг; ксилитол — 1600 мг; глицерол — 500 мг; МКЦ — 100 мг; пропиленгликоль — 50 мг; натрия цитрат — 25 мг; натрия цикламат — 25 мг; кислота лимонная безводная — 12,5 мг; натрия хлорид — 3 мг; ароматизатор лимонный (Givaudan PHL-134488) — 1,5 мг |
| Таблетки, покрытые пленочной оболочкой | 1 табл. |
| активное вещество: | |
| урсодезоксихолевая кислота | 500 мг |
| вспомогательные вещества: МКЦ — 23 мг; повидон К25 — 15 мг; кросповидон (тип А) — 12,5 мг; тальк — 8,5 мг; магния стеарат — 5 мг; кремния диоксид коллоидный — 4 мг; полисорбат 80 — 2 мг | |
| оболочка пленочная: гипромеллоза — 5,7 мг; тальк — 1,45 мг; макрогол 6000 — 0,85 мг |
Описание лекарственной формы
Капсулы
Твердые, непрозрачные желатиновые №0; крышечка и корпус белого цвета. Содержимое капсулы — порошок или гранулы белого цвета.
Суспензия для приема внутрь
Однородная, белого цвета, содержащая мелкие пузырьки воздуха, с ароматом лимона.
Таблетки, покрытые пленочной оболочкой
Двояковыпуклые, продолговатой формы, покрытые пленочной оболочкой белого цвета, с риской с обеих сторон.
Фармакологическое действие
Фармакологическое действие
—
гепатопротекторное.
Фармакодинамика
Гепатопротекторное средство, оказывает желчегонное действие. Уменьшает синтез Хс в печени, всасывание его в кишечнике и концентрацию в желчи, повышает растворимость Хс в желчевыводящей системе, стимулирует образование и выделение желчи. Снижает литогенность желчи, увеличивает содержание в ней желчных кислот; вызывает усиление желудочной и панкреатической секреции, усиливает активность липазы, оказывает гипогликемическое действие. Вызывает частичное или полное растворение Хс-камней при энтеральном применении, уменьшает насыщенность желчи Хс, что способствует мобилизации Хс из желчных камней. Оказывает иммуномодулирующее действие, влияет на иммунологические реакции в печени: уменьшает экспрессию некоторых антигенов на мембране гепатоцитов; влияет на количество Т-лимфоцитов, образование ИЛ-2, уменьшает количество эозинофилов.
Педиатрическая популяция
Муковисцидоз (кистозный фиброз). Согласно данным клинических отчетов, имеется многолетний опыт (до 10 лет и более) лечения УДХК педиатрических больных, страдающих гепатобилиарной болезнью, связанной с муковисцидозом (CFAHD). Имеются данные о том, что терапия УДХК способна снижать пролиферацию желчных протоков, замедлять развитие повреждений, выявляемых при гистологическом исследовании, и даже способствовать обратному развитию изменений гепатобилиарной системы в случае, если терапия начинается на ранних стадиях CFAHD. В целях оптимизации эффективности лечения терапию УДХК следует начинать как можно раньше после установления диагноза CFAHD.
Фармакокинетика
После приема внутрь УДХК быстро всасывается в тощей кишке и проксимальном отделе подвздошной кишки путем пассивной диффузии, а в дистальном отделе подвздошной кишки — за счет активного транспорта. Всасывается приблизительно 60–80% принятого объема. После всасывания УДХК почти полностью конъюгирует в печени с глицином и таурином и выводится с желчью. При первом прохождении через печень метаболизируется до 60%.
В зависимости от суточной дозы, типа заболевания и состояния печени, в желчи накапливается большее или меньшее количество УДХК. В то же время наблюдается относительное снижение содержания других, более липофильных желчных кислот.
Под действием кишечных бактерий УДХК частично распадается с образованием 7-кето-литохолевой и литохолевой кислоты. Литохолевая кислота гепатотоксична; у некоторых видов животных она вызывает повреждение паренхимы печени. В организме человека она всасывается лишь в небольших количествах. В процессе метаболизма происходит ее сульфатирование в печени, за счет чего она обезвреживается еще до того, как происходит ее экскреция в желчь, и выводится из организма с калом. Период полураспада УДХК составляет от 3,5 до 5,8 дней.
Показания
растворение холестериновых желчных камней в желчном пузыре;
билиарный рефлюкс-гастрит;
первичный билиарный цирроз печени при отсутствии признаков декомпенсации (симптоматическое лечение);
хронические гепатиты различного генеза;
первичный склерозирующий холангит;
кистозный фиброз (муковисцидоз) — в составе комплексной терапии;
неалкогольный стеатогепатит;
алкогольная болезнь печени;
дискинезия желчевыводящих путей.
Противопоказания
повышенная чувствительность к компонентам препарата;
рентгеноположительные (с высоким содержанием кальция) желчные камни;
нефункционирующий желчный пузырь;
острые воспалительные заболевания желчного пузыря, желчных протоков и кишечника;
цирроз печени в стадии декомпенсации;
выраженные нарушения функции почек, печени, поджелудочной железы.
Для суспензии для приема внутрь и таблеток, покрытых пленочной оболочкой, дополнительно
нарушение сократительной способности желчного пузыря;
закупорка желчных путей (закупорка общего желчного протока или пузырного протока);
частые эпизоды желчной колики;
выраженная печеночная и/или почечная недостаточность.
Педиатрическая популяция. Неудачно выполненная портоэнтеростомия или случаи отсутствия восстановления нормального тока желчи у детей с атрезией желчевыводящих путей.
Для капсул и таблеток, покрытых пленочной оболочкой, дополнительно
Детям в возрасте до 3 лет, а также пациентам с затруднениями при проглатывании таблеток, рекомендуется применять препарат Урсофальк в форме суспензии.
Для таблеток, покрытых пленочной оболочкой, дополнительно
детский возраст до 3 лет.
Применение при беременности и кормлении грудью
Препарат противопоказан в период беременности и лактации.
Данные об использовании УДХК у беременных женщин носят ограниченный характер или отсутствуют. Исследования на животных показали наличие репродуктивной токсичности на ранней стадии беременности. Во время беременности препарат Урсофальк использоваться не должен, за исключением случаев, когда это явно необходимо.
По данным исследований на животных, УДХК не оказывает влияние на фертильность. Данные о влиянии лечения УДХК на фертильность у человека отсутствуют.
Применение препарата у женщин, обладающих детородным потенциалом, возможно только если они используют надежные методы контрацепции. Рекомендуется использовать негормональные контрацептивы или пероральные контрацептивы с низким содержанием эстрогена. Однако пациентам, принимающим Урсофальк для растворения камней в желчном пузыре, следует использовать эффективные негормональные контрацептивы, т.к. гормональные пероральные контрацептивы могут повышать образование желчных камней. Наличие беременности должно быть исключено до начала лечения.
Согласно данным нескольких документально подтвержденных случаев, уровень УДХК в грудном молоке у женщин очень низок, и поэтому возникновение побочных реакций у детей при грудном вскармливании не ожидается.
Способ применения и дозы
Внутрь. Детям и взрослым с массой тела менее 47 кг, а также пациентам, которые не могут проглотить препарат Урсофальк в форме таблеток, покрытых пленочной оболочкой, рекомендуется применять Урсофальк в виде суспензии.
Растворение Хс-желчных камней. Рекомендуемая доза составляет 10 мг/кг/сут.
Капсулы
| Масса тела, кг | Количество капсул, шт. |
| до 60 | 2 |
| 61–80 | 3 |
| 81–100 | 4 |
| Свыше 100 | 5 |
Суспензия для приема внутрь
| Масса тела, кг | Количество мерных ложек | Соответствующее количество, мл |
| 5–7 | 0,25 | 1,25 |
| 8–12 | 0,5 | 2,5 |
| 13–18 | 0,75 | 3,75 |
| 19–25 | 1 | 5 |
| 26–35 | 1,5 | 7,5 |
| 36–50 | 2 | 10 |
| 51–65 | 2,5 | 12,5 |
| 66–80 | 3 | 15 |
| 81–100 | 4 | 20 |
| Свыше 100 | 5 | 25 |
Таблетки, покрытые пленочной оболочкой
| Масса тела, кг | Количество таблеток, покрытых пленочной оболочкой, шт |
| до 60 | 1 |
| 61–80 | 1,5 |
| 81–100 | 2 |
| более 100 | 2,5 |
Препарат необходимо принимать ежедневно вечером, перед сном (капсулы не разжевывают), запивая небольшим количеством жидкости.
Длительность лечения — 6–24 мес. Если после 12 мес лечения размер камней не уменьшается, то лечение следует прекратить. Для профилактики повторного холелитиаза рекомендован прием препарата в течение нескольких месяцев после растворения камней.
Эффективность лечения следует оценивать каждые 6 мес при УЗИ или рентгенографии. В ходе промежуточного обследования следует оценить, не произошло ли обызвествление камней за истекший период. В случае обызвествления камней, лечение следует прекратить.
Лечение билиарного рефлюкс-гастрита
1 капс./1 мерный стаканчик/0,5 табл. (250 мг) препарата Урсофальк ежедневно вечером, перед сном (капсулы не разжевывают), запивая небольшим количеством воды.
Курс лечения — от 10–14 дней до 6 мес, при необходимости — до 2 лет.
Лечение первичного билиарного цирроза
Суточная доза зависит от массы тела и составляет от 3 до 7 капс./от 2 до 7 мерных стаканчиков/от 1,5 до 3,5 табл. (примерно от (14±2) мг/кг УДХК).
В первые 3 мес лечения применение препарата Урсофальк (капсулы, таблетки, покрытые пленочной оболочкой) следует разделить на несколько приемов в течении дня. После улучшения печеночных показателей суточную дозу препарата можно принимать 1 раз вечером.
Рекомендуется следующий режим применения:
Капсулы
| Масса тела, кг | Суточная доза (капсулы, шт.) | Утром | Днем | Вечером |
| 47–62 | 3 | 1 | 1 | 1 |
| 63–78 | 4 | 1 | 1 | 2 |
| 79–93 | 5 | 1 | 2 | 2 |
| 94–109 | 6 | 2 | 2 | 2 |
| Свыше 110 | 7 | 2 | 2 | 3 |
Суспензия для приема внутрь
| Масса тела, кг | Мерные стаканчики Урсофальк, суспензия для приема внутрь 250 мг/5 мл |
|||
| первые 3 мес | в последующем | |||
| утро | день | вечер | вечер (однократный прием) | |
| 8–11 | — | 0,25 | 0,25 | 0,5 |
| 12–15 | 0,25 | 0,25 | 0,25 | 0,75 |
| 16–19 | 0,5 | — | 0,5 | 1 |
| 20–23 | 0,25 | 0,5 | 0,5 | 1,25 |
| 24–27 | 0,5 | 0,5 | 0,5 | 1,5 |
| 28–31 | 0,25 | 0,5 | 1 | 1,75 |
| 32–39 | 0,5 | 0,5 | 1 | 2 |
| 40–47 | 0,5 | 1 | 1 | 2,5 |
| 48–62 | 1 | 1 | 1 | 3 |
| 63–80 | 1 | 1 | 2 | 4 |
| 81–95 | 1 | 2 | 2 | 5 |
| 96–115 | 2 | 2 | 2 | 6 |
| Более 115 кг | 2 | 2 | 3 | 7 |
Таблетки, покрытые пленочной оболочкой
| Масса тела, кг | Суточная доза, мг/кг | Урсофальк, таблетки покрытые пленочной оболочкой, 500 мг | |||
| первые 3 мес | в последующем | ||||
| утро | полдень | вечер | вечер (однократный прием) | ||
| 47–62 | 12–16 | 0,5 | 0,5 | 0,5 | 1,5 |
| 63–78 | 13–16 | 0,5 | 0,5 | 1 | 2 |
| 79–93 | 13–16 | 0,5 | 1 | 1 | 2,5 |
| 94–109 | 14–16 | 1 | 1 | 1 | 3 |
| более 110 | — | 1 | 1 | 1,5 | 3,5 |
Капсулы следует принимать регулярно, не разжевывая, запивая небольшим количеством жидкости.
Применение Урсофалька для лечения первичного билиарного цирроза может быть продолжено в течение неограниченного времени.
У пациентов с первичным билиарным циррозом в редких случаях клинические симптомы могут ухудшиться в начале лечения, например может участиться зуд. В этом случае лечение следует продолжить, принимая по 1 капс./0,5 табл. ежедневно, далее следует постепенно повышать дозировку (увеличивая суточную дозу еженедельно на 1 капс./0,5 табл.) до тех пор, пока вновь не будет достигнут рекомендованный режим дозирования.
Симптоматическое лечение хронических гепатитов различного генеза. Суточная доза — 10–15 мг/кг в 2–3 приема. Длительность лечения — 6–12 мес и более.
Первичный склерозирующий холангит. Cуточная доза — 12–15 мг/кг; при необходимости доза может быть увеличена до 20–30 мг/кг в 2–3 приема. Длительность терапии составляет от 6 мес до нескольких лет (см. «Особые указания»).
Кистозный фиброз (муковисцидоз). Суточная доза 12–15 мг/кг; при необходимости доза может быть увеличена до 20–30 мг/кг в 2–3 приема. Длительность терапии составляет от 6 мес до нескольких лет.
Масса тела более 10 кг: дозировка УДХК — 20–25 мг/кг/сут. Мерное устройство — мерный стаканчик.
| Масса тела, кг | Суточная доза УДХК, мг/кг |
Количество мерных стаканчиков суспензии Урсофальк 250 мг/5 мл | |
| Утро | Вечер | ||
| 11–12 | 21–23 | 0,5 | 0,5 |
| 13–15 | 21–24 | 0,5 | 0,75 |
| 16–18 | 21–23 | 0,75 | 0,75 |
| 19–21 | 21–23 | 0,75 | 1 |
| 22–23 | 22–23 | 1 | 1 |
| 24–26 | 22–23 | 1 | 1,25 |
| 27–29 | 22–23 | 1,25 | 1,25 |
| 30–32 | 21–23 | 1,25 | 1,5 |
| 33–35 | 21–23 | 1,5 | 1,5 |
| 36–38 | 21–23 | 1,5 | 1,75 |
| 39–41 | 21–22 | 1,75 | 1,75 |
| 42–47 | 20–22 | 1,75 | 2 |
| 48–56 | 20–23 | 2,25 | 2,25 |
| 57–68 | 20–24 | 2,75 | 2,75 |
| 69–81 | 20–24 | 3,25 | 3,25 |
| 82–100 | 20–24 | 4 | 4 |
| >100 | 4,5 | 4,5 |
Таблица пересчета
| Количество мерных стаканчиков | Пероральная суспензия, мл | УДХК, мг |
| 1 | 5 | 250 |
| 0,75 | 3,75 | 187,5 |
| 0,5 | 2,5 | 125 |
| 0,25 | 1,25 | 62,5 |
Дети с массой тела до 10 кг заболевают очень редко. В этом случае следует использовать одноразовый шприц.
Разовые дозы для детей с массой тела до 10 кг следует отмерять с помощью шприца, поскольку предоставляемый мерный стаканчик не рассчитан на объемы менее 1,25 мл. Используйте одноразовый 2-миллилитровый шприц с градацией 0,1 мл. Следует обратить внимание на то, что одноразовые шприцы не входят в комплект упаковки с препаратом, но могут быть приобретены в аптеке.
Как отмерить требуемую дозу с помощью шприца:
1. Перед открытием флакона встряхнуть его.
2. Налить небольшое количество суспензии в мерный стаканчик, который входит в комплект упаковки с препаратом.
3. Набрать в шприц немного больший, чем требуется, объем препарата.
4. Постучать пальцами по шприцу, чтобы удалить пузырьки воздуха из набранной суспензии.
5. Убедиться в том, что в шприце находится требуемый объем суспензии; при необходимости набрать или спустить лишний объем.
6. Осторожно перелить содержимое шприца непосредственно в рот ребенка.
Не вставлять шприц во флакон. Не выливать неиспользованную суспензию из шприца или мерного стаканчика обратно во флакон.
Масса тела до 10 кг: дозировка УДХК — 20 мг/кг/сут. Мерное устройство — одноразовый шприц.
| Масса тела, кг | Доза суспензии Урсофалька 250 мг/5 мл, мл |
|
| Утро | Вечер | |
| 4 | 0,8 | 0,8 |
| 4,5 | 0,9 | 0,9 |
| 5 | 1 | 1 |
| 5,5 | 1,1 | 1,1 |
| 6 | 1,2 | 1,2 |
| 6,5 | 1,3 | 1,3 |
| 7 | 1,4 | 1,4 |
| 7,5 | 1,5 | 1,5 |
| 8 | 1,6 | 1,6 |
| 8,5 | 1,7 | 1,7 |
| 9 | 1,8 | 1,8 |
| 9,5 | 1,9 | 1,9 |
| 10 | 2 | 2 |
Таблетки, покрытые пленочной оболочкой
| Масса тела, кг | Суточная доза, мг/кг | Урсофальк, таблетки покрытые пленочной оболочкой, 500 мг | ||
| утро | полдень | вечер | ||
| 20–29 | 17–25 | 0,5 | — | 0,5 |
| 30–39 | 19–25 | 0,5 | 0,5 | 0,5 |
| 40–49 | 20–25 | 0,5 | 0,5 | 1 |
| 50–59 | 21–25 | 0,5 | 1 | 1 |
| 60–69 | 22–25 | 1 | 1 | 1 |
| 70–79 | 22–25 | 1 | 1 | 1,5 |
| 80–89 | 22–25 | 1 | 1,5 | 1,5 |
| 90–99 | 23–25 | 1,5 | 1,5 | 1,5 |
| 100–109 | 23–25 | 1,5 | 1,5 | 2 |
| >110 | 1,5 | 2 | 2 |
Неалкогольный стеатогепатит. Cредняя суточная доза — 10–15 мг/кг в 2–3 приема. Длительность терапии составляет от 6–12 мес и более.
Алкогольная болезнь печени. Средняя суточная доза — 10–15 мг/кг в 2–3 приема. Длительность терапии составляет 6–12 мес и более.
Дискинезия желчевыводящих путей. Средняя суточная доза 10 мг/кг в 2 приема в течение от 2 нед до 2 мес. При необходимости курс лечения рекомендуется повторить.
Побочные действия
Оценка нежелательных явлений основана на следующей классификации: очень часто (≥1/10); часто (≥1/100–<1/10); нечасто (≥1/1000–<1/100); редко (≥1/10000–<1/1000); очень редко (<1/10000).
Со стороны ЖКТ: часто — неоформленный стул или диарея; при лечении первичного билиарного цирроза очень редко — острые боли в правой верхней части живота.
Со стороны печени и желчевыводящих путей: очень редко — кальцинирование желчных камней. При лечении выраженных стадий первичного билиарного цирроза очень редко — декомпенсация цирроза печени, которая исчезает после отмены препарата.
Со стороны кожи и подкожных тканей: очень редко — крапивница.
Если любое из указанных в настоящем описании побочных эффектов усугубляется или пациент заметил другие побочные эффекты, не указанные в описании, следует сообщить об этом врачу.
Взаимодействие
Колестирамин, колестипол и антациды, содержащие алюминия гидроксид или смектит (алюминия оксид), снижают абсорбцию УДХК в кишечнике и таким образом уменьшают ее поглощение и эффективность. Если использование препаратов, содержащих хотя бы одно из этих веществ, все же является необходимым, их нужно принимать минимум за 2 ч до приема Урсофалька.
УДХК может усилить абсорбцию циклоспорина из кишечника. Поэтому у больных, принимающих циклоспорин, врач должен проверить концентрацию циклоспорина в крови и в случае необходимости скорректировать его дозу.
В отдельных случаях Урсофальк может снижать всасывание ципрофлоксацина.
В клиническом исследовании с участием здоровых добровольцев одновременное применение УДХК (500 мг/сут) и розувастатина (20 мг/сут) приводило к небольшому повышению уровня розувастатина в плазме крови. Клиническая значимость этого взаимодействия, в т.ч. в отношении других статинов, неизвестна.
Было показано, что у здоровых добровольцев УДХК снижает Cmax и AUC БКК — нитрендипина. В случае одновременного применения нитрендипина и УДХК рекомендуется тщательный мониторинг. Может потребоваться увеличение дозы нитрендипина.
Имеются также сообщения о взаимодействии с дапсоном, которое приводило к уменьшению терапевтического эффекта последнего. Эти наблюдения, наряду с данными экспериментов in vitro, дают основания полагать, что УДХК способна индуцировать изоферменты системы цитохрома P450 CYP3A. Однако в спланированном исследовании взаимодействия с будесонидом, который является известным субстратом цитохрома Р450 CYP3A, индукция отмечена не была.
Эстрогенные гормоны и препараты, снижающие уровень Хс в крови, такие как клофибрат, увеличивают секрецию Хс в печени и, следовательно, могут стимулировать образование желчных камней, что нивелирует эффект УДХК, которая используется для растворения камней в желчном пузыре.
Передозировка
Симптомы: диарея. Как правило, другие симптомы передозировки маловероятны, поскольку с увеличением дозы поглощение УДХК уменьшается и, соответственно, большее ее количество выделяется с фекалиями.
Лечение: симптоматическое, направленное на восполнение объема жидкости и восстановление электролитного баланса. Необходимости в применении специфических мер при передозировке нет.
Особые указания
Прием препарата Урсофальк должен осуществляться под наблюдением врача.
В течение первых 3 мес лечения следует контролировать функциональные пробы печени (уровень трансаминаз, ГГТП и ЩФ в сыворотке крови) каждые 4 нед, а затем каждые 3 мес. Контроль указанных параметров позволяет выявить нарушения функции печени на ранних стадиях. Также это касается пациентов на поздних стадиях первичного билиарного цирроза. Кроме того, так можно быстро определить, реагирует ли пациент с первичным билиарным циррозом на проводимое лечение.
При применении препарата для растворения холестериновых желчных камней
Для того чтобы оценить прогресс в лечении и в целях своевременного выявления признаков кальциноза камней в зависимости от их размера, желчный пузырь следует визуализировать (пероральная холецистография) с осмотром затемнений в положении стоя и лежа на спине (УЗИ) через 6–10 мес после начала лечения.
Если желчный пузырь невозможно визуализировать на рентгеновских снимках или в случаях кальциноза камней, слабой сократимости желчного пузыря или частых приступов колик, препарат Урсофальк применять не следует.
При лечении пациентов на поздних стадиях первичного билиарного цирроза
Крайне редко отмечались случаи декомпенсации цирроза печени. После прекращения терапии отмечалось частичное обратное развитие проявлений декомпенсации.
У пациентов с первичным билиарным циррозом в редких случаях в начале лечения возможно усиление клинических симптомов, например может усилиться зуд. В этом случае дозу препарата необходимо снизить, а затем постепенно вновь увеличивать (см. «Способ применения и дозы»).
При применении у пациентов с первичным склерозирующим холангитом
Длительная терапия высокими дозами УДХК (28–30 мг/кг/сут) у пациентов с данной патологией может вызвать серьезные побочные явления.
У пациентов с диареей следует уменьшить дозировку препарата. При персистирующей диарее следует прекратить лечение.
Женщины детородного возраста могут принимать препарат, только если они используют надежные средства контрацепции. Рекомендуется использовать негормональные противозачаточные средства либо пероральные контрацептивы с низким содержанием эстрогенов, поскольку гормональные пероральные контрацептивы могут усиливать камнеобразование в желчном пузыре. До начала лечения следует исключить возможную беременность.
Один мерный стаканчик (эквивалентно 5 мл) суспензии Урсофальк для приема внутрь 250 мг/5 мл содержит 0,5 ммоль (11,39 мг) натрия. Пациентам, контролирующим потребление натрия, следует учитывать этот факт.
Влияние на способность управлять транспортными средствами и движущимися механизмами. УДХК не оказывает влияние на способность управлять транспортными средствами и механизмами или же это влияние минимальное.
Форма выпуска
Капсулы, 250 мг. По 10 капс. в блистере алюминий/ПВХ, по 1 бл. в пачке картонной.
По 25 капс. в блистере алюминий /ПВХ, по 2 или 4 бл. в пачке картонной.
Суспензия для приема внутрь, 250 мг/5 мл. По 250 мл во флаконе темного стекла с завинчивающейся крышкой с контролем первого вскрытия; по 1 фл. вместе с мерным стаканчиком помещают в пачку картонную.
Таблетки, покрытые пленочной оболочкой, 500 мг. По 25 табл. в контурной ячейковой упаковке из пленки ПВХ/ПВДХ/фольги алюминиевой (блистер). По 2 или 4 бл. в картонной пачке.
Производитель
Владелец регистрационного удостоверения/выпускающий контроль качества: Др. Фальк Фарма ГмбХ, Ляйненвеберштр. 5, 79108, Фрайбург, Германия.
Тел.: 49076115140; факс: 4907611514356.
Организация, уполномоченная владельцем регистрационного удостоверения на принятие претензий от потребителей: представительство компании Доктор Фальк Фарма ГмбХ. 127055, Москва, ул. Бутырский вал, 68/70, стр. 4, 5.
Тел./факс: (495) 933-99-04.
Условия отпуска из аптек
По рецепту.
Условия хранения
При температуре не выше 25 °C.
Хранить в недоступном для детей месте.
Срок годности
капсулы 250 мг блистер —
5 лет.
таблетки, покрытые пленочной оболочкой 500 мг упаковка контурная ячейковая;
суспензия для приема внутрь 250 мг/5 мл флакон темного стекла —
4 года.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Одна таблетка содержит: действующего вещества – албендазола – 400 мг; вспомогательные вещества – целлюлоза микрокристаллическая, крахмал кукурузный, кроскармеллоза натрия, кросповидон, повидон К 30, натрия лаурилсульфат, магния стеарат, Опадрай II (в т.ч. макрогол 4000, лактозы моногидрат, гипромеллоза, титана диоксид Е 171).
Таблетки покрытые пленочной оболочкой белого цвета, с двояковыпуклой поверхностью, круглые.
Антигельминтное средство.
Код АТХ: Р02СA03.
Фармакодинамика
Албендазол является производным бензимидазола с противогельинтной и антипротозойной активностью в отношении кишечных и тканевых паразитов. Албендазол оказывает ларвицидное, овоцидное и противогельминтное действие, предположительно, за счет ингибирования полимеризации тубулина. Это вызывает нарушение метаболизма гельминтов, в том числе, энергетическое истощение (подавление поглощения глюкозы), что приводит к обездвиживанию, а затем уничтожению восприимчивых гельминтов.
Фармакокинетика
После приема внутрь албендазол плохо абсорбируется из желудочно-кишечного тракта (ЖКТ) – менее 5 %, в неизмененном виде не определяется в плазме, биодоступность – низкая. Системное фармакологическое действие усиливается при приеме лекарственного средства с жирной пищей, при этом повышается абсорбция и увеличивается Сmax в плазме крови в 5 раз. Время достижения Сmax албендазола сульфоксида составляет 2‒5 ч. Связывание с белками плазмы – 70 %. Албендазол обнаруживается в желчи, печени, стенке кисты и кистозной жидкости, цереброспинальной жидкости.
Албендазол быстро претерпевает эффект первого прохождения печени, и, как правило, не обнаруживается в крови. Основным метаболитом, обладающим антигельминтной активностью и обеспечивающим эффективность при системных тканевых инфекциях, является албендазола сульфоксид.
После приема лекарственного средства в разовой дозе 400 мг фармакологически активный метаболит, албендазола сульфоксид, достигает плазменных концентраций от 1,6 до 6,0 мкмоль/л. T1/2 албендазола сульфоксида составляет 8,5 ч. Выводится с желчью через кишечник в виде албендазола сульфоксида и лишь незначительная часть его количества выводится с мочой. Выведение из кист наблюдалось в течение нескольких недель после длительного приема высоких доз. При внепеченочном холестазе печеночный клиренс значительно снижается, что приводит к увеличению AUC и повышению содержания в плазме албендазола сульфоксида.
Особые категории пациентов
Дети: фармакокинетика албендазола сульфоксида при приеме одно-кратных доз 200–300 мг (приблизительно 10 мг/кг) албендазола сопоставима с фармакокинетикой, наблюдавшейся у взрослых после приема пищи. Клинический опыт применения у детей младше 6 лет ограничен.
Пациенты пожилого возраста: фармакокинетика албендазола сульфоксида сопоставима с фармакокинетикой у здоровых молодых пациентов.
Пациенты с нарушением функции почек: фармакокинетика албендазола при применении у пациентов с нарушением функции почек не была исследована.
Пациенты с нарушением функции печени: фармакокинетика албендазола при применении у пациентов с нарушением функции печени не была исследована.
Кишечные инфекции и ларвальный (личиночный) гельминтоз (в том числе, смешанные глистные инвазии)
– Нематодозы: аскаридоз, энтеробиоз, трихоцефалез, анкилостомоз, некатороз, стронгилоидоз.
– Трематодозы: описторхоз и клонорхоз.
– Лямблиоз у детей 2–12 лет.
– Цестодозы: тениоз (Taenia solium, Taenia saginata), гименолепидоз.
Системные гельминтозы
– Эхинококкоз. Албендазол демонстрирует наибольшую эффективность при лечении кист печени, легких и брюшины. Опыт применения при кистах костей, сердца и центральной нервной системы ограничен.
– Кистозный эхинококкоз (вызванный Echinococcus granulosus). Албендазол применяется для лечения пациентов с кистозным эхинококкозом:
1. если хирургическое вмешательство неприемлемо.
2. перед хирургическим вмешательством.
3. после хирургического вмешательства в случае, если предоперационное лечение было слишком кратковременным, или произошла утечка содержимого кисты, или во время хирургического вмешательства был выявлен жизнеспособный материал.
4. после чрескожного дренирования кист в диагностических или терапевтических целях.
– Альвеолярный эхинококкоз (вызванный Echinococcus multilocularis). Албендазол применяется для лечения пациентов:
1. при неоперабельном заболевании, особенно в случаях локальных или отдаленных метастазов.
2. после паллиативного хирургического вмешательства.
3. после радикального хирургического вмешательства или трансплантации печени.
– Нейроцистицеркоз. Албендазол применяется для лечения пациентов со следующими состояниями:
1. одиночные или множественные кисты или гранулематозные поражения паренхимы головного мозга.
2. арахноидальные или внутрижелудочковые кисты.
3. гроздевидные кисты.
Лекарственное средство принимают внутрь во время приема пищи. Предпочтителен прием в одно и то же время суток. Если через 3 недели не наступает выздоровление, то следует назначить второй курс лечения.
Для пациентов, которые не в состоянии проглотить таблетку целиком, рекомендуется ее размельчить и запить небольшим количеством воды.
|
Инфекция |
Возраст |
Продолжительность приема |
|
Энтеробиоз, анкилостомидоз,
некатороз, |
Взрослые и дети старше 2 лет (›10 кг) |
400 мг 1 раз в сутки однократно |
|
Дети от 1 до 2 лет (›10 кг) |
200 мг 1 раз в сутки однократно |
|
|
Стронгилоидоз, тениоз, гименолепидоз |
Взрослые и дети старше 2 лет (›10 кг) |
400 мг 1 раз в сутки в течение 3 дней. |
|
Клонорхоз, описторхоз |
Взрослые и дети старше 2 лет (›10 кг) |
400 мг 2 раза в сутки в течение 3 дней |
|
Кожный синдром Larva Migrans |
Взрослые и дети старше 2 лет (›10 кг) |
400 мг 1 раз в сутки. Продолжительность приема от 1 дня до 3 дней |
|
Лямблиоз |
Только дети от 2 (›10 кг) до 12 лет |
400 мг 1 раз в сутки в течение 5 дней |
Особые категории пациентов
Дети. У детей младше 4 лет, или испытывающих трудности с глотанием рекомендуется применять лекарственное средство в форме суспензии.
Пациенты пожилого возраста. Опыт применения у пациентов в возрасте 65 лет или старше ограничен. Согласно данным отчетов, коррекция дозы не требуется, однако албендазол следует с осторожностью применять у пациентов с признаками нарушения функции печени (см. раздел «Пациенты с нарушением функции печени»).
Пациенты с нарушением функции почек. Поскольку выведение почками албендазола и его основного метаболита албендазола сульфоксида незначительно, вероятность изменения клиренса этих соединений у таких пациентов является низкой. Пациентам с нарушением функции почек коррекция дозы не требуется, однако за такими пациентами следует проводить тщательное наблюдение.
Пациенты с нарушением функции печени. Поскольку албендазол быстро метаболизируется в печени с образованием основного фармакологически активного метаболита албендазола сульфоксида, при нарушении функции печени можно ожидать существенного влияния на фармакокинетику албендазола сульфоксида. За пациентами с отклонением функциональных проб печени (трансаминаз) следует проводить тщательное наблюдение перед началом терапии албендазолом.
Системные гельминтные инфекции (продолжительное лечение более высокими дозами).
Имеется ограниченный опыт использования албендазола у детей в возрасте до шести лет, поэтому не рекомендуется применять албендазол в данном возрастном периоде. Рекомендуемая доза для детей старше 6 лет – 12 мг/кг/сут в разделенных дозах.
Для пациентов с массой тела более 60 кг доза лекарственного средства составляет 400 мг 2 раза в сутки. Для пациентов с массой тела менее 60 кг лекарственное средство назначают из расчета 15 мг/кг/сут в 2 приема. Максимальная суточная доза составляет 800 мг. Рекомендуется проводить одновременное лечение всех членов семьи.
|
Инфекция |
Продолжительность приема |
|
Кистозный эхинококкоз |
28 дней. При неоперабельной форме рекомендуется три 28-дневных цикла лечения, разделенных 14-дневным перерывом в приеме лекарственного средства. Перед операцией рекомендовано два 28-дневных цикла, разделенных 14-дневным перерывом в приеме лекарственного средства. Если предоперационный курс меньше 14 дней или найдены жизнеспособные кисты, то после операции проводят два цикла по 28 дней, разделенных 14-дневным перерывом в приеме лекарственного средства. |
|
Альвеолярный эхинококкоз |
28 дней. Второй 28-дневный курс повторяют после двухнедельного перерыва в приеме лекарственного средства. Лечение может быть продолжено в течение нескольких месяцев или лет. |
|
Нейроцистицеркоз |
Продолжительность приема 7–31 день. Второй курс можно повторить после двухнедельного перерыва в приеме лекарственного средства. |
Особые категории пациентов
Особенности дозирования у пожилых пациентов и пациентов с нарушением функции почек – см. кишечные инфекции и кожный синдром Larva migrans.
Побочное действие
Нежелательные реакции, представленные ниже, перечислены в соответствии с поражением органов и систем органов и частотой встречаемости. Частота встречаемости определяется следующим образом: очень часто (≥ 1/10), часто (≥ 1/100 и ˂ 1/10), нечасто (≥ 1/1000 и ˂ 1/100), редко (≥ 1/10000 и ˂ 1/1000), очень редко (˂ 1/10000, включая отдельные случаи). Категории частоты были сформированы на основании пострегистра-ционного наблюдения.
Частота встречаемости нежелательных реакций
Применение при кишечных инфекциях и ларвальном (личиночном) гельминтозе (кожная форма) (меньшая длительность с применением меньшей дозы)
Нарушения со стороны иммунной системы: редко: реакции повышенной чувствительности, включая сыпь, зуд и крапивницу.
Нарушения со стороны нервной системы: нечасто: головная боль и головокружение.
Нарушения со стороны желудочно-кишечного тракта: нечасто: симптомы со стороны верхних отделов желудочно-кишечного тракта (например, боль в эпигастрии или животе, тошнота, рвота) и диарея.
Нарушения со стороны печени и желчевыводящих путей: редко: повышение уровня ферментов печени.
Нарушения со стороны кожи и подкожных тканей: очень редко: многоформная эритема, синдром Стивенса-Джонсона.
Применение при системных гельминтозах (более длительное лечение с применением высоких доз)
Нарушение со стороны крови и лимфатической системы: нечасто: лейкопения; очень редко: панцитопения, апластическая анемия, агранулоцитоз.
У пациентов с заболеваниями печени, такими как, эхинококкоз печени, чаще наблюдается угнетение костного мозга (см. разделы «Способ применения и дозы», «Меры предосторожности»).
Нарушения со стороны иммунной системы: нечасто: реакции повышенной чувствительности, включая сыпь, зуд и крапивницу.
Нарушения со стороны нервной системы: очень часто: головная боль; часто: головокружение.
Нарушения со стороны желудочно-кишечного тракта: часто: желудочно-кишечные расстройства (боль в животе, тошнота, рвота).
При лечении пациентов с эхинококкозом наблюдались нарушения со стороны желудочно-кишечного тракта, связанные с албендазолом.
Нарушения со стороны печени и желчевыводящих путей: очень часто: небольшое или умеренное увеличение уровня ферментов печени, гепатит.
Нарушения со стороны кожи и подкожных тканей: часто: обратимая алопеция (истончение волос и умеренное выпадение волос); очень редко: многоформная эритема, синдром Стивенса-Джонсона.
Общие расстройства и нарушения в месте введения: часто: лихорадка.
— повышенная чувствительность к албендазолу или любому другому компоненту, входящему в состав лекарственного средства;
— албендазол не следует применять во время беременности или у женщин с предполагаемой беременностью.
Для женщин детородного возраста сначала необходимо исключить беременность (см. также «Применение в период беременности и кормления грудью»).
Сообщение о предполагаемых побочных реакциях
Медицинским работникам рекомендуется направлять информацию о любых подозреваемых нежелательных реакциях и неэффективности лекарственного средства по адресу: Республиканское унитарное предприятие «Центр экспертиз испытаний в здравоохранении», www.rceth.by.
Возможно слабое или умеренное повышение активности печеночных ферментов при продолжительном приеме лекарственного средства, которое нормализируется после прекращения приема. Определение показателей функции печени следует проводить перед началом каждого цикла лечения и каждые 2 нед в течение лечения. Если активность печеночных трансаминаз увеличивается в 2 раза и более, албендазол следует отменить. Лечение повторяют, когда показатели функции печени возвратятся к норме.
Албендазол может вызывать угнетение костного мозга, поэтому следует проводить анализы крови пациента как в начале лечения, так и каждые 2 нед в течение 28-дневного цикла лечения. Пациенты с заболеванием печени, включая печеночный эхинококкоз, более склонны к угнетению костного мозга, в результате чего возникает панцитопения, апластическая анемия, агранулоцитоз и лейкопения, что обусловливает необходимость тщательного контроля показателей крови. В случае возникновения значительного снижения показателей крови лечение следует прекратить.
Лечение албендазолом может обнаружить наличие уже существующего нейроцистицеркоза, особенно на территориях с высоким уровнем инфицирования штаммами Taenia solium. У пациентов могут возникать неврологические симптомы, например, судороги, повышение внутричерепного давления и фокальные симптомы вследствие воспалительной реакции, вы-званной гибелью паразитов в мозгу. Симптомы могут возникнуть сразу после лечения, поэтому следует немедленно начать соответствующую терапию кортикостероидами и противосудорожными лекарственными средствами.
Цистицеркоз может, в редких случаях, затрагивать сетчатку глаза. Если такие повреждения визуализируются, необходимость в проведении терапии цистицеркоза следует сопоставлять с возможностью повреждения сетчатки, вызванного албендазол-индуцированными изменениями в сетчатке.
Для предотвращения возникновения случаев повышения церебрального давления в течение первой недели лечения рекомендуется применять пероральные или внутривенные кортикостероиды.
Лечение лекарственным средством не требует применения клизм, слабительных средств или специальной диеты.
Албендазол содержит лактозу. Пациенты с редкими наследственными нарушениями, такими как, непереносимость галактозы, лактазная недостаточность Лаппа и нарушение всасывания глюкозы-галактозы, не должны принимать это лекарственное средство.
Лекарственное средство противопоказано во время беременности. Во избежание приема албендазола в течение ранней беременности, женщины детородного возраста должны проводить лечение после получения отрицательного теста на беременность; этот тест следует повторить, по крайней мере, один раз перед началом следующего цикла. Следует принимать меры контрацепции во время и в течение одного месяца после окончания лечения при системной инфекции. Неизвестно, секретируется ли у человека албендазол или его метаболиты в грудное молоко. Поэтому не следует использовать албендазол в период грудного вскармливания, за исключением случаев, когда предполагается, что потенциальная польза превышает возможные риски, связанные с лечением.
C осторожностью применяется у детей.
Учитывая возможность развития головокружений, необходимо при вождении транспортных средств и обслуживании механического оборудования в движении соблюдать осторожность.
Установлено, что албендазол индуцирует печеночные ферменты системы цитохрома Р450, ответственной за его метаболизм.
Лекарственные средства, которые могут уменьшить эффективность албендазола, и при использовании которых требуется мониторинг эффектов, поскольку может возникнуть необходимость применения других режимов дозирования или терапии:
– противосудорожные (например, фенитоин: фосфенитон, карбамазепин, фенобарбитал, примидон);
– левамизол;
– ритонавир.
Лекарственные средства, которые могут увеличивать уровни активных метаболитов албендазола, и при использовании которых необходимо проводить мониторинг за возможным увеличением побочных эффектов албендазола:
– циметидин;
– дексаметазон (непрерывное использование повышает уровни метаболитов албендазола на 50 %);
– празиквантел.
Грейпфрутовый сок также увеличивает уровень албендазола сульфоксида в плазме.
Другие возможные взаимодействия
В связи с возможным изменением активности цитохрома Р450 существует теоретический риск взаимодействия со следующими лекарственными средствами:
– пероральными противозачаточными средствами;
– антикоагулянтами;
– гипогликемическими средствами для приема внутрь;
– теофиллином.
Необходимо соблюдать осторожность при применении Албендазола пациентами, принимающими вышеуказанные лекарственные средства.
Симптомы передозировки не описаны.
Лечение: промывание желудка, симптоматическое лечение и общие поддерживающие меры.
По 2 или 10 таблеток в контурной ячейковой упаковке из пленки поливинилхлоридной и фольги алюминиевой.
1 контурную ячейковую упаковку по 10 таблеток вместе с листком-вкладышем помещают в пачку из картона (№10х1).
1, 2 или 3 контурные ячейковые упаковки по 2 таблетки вместе с листком-вкладышем помещают в пачку из картона (№2х1, №2х2, №2х3).
В защищенном от света и влаги месте, при температуре не выше 25 °С. Хранить в недоступном для детей месте.
2 года. Лекарственное средство не использовать после окончания срока годности.
Информация о производителе
Открытое акционерное общество «Борисовский завод медицинских препаратов», Республика Беларусь, Минская обл., г. Борисов, ул. Чапаева, 64, тел/факс. +375(177) 735612, 731156.
Нервная система. Анальгетики. Другие анальгетики и антипиретики. Анилиды. Парацетамол, комбинации исключая психолептики.
Код АТХ N02BE51
Тайлолфен Хот показан для облегчения симптомов гриппа, ОРВИ и простуд, включающих в себя:
— повышенная температура тела
— лихорадка, озноб
— головная боль
— боль в горле
— заложенность носа
— синусит и связанные с ним боли
— острый ринит (носовой катар)
— гиперчувствительность к компонентам препарата
— тяжелые нарушения функции печени и почек
— острый инфаркт миокарда, артериальная гипертензия, в том числе осложненная ангиопатия сетчатки, выраженный атеросклероз аорты и сосудов головного мозга
— сахарный диабет
— бронхиальная астма
— закрытоугольная глаукома
— гипертиреоз
— одновременный прием ингибиторов моноаминооксидазы
— дефицит фермента глюкозо-6-фосфатдегидрогеназы (признаки такого заболевания крови, как анемия)
— задержка мочи, связанная с нарушением функции предстательной железы
— синдром Жильбера (вторичная колеблющаяся доброкачественная желтуха в результате дефицита глюкуронил-трансферазы)
При назначении парацетамола пациентам с почечной или печеночной недостаточностью рекомендуется соблюдать осторожность. Риск передозировки выше у лиц с нецирротической алкогольной болезнью печени.
Необходимо проконсультироваться с врачом, прежде чем принимать этот препарат у пациентов с этими симптомами:
— Увеличение предстательной железы
— Заболевание сосудистой системы (например, феномен Рейно).
Этот препарат не должен использоваться пациентами, принимающими другие симпатомиметики (такие как противоотечные средства, средства для подавления аппетита и амфетаминоподобные психостимуляторы).
Пациентам не следует принимать другие парацетамол содержащие, противопростудные или противоотечные препараты одновременно.
Если симптомы не проходят, обратитесь к врачу.
В случае передозировки следует немедленно обратиться к врачу, даже если вы чувствуете себя хорошо из-за риска позднего серьезного повреждения печени.
Хлорфенамин, как и другие препараты, обладающие антихолинергическим эффектом, следует применять с осторожностью при эпилепсии, повышенном внутриглазном давлении, включая глаукому, гипертрофию предстательной железы, тяжелой гипертонии или сердечно-сосудистых заболеваниях, бронхите, бронхоэктазии или астме, печеночной, почечной недостаточности. Дети и пожилые люди чаще испытывают неврологические антихолинергические эффекты и парадоксальное возбуждение (например, прилив энергии, беспокойство, нервозность).
Воздействие алкоголя может быть усилено, и поэтому следует избегать одновременного использования.
Не следует использовать с другими антигистаминсодержащими препаратами, включая антигистаминсодержащие препараты от кашля и простуды.
Натрий
Этот лекарственный препарат содержит 450 мг бикарбоната натрия, 45 мг безводного карбоната натрия и 10 мг бензоата натрия на дозу (общее количество натрия: 144,336 мг). Для учета пациентами на контролируемой натриевой диете.
Сахароза
Пациенты с редкими наследственными проблемами непереносимости фруктозы, мальабсорбции глюкозы-галактозы или недостаточности сахарозы-изомальтазы не должны принимать это лекарство.
Скорость абсорбции парацетамола может быть увеличена метоклопрамидом или домперидоном, а абсорбция колестирамином снижена. Антикоагулянтный эффект варфарина и других кумаринов может быть усилен при длительном регулярном ежедневном применении парацетамола с повышенным риском кровотечений, случайные дозы не оказывают существенного эффекта.
Фенилэфрин следует использовать с осторожностью в сочетании со следующими препаратами, поскольку было сообщено о взаимодействиях
| Ингибиторы моноаминоксидазы (включая моклобемид) | Гипертонические взаимодействия возникают между симпатомиметическими аминами, такими как ингибиторы фенилэфрина и моноаминоксидазы (см. Противопоказания). |
| Симпатомиметические амины | Одновременный прием фенилэфрина с другими симпатомиметическими аминами может увеличить риск сердечно-сосудистых побочных эффектов. |
| Бета-блокаторы и другие гипотензивные средства (в том числе дебрисохин, гуанетидин, резерпин, метилдопа) | Фенилэфрин может снизить эффективность бета-блокирующих и гипотензивных препаратов. Риск гипертонии и других сердечно-сосудистых побочных эффектов может быть увеличен. |
| Трициклические антидепрессанты (например, амитриптилин) | Может увеличить риск сердечно-сосудистых побочных эффектов с фенилэфрином. |
| Алкалоиды спорыньи | (эрготамин и метилсергид) повышенный риск эрготизма |
| Дигоксин и сердечные гликозиды | Увеличьте риск нерегулярного сердцебиения или сердечного приступа |
Одновременное использование хлорфенамина со снотворными или анксиолитиками может вызвать усиление седативного эффекта, поэтому следует проконсультироваться с врачом, прежде чем принимать хлорфенамин одновременно с этими препаратами.
Хлорфенамин ингибирует метаболизм фенитоина и может привести к токсичности фенитоина.
Антихолинергические эффекты хлорфенамина усиливаются с помощью ингибиторов МАО. Перед применением Тайлолфен Хот пациенты должны быть проинформированы о том, что после применения ингибиторов МАО должно пройти не менее 2-х недель.
Беременность
Большой объем данных о беременных женщинах свидетельствует, об отсутствии у парацетамола фето и/или неонатальной токсичности, а также способности вызывать пороки развития. Эпидемиологические исследования развития нервной системы у детей, подвергшихся внутриутробному воздействию парацетамола, показали неубедительные результаты. Допускается прием парацетамола во время беременности, исходя из клинической необходимости, однако его следует принимать в минимальной эффективной дозе, на минимально возможные короткие сроки и с наименьшей возможной частотой.
Адекватных данных по применению малеата хлорфенамина у беременных женщин нет. Потенциальный риск для человека неизвестен. Использование в третьем триместре может привести к реакциям у новорожденных или недоношенных новорожденных. Не следует использовать во время беременности, если это не рассматривается врачом.
Кормление грудью
Фенилэфрин может выводиться с грудным молоком.
Малеат хлорфенамина и другие антигистаминные препараты могут подавлять лактацию и могут выделяться с грудным молоком.
Не использовать во время кормления грудью, если врач не считает это необходимым.
Так как антихолинергические свойства хлорфенамина могут вызывать сонливость, головокружение, помутнение зрения и психомоторные нарушения у некоторых пациентов, необходимо соблюдать осторожность при вождении автомобиля и при управлении другими потенциально опасными механизмами.
Режим дозирования
Взрослым и детям старше 12 лет назначают по 1 пакетику (500 мг) каждые 6 ч, но не более 4 пакетиков (2 г) в сутки. Максимальная рекомендуемая суточная доза 4 пакетика (2 г) в сутки. Перед приемом содержимое 1 пакетика растворяют в стакане горячей воды.
При отсутствии выраженного терапевтического эффекта, высокой температуре, которая держится более 3 дней, а также при появлении новых симптомов следует срочно обратиться к врачу.
У пациентов, употребляющих алкоголь, из-за риска гепатотоксичности, общая суточная доза парацетамола не должна превышать 2 грамма.
Не принимайте непрерывно более 7 дней без консультации врача.
Метод и путь введения
Следует принимать внутрь, по нижеуказанной схеме.
Ингредиент каждого пакета следует растворить в 160 мл горячей воды (примерно одна чашка стандартного размера) и немедленно выпить. Необходимо придерживаться периода 6 часов между приемами препарата. Рекомендуемая максимальная суточная доза — 4 пакетика.

Парацетамол
Поражение печени у взрослых возможно при приеме 10 г и более парацетамола. Прием 5 г и более парацетамола может привести к поражению печени у пациентов, имеющих следующие факторы риска:
Если пациент:
а) находится на длительном лечении карбамазепином, фенобарбитоном, фенитоином, примидоном, рифампицином, препаратами зверобоя продырявленного или другими препаратами, которые вызывают индукцию ферментов печени;
б) регулярно злоупотребляет алкоголем;
c) имеет заболевания, при которых вероятно имеется истощение глутатиона, например, при расстройстве пищевого поведения, муковисцидозе, ВИЧ-инфекции, голодании, кахексии.
Симптомами острого отравления парацетамолом в течение первых 24-х часов после передозировки могут быть: тошнота, рвота, боли в животе, нарушение метаболизма глюкозы (потливость, головокружение, потеря сознания), бледность кожных покровов, снижение аппетита, нарушение углеводного обмена.
Передозировка парацетамола при однократном введении у взрослых или у детей может вызвать некроз клеток печени, который может вызвать полный и необратимый некроз, приводящий к гепатоцеллюлярной недостаточности, нарушениям метаболизма глюкозы, метаболическому ацидозу и энцефалопатии (нарушение функции мозга), кровотечениям, гипогликемии, отеку мозга, что может привести к коме и летальному исходу.
Поражение печени определяется через 12-48 часов после передозировки. Одновременно наблюдаются повышенные уровни печеночных трансаминаз (АСТ, АЛТ), лактатдегидрогеназы и билирубина, а также повышенные уровни протромбина.
При длительном применении с превышением рекомендованной дозы может наблюдаться гепатотоксическое и нефротоксическое действие (почечная колика, неспецифическая бактериурия, интерстициальный нефрит, папиллярный некроз).
Лечение:
при превышении необходимой дозы нужна незамедлительная медицинская помощь. Симптомы могут ограничиваться тошнотой или рвотой и не отражать тяжести передозировки или риска повреждения органов. В течение первого часа после передозировки рекомендуется промывание желудка и прием энтеросорбентов (активированный уголь, полифепан). Следует определить уровень парацетамола в плазме крови, но не ранее чем через 4 ч после передозировки (более ранние результаты недостоверны). Нужно как можно скорее ввести антидот N-ацетилцистеин в течение 24 ч после передозировки, в соответствии с общепринятыми руководствами по его применению. При необходимости пациенту вводят N-ацетилцистеин внутривенно согласно рекомендуемым дозам. При отсутствии рвоты до поступления пациента в стационар возможно применение метионина в качестве альтернативы.
Фенилэфрина гидрохлорид
Симптомы и признаки:
Передозировка фенилэфрина может привести к эффектам, аналогичным тем, которые перечислены в разделе «Побочные реакции». Дополнительные симптомы могут включать гипертонию и, возможно, рефлюкс-брадикардию. В тяжелых случаях могут возникнуть спутанность сознания, галлюцинации, судороги и аритмии. Однако количество, необходимое для получения серьезной токсичности фенилэфрина, будет больше, чем требуется, чтобы вызвать токсичность, связанную с парацетамолом.
Лечение:
Лечение должно быть клинически целесообразным. При тяжелой гипертензии может потребоваться лечение альфа-блокирующими препаратами, такими как фентоламин.
Обращайтесь за консультацией к медицинскому работнику для разъяснения способа применения лекарственного препарата.
В целом, Тайлолфен Хот хорошо переносится.
Побочные реакции на лекарства ранжируются по частоте, наиболее часто сначала, с использованием следующего соглашения: очень часто (≥1/10); часто (≥1/100 до <1/10); редко (≥1/1000 до <1/100); редко (≥1/10000 до <1/1000); очень редко (<1/10000), неизвестно (не может быть оценено по имеющимся данным).
Парацетамол
— тромбоцитопения, агранулоцитоз не обязательно могут появиться по причине приема парацетамола
— анафилаксия, кожные реакции гиперчувствительности, включая кожную сыпь, ангиодему и синдром Стивенса-Джонсона/токсический эпидермальный некролиз
— бронхоспазм
— дисфункция печени
Хлорфенирамин малеат
Очень часто:
— седативный эффект, сонливость
Часто:
— нарушение внимания, нарушение координации, головокружение, головная боль
— нечеткое зрение
— тошнота, сухость во рту
— усталость
Неизвестно
— гемолитическая анемия, дискразии крови
— аллергическая реакция, ангионевротический отек, анафилактические реакции
— анорексия
— спутанность сознания, возбуждение, раздражительность, кошмары, депрессия
— тиннитус
— сердцебиение, тахикардия, аритмии
— гипотония
— сгущение бронхиального секрета
— рвота, боли в животе, диарея, диспепсия
— гепатит, желтуха
— эксфолиативный дерматит, сыпь, крапивница, светочувствительность
— подергивание мышц, мышечная слабость
— стеснение в груди
— задержка мочи
Фенилэфрин
— нервозность, раздражительность, возбужденное состояние и возбудимость.
— головная боль, головокружение, бессонница
— повышенное кровяное давление
— тошнота, рвота
Неизвестно:
— мидриаз, закрытоугольная глаукома, чаще всего встречается у пациентов с закрытоугольной глаукомой
— тахикардия, сердцебиение, кожные и подкожные нарушения
— аллергические реакции (например, сыпь, крапивница, аллергический дерматит)
— реакции гиперчувствительности, в том числе возможна перекрестная чувствительность с другими симпатомиметиками
— дизурия, задержка мочи. Это наиболее вероятно у людей с обструкцией выходного отверстия мочевого пузыря, такой как наблюдается гипертрофия простаты
При возникновении нежелательных лекарственных реакций обращаться к медицинскому работнику, фармацевтическому работнику или напрямую в информационную базу данных по нежелательным реакциям (действиям) на лекарственные препараты, включая сообщения о неэффективности лекарственных препаратов
РГП на ПХВ «Национальный Центр экспертизы лекарственных средств и медицинских изделий» Комитет медицинского и фармацевтического контроля Министерства здравоохранения Республики Казахстан http://www.ndda.kz
Один пакет содержит
активные вещества: парацетамол 500 мг, хлорфенирамина малеат 4 мг, фенилэфрина гидрохлорид 10 мг,
вспомогательные вещества: кислота лимонная безводная, кислота винная, натрия гидрокарбонат, натрия карбонат безводный, натрия бензоат (Е211), ароматизатор лимонный, сахар рафинированный, поливинилпирролидон К 30, железа оксид желтый (Е172).
Гранулированный сыпучий порошок беловато-желтого цвета с лимонным запахом.
Порошок для приготовления раствора для приема внутрь.
По 20 г препарата в трехслойные прессованные пакеты из полиэстера, фольги алюминиевой и пленки полиэтиленовой.
По 6 или 12 пакетов вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в пачку картонную.
3 года
Не применять по истечении срока годности.
Условия хранения
Хранить при температуре не выше 25°С в сухом, защищенном от света месте.
Хранить в недоступном для детей месте!
Без рецепта
Сведения о производителе
Нобел Илач Санаи ве Тиджарет А.Ш.
Санджаклар Махаллеси Эски Акчакоджа Джадесси №299, 81100 г.Стамбул, Турция
Номер телефона: +90 216 633 60 01
Адрес электронной почты: nobel@nobel.com.tr
Держатель регистрационного удостоверения
АО «Нобел Алматинская Фармацевтическая Фабрика»
Республика Казахстан, г. Алматы, ул. Шевченко 162 Е.
Номер телефона: (+7 727) 399-50-50
Номер факса: (+7 727) 399-60-60
Адрес электронной почты nobel@nobel.kz
Наименование, адрес и контактные данные (телефон, факс, электронная почта) организации на территории Республики Казахстан, принимающей претензии (предложения) по качеству лекарственных средств от потребителей и ответственной за пострегистрационное наблюдение за безопасностью лекарственного средства:
АО «Нобел Алматинская Фармацевтическая Фабрика»
Республика Казахстан, г. Алматы, ул. Шевченко 162 Е.
Номер телефона: (+7 727) 399-50-50
Номер факса: (+7 727) 399-60-60
Адрес электронной почты nobel@nobel.kz
Ренгалин® (Rengalin) инструкция по применению
📜 Инструкция по применению Ренгалин®
💊 Состав препарата Ренгалин®
✅ Применение препарата Ренгалин®
📅 Условия хранения Ренгалин®
⏳ Срок годности Ренгалин®
Описание лекарственного препарата
Ренгалин®
(Rengalin)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2023 года.
Дата обновления: 2022.12.31
Код ATX:
R05DB
(Противокашлевые препараты другие)
Лекарственная форма
| Ренгалин® |
Таб. д/рассасывания: 20 шт. рег. №: ЛП-(000032)-(РГ-RU) |
Форма выпуска, упаковка и состав
препарата Ренгалин®
Таблетки для рассасывания от белого до почти белого цвета, плоскоцилиндрической формы, с фаской, с риской на одной плоской стороне, с цельными краями; на плоской стороне с риской нанесена надпись MATERIA MEDICA, на другой плоской стороне нанесена надпись RENGALIN.
* ЕМД — единицы модифицирующего действия.
Вспомогательные вещества: изомальт, целлюлоза микрокристаллическая, магния стеарат, лимонная кислота безводная, цикламат натрия, сахарин натрия.
10 шт. — упаковки ячейковые контурные (2) — пачки картонные.
Фармакологическое действие
Экспериментально показано, что компоненты препарата модифицируют активность лиганд-рецепторного взаимодействия эндогенных регуляторов с соответствующими рецепторами: антитела к морфину (компонент препарата) модифицируют активность лиганд-рецепторного взаимодействия эндогенных регуляторов с опиатными рецепторами; антитела к гистамину – с H1-гистаминовыми рецепторами; антитела к брадикинину – с рецепторами брадикинина; при этом совместное применение компонентов приводит к усилению противокашлевого эффекта.
Кроме противокашлевого действия, комплексный препарат за счет входящих в него компонентов оказывает противовоспалительное, противоотечное, антиаллергическое, спазмолитическое (антитела к гистамину, антитела к брадикинину) и анальгезирующее действие (антитела к морфину).
Комплексный препарат Ренгалин® за счет модификации гистамин-зависимой активации Н1-рецепторов и брадикинин-зависимой активации B1 и B2-рецепторов избирательно снижает возбудимость кашлевого центра продолговатого мозга, тормозит центральные звенья кашлевого рефлекса. Угнетая центры болевой чувствительности в таламусе, блокирует передачу болевых импульсов к коре головного мозга. Ингибирует поток болевой импульсации с периферии вследствие уменьшения высвобождения тканевых и плазменных альгогенов (гистамина, брадикинина, простагландинов и других). В отличие от наркотических анальгетиков не вызывает угнетения дыхания, лекарственной зависимости, не обладает наркогенным и снотворным действием.
Облегчает проявления острого фарингита, ларингита и бронхита, уменьшая бронхоспазм. Купирует системные и местные симптомы аллергических реакций за счет влияния на синтез и высвобождение гистамина и брадикинина из тучных клеток.
Фармакокинетика
Чувствительность современных физико-химических методов анализа (газо-жидкостная хроматография, высокоэффективная жидкостная хроматография, хромато-масс-спектрометрия) не позволяет оценивать содержание действующих веществ препарата Ренгалин® в биологических жидкостях, органах и тканях, что делает технически невозможным изучение фармакокинетики.
Показания препарата
Ренгалин®
Препарат Ренгалин® показан к применению у взрослых и детей от 3 лет:
- продуктивный и непродуктивный кашель при гриппе и ОРВИ, остром фарингите, ларинготрахеите, остром обструктивном ларингите, хроническом бронхите, хронической обструктивной болезни легких и других инфекционно-воспалительных и аллергических заболеваниях верхних и нижних дыхательных путей.
Режим дозирования
Риска не предназначена для деления таблетки на части.
Препарат принимают внутрь. На один прием — 1 таблетку (держать во рту до полного растворения). Применять по 1-2 таблетки 3 раза в сутки вне приема пищи. В зависимости от тяжести состояния в первые три дня частота приема может быть увеличена до 4-6 раза в сутки.
Длительность терапии зависит от тяжести заболевания и определяется лечащим врачом.
Побочное действие
Возможны реакции повышенной индивидуальной чувствительности к компонентам препарата.
Противопоказания к применению
- повышенная индивидуальная чувствительность к компонентам препарата;
- Ренгалин® не рекомендуется для применения у детей в возрасте до 3 лет в связи с недостаточностью данных по эффективности и безопасности.
Применение при беременности и кормлении грудью
Безопасность применения препарата Ренгалин® у беременных и в период грудного вскармливания не изучалась. При необходимости приема препарата следует учитывать соотношение польза/риск.
Применение у детей
Противопоказано применение препарата в детском возрасте до 3 лет (в связи недостаточностью данных по эффективности и безопасности).
Особые указания
Перед применением препарата Ренгалин® следует проконсультироваться с лечащим врачом.
Влияние на способность к управлению транспортными средствами и механизмами
Препарат Ренгалин® не оказывает влияния на способность управлять транспортными средствами и другими потенциально опасными механизмами.
Передозировка
При передозировке возможны диспепсические явления, обусловленные входящими в состав препарата вспомогательными веществами.
Лечение: симптоматическое.
Лекарственное взаимодействие
Случаев несовместимости с другими лекарственными средствами до настоящего времени не зарегистрировано.
Условия хранения препарата Ренгалин®
Препарат следует хранить в недоступном для детей месте при температуре не выше 25°С.
Срок годности препарата Ренгалин®
Срок годности — 3 года. Не применять по истечении срока годности.
Условия реализации
Препарат отпускают без рецепта.
Контакты для обращений
МАТЕРИА МЕДИКА ХОЛДИНГ НПФ ООО
(Россия)

|
|
МАТЕРИА МЕДИКА ХОЛДИНГ НПФ ООО 127473 Москва, 3-й Самотечный пер., д. 9 |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Умкалор® (Таблетки)
Производитель: Др. Вильмар Швабе ГмбХ & Ко. КГ
Анатомо-терапевтическо-химическая классификация: Препараты, применяемые при кашле и простудных заболеваниях
Номер регистрации в РК:
№ РК-ЛС-5№121845
Информация о регистрации в РК:
24.09.2020 — 24.09.2030
- Скачать инструкцию медикамента
Торговое название
Умкалор®
Umckalor®
Международное непатентованное название
Нет
Лекарственная форма
Таблетки, покрытые пленочной оболочкой
Состав
Одна таблетка содержит
активное вещество: корней Pеlargonium sidoides экстракта жидкого высушенного (1:8-10) (EPs® 7630) – 20.00 мг (экстрагент этанол 11 %);
вспомогательные вещества: мальтодекстрин, целлюлоза микрокристалли-ческая, лактозы моногидрат, натрия кроскармеллоза, кремния диоксид осажденный, магния стеарат, оболочка: гипромелоза 5 mPas, макрогол 1500, железа оксид желтый (Е 172), железа оксид красный (Е 172), титана диоксид (Е 171), тальк, противоспенивающая эмульсия сухое вещество**.
** состоит из: симетикона – 92.02 %, метилцеллюлозы – 7.67 % и кислота сорбиновая – 0.31 %
Описание
Таблетки круглой формы, покрытые пленочной оболочкой красновато-коричневого цвета.
Фармакотерапевтическая группа
Препараты для устранения симптомов простуды и кашля.
Код АТХ R05
Фармакологические свойства
Фармакокинетика
Умкалор® представляет собой комплексную смесь множества компонентов, рассматриваемую в целом как активное вещество. Данных о фармакокине-тических свойствах отдельных веществ не имеется.
Фармакодинамика
В препарате Умкалор® содержится экстракт из корней южно-африканского растения Pelargonium sidoides.
Исследования на животных показали, что при оральном использовании экст-ракта на мышах наблюдалось уменьшение признаков болезни (неспецифичные симптомы болезни, которые происходят в связи инфекцией) и проявлялись антиоксидантные свойства.
В ходе исследований in vitro были подтверждены следующие действия препарата Умкалор®:
стимуляция неспецифических защитных механизмов:
— стимуляция частоты колебаний ворсинок реснитчатого эпителия
— модуляция синтеза интерферона и противовоспалительных цитокинов
— стимуляция активности NK-клеток
— стимуляция фагоцитоза, экспрессии адгезивных молекул, хемотаксиса;
антимикробная активность:
— умеренная прямая антибактериальная и антивирусная активность
— усиление/ингибирование адгезии стрептококков группы А к мертвым/жи-
вым эпителиальным клеткам
— ингибирование активности ß-лактамазы
цитопротективные свойства:
— ингибирование активности человеческой лейкоцитарной эластазы
— антиоксидантные свойства.
Показания к применению
Острые и хронические инфекции , особенно инфекции дыхательных путей и области уха, горла и носа, например, бронхит, синусит, тонзиллярная ангина, ринофарингит.
Способ применения и дозы
Взрослым и детям старше 12 лет назначают по 1 таблетке 3 раза в день
(утром, днем и вечером).
Детям в возрасте от 6 до12 лет — по 1 таблетке 2 раза в день (утром и вечером).
Умкалор рекомендуется принимать, не разжевывая, с небольшим количест-вом жидкости.
Продолжительность лечения
Продолжительность лечения не должна превышать 3 недели.
После ослабления симптомов рекомендуется продолжить прием препарата еще в течение нескольких дней для предупреждения рецидива заболевания.
Побочные действия
Нечасто (≥1/1 000 — <1/100)
— желудочно-кишечные расстройства
Редко (≥1/10 000 — <1/1 000)
— легкое кровотечение из десен или из носа
— реакции гиперчувствительности
Имеются отдельные сообщения о появлении признаков нарушения функции печени после приёма препарата Умкалор®; причинно-следственной связи между этими эффектами и применением препарата не установлено; частота возникновения неизвестна.
Противопоказания
— гиперчувствительность к активному веществу или к другим компонентам
препарата
— тяжелые заболевания печени
— детский возраст до 6 лет
— беременность, период лактации
Лекарственные взаимодействия
До настоящего времени сообщений о взаимодействии препарата Умкалор® с
другими лекарственными средствами не имеется.
Особые указания
Если Ваше состояние не улучшится в течение одной недели, если в течение нескольких дней у Вас сохранится высокая температура, в случае появления признаков нарушения функции печени, а также, если у Вас появится одышка или кровянистая мокрота, немедленно обратитесь к врачу.
Не рекомендуется применять препарат пациентам с редкими наследствен-ными заболеваниями непереносимости галактозы, лактазной недостаточ-ности или глюкозо-галактозной мальабсорбции.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
Данные о влиянии препарата на способность управлять автотранспортом или работу с другими механизмами отсутствуют.
Передозировка
Нет сведений относительно случаев передозировки.
Форма выпуска и упаковка
По 15 таблеток, покрытых пленочной оболочкой, помещают в контурно-ячейковую упаковку из ПВХ/ПВДХ – пленки и алюминиевой фольги. По 1 и 2 контурно-ячейковых упаковки вместе с инструкцией по медицинскому применению на государственном и русском языках вкладывают в пачку из картона.
Условия хранения
Хранить при температуре не выше 30 °С.
Хранить в недоступном для детей месте!
Срок хранения
5 лет
Не использовать по истечении срока годности.
Условия отпуска из аптек
Без рецепта
Производитель
Др. Вильмар Швабе ГмбХ&Ко КГ,
Вильмар-Швабе-Штрассе, 4
76227, Карлсруэ
Германия
Владелец регистрационного удостоверения
Др. Вильмар Швабе ГмбХ&Ко КГ,
Вильмар-Швабе-Штрассе, 4
76227, Карлсруэ
Германия
Организация — упаковщик лекарственного средства
Др. Вильмар Швабе ГмбХ&Ко КГ.,
Вильмар-Швабе-Штрассе, 4
76227, Карлсруэ
Германия
Эксклюзивный представитель
Альпен Фарма АГ
Берн, Швейцария
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукции (товара)
ТОО «Альпен Фарма»
г. Алматы, мкр. Жетысу-2, д. 80, кв. 54
Тел./факс + 7 727 2265306
E-mail: info. kazakhstan@alpenpharma.com
| 612119321477976298_ru.doc | 54.5 кб |
| 462862341477977545_kz.doc | 51 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники