📜 Инструкция по применению НИТОКС® 200
💊 Состав препарата НИТОКС® 200
✅ Применение препарата НИТОКС® 200
📅 Условия хранения НИТОКС® 200
⏳ Срок годности НИТОКС® 200
Описание лекарственного препарата ветеринарного назначения НИТОКС® 200
Основано на официально утвержденной инструкции по применению
препарата НИТОКС® 200 для специалистов
и утверждено компанией-производителем для электронного издания справочника Видаль Ветеринар
2023 года
Дата обновления: 2023.01.10
Лекарственная форма
|
|
НИТОКС® 200 |
Раствор для инъекций рег. 44-3-12.12-2721№ПВР-3-5.0/00533 |
Форма выпуска, состав и упаковка
Раствор для инъекций прозрачный, слегка вязкий, от светло-коричневого до темно-коричневого цвета.
Вспомогательные вещества: магния оксид, диметилацетамид, ронгалит (формальдегидсульфоксилат натрия), моноэтаноламин, вода д/и.
Расфасован по 20, 50, 100 мл в стеклянные флаконы соответствующей вместимости, герметично укупоренные резиновыми пробками, укрепленными алюминиевыми колпачками c клипсами контроля первого вскрытия. Флаконы с препаратом допускается упаковывать в индивидуальные пачки из картона. Каждая потребительская упаковка снабжена инструкцией по применению препарата.
Фармакологические (биологические) свойства и эффекты
Антибактериальный препарат группы тетрациклина.
Окситетрациклин, входящий в состав препарата, обладает бактериостатическим действием, активен в отношении большинства грамположительных и грамотрицательных бактерий, в т.ч. Streptococcus spp., Staphylococcus spp., Corynebacterium spp., Clostridium spp., Erysipelothrix spp., Pasteurella spp., Fusobacterium spp., Salmonella spp., Pseudomonas spp., Actinobacteria spp., Escherichia spp., Chlamydia spp., Rickettsia spp., и Spirochaetes spp.
Механизм действия окситетрациклина основан на способности антибиотика связываться с 30S субъединицей рибосом бактериальной клетки, что приводит к нарушению синтеза белка и гибели микроорганизма.
Длительное (пролонгированное) действие лекарственного препарата обусловлено комплексом окситетрациклина дигидрата с магнием. При в/м введении окситетрациклина дигидрат быстро всасывается из места инъекции и достигает максимальных концентраций в органах и тканях через 30-50 мин после введения. Терапевтический уровень антибиотика в сыворотке крови сохраняется в течение 60-72 ч. Окситетрациклина дигидрат выводится из организма преимущественно с мочой и желчью, у лактирующих животных — частично с молоком.
Нитокс® 200 по степени воздействия на организм относится к умеренно опасным веществам (3 класс опасности по ГОСТ 12.1.007-76).
Показания к применению препарата НИТОКС® 200
Крупному, мелкому рогатому скоту и свиньям для лечения инфекционных заболеваний, вызванных чувствительными к окситетрациклину возбудителями, в т.ч.:
- респираторные заболевания;
- пастереллез;
- атрофический ринит;
- энзоотический аборт;
- мастит;
- синдром метрит-мастит-агалактия;
- кератоконъюнктивит;
- копытная гниль;
- гнойный артрит;
- пупочный сепсис;
- абсцесс;
- перитонит;
- раневые и послеродовые инфекции;
- анаплазмоз;
- вторичные инфекции при вирусных заболеваниях.
Порядок применения
Нитокс® 200 применяют животным однократно глубоко в/м в дозе 1 мл препарата на 10 кг массы животного (20 мг окситетрациклина на 1 кг массы).
При необходимости инъекцию лекарственного средства повторяют через 72 ч. При повторном введении не следует превышать интервал 72 ч, т.к. это может снизить эффективность лечения.
Максимальная доза для введения в одну точку тела: крупному рогатому скоту — 20 мл, мелким животным — 5-10 мл. Если объем вводимого раствора более указанного, его следует вводить животным в несколько мест.
Особенностей действия при первом применении препарата и при его отмене не выявлено.
При пропуске введения повторной дозы лекарственного препарата применение следует возобновить как можно быстрее в предусмотренных дозах и по той же схеме.
Побочные эффекты
В месте введения лекарственного препарата могут отмечаться эритема и зуд, которые быстро проходят и не требуют лечения. При возникновении устойчивой аллергической реакции рекомендуется в/в введение препаратов кальция (хлористый кальций, кальция борглюконат), симптоматическая терапия. При длительном применении препаратов группы тетрациклина могут возникнуть осложнения, обусловленные развитием кандидоза (поражения кожи и слизистых оболочек), а также септицемии (заражение крови), вызываемые дрожжевидным грибом Сandida albicans.
При передозировке препарата у животного может наблюдаться отказ от корма, воспалительная реакция в месте инъекций. В этом случае необходимо прекратить введение препарата. При необходимости рекомендуется в/в введение препаратов кальция (хлористый кальций, кальция борглюконат), симптоматическая терапия.
Противопоказания к применению препарата НИТОКС® 200
- индивидуальная повышенная чувствительность животного к компонентам препарата и антибиотикам тетрациклиновой группы;
- выраженные нарушения функции печени и/или почек;
- грибковые инфекции (трихофития, микроспория, кандидоз);
Запрещается применение собакам, кошкам, лошадям.
Особые указания и меры личной профилактики
Нитокс® 200 нельзя применять одновременно с кортикостероидами и эстрогенами. В связи с выраженным снижением антибактериального эффекта окситетрациклина препарат не рекомендуется применять одновременно с антибиотиками пенициллинового и цефалоспоринового ряда.
Самкам в период беременности и вскармливания приплода препарат Нитокс® 200 при необходимости применяют под контролем ветеринарного врача.
Нитокс® 200 разрешен для применения молодняку. Не рекомендуется применение молодняку в период развития зубов из-за возможного изменения цвета эмали.
Убой животных на мясо разрешается не ранее чем через 28 суток после введения лекарственного препарата. Мясо животных, вынужденно убитых до истечения указанного срока, может быть использовано для кормления пушных зверей..
Запрещается использовать в пищевых целях молоко, полученное от дойных животных в период лечения и в течение 7 суток после последнего введения препарата. Такое молоко может быть использовано для кормления животных. после термической обработки.
Меры личной профилактики
При работе с препаратом Нитокс® 200 следует соблюдать общие правила личной гигиены и техники безопасности, предусмотренные при работе с лекарственными препаратами. Во время работы запрещается пить, курить и принимать пищу. После работы с лекарственным препаратом вымыть руки с мылом.
Людям с гиперчувствительностью к компонентам препарата следует избегать прямого контакта с препаратом Нитокс® 200. При попадании препарата на кожу или слизистые оболочки их необходимо немедленно промыть большим количеством водопроводной воды. В случае появления аллергических реакций или при случайном попадании препарата в организм человека следует немедленно обратиться в медицинское учреждение (при себе иметь инструкцию по применению препарата или этикетку).
Пустую тару из-под лекарственного препарата запрещается использовать для бытовых целей; она подлежит утилизации с бытовыми отходами.
Условия хранения НИТОКС® 200
Препарат следует хранить в закрытой упаковке производителя, отдельно от продуктов питания и кормов, в защищенном от прямых солнечных лучей, недоступном для детей месте при температуре от 5° до 25°С.
Неиспользованный лекарственный препарат утилизируют в соответствии с требованиями действующего законодательства.
Срок годности НИТОКС® 200
Срок годности при соблюдении условий хранения в закрытой упаковке производителя — 3 года со дня производства, после вскрытия флакона — 28 суток. Запрещается применение препарата по истечении срока годности.
Условия отпуска
Препарат отпускается без рецепта.
Контакты для обращений
|
|
410010 Саратов, |
НИТОКС® 200 отзывы
Помогите другим с выбором, оставьте отзыв об НИТОКС® 200
Оставить отзыв
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
В 1 мл Дитрима® содержится 200 мг сульфадимезина и 40 мг триметоприма, и вспомогательные компоненты.
Сульфадимезин и триметоприм, входящие в состав Дитрима®, усиливают действие друг друга путем последовательного воздействия на метаболизм n-аминобензойной и фолиевой кислот в микробной клетке, обеспечивая широкий спектр антибактериального действия. Дитрим® активен против грамположительных и грамотрицательных микроорганизмов.
Спектр действия препарата охватывает E.соli, Clоstridium spp., Salmоnella spp., Prоteus spp., Baсillus anthraсis, Pasteurella spp., Haemоphilus spp., Vibriо spp., Stafylососсus spp., Streptососсus spp., Shigella spp., Cоrynebaсterium spp., Klebsiella spp., Fusоbaсterium spp., Bоrdetella spp., Bruсella spp, а также Eimeria и Isоspоra spp.
При внутримышечном введении Дитрим® резорбируется и достигает максимальной концентрации через 2–3 часа после инъекции.
Антибактериальное действие сохраняется в течение 24 часов. Выводится препарат из организма, в основном, с мочой, у лактирующих животных частично с молоком.
Дитрим® назначают животным для лечения бактериальных инфекций, вызываемых чувствительными к препарату микроорганизмами.
Крупный рогатый скот – бронхопневмония, колибактериоз, паратиф, метрит, вибриозная диарея и т.д.;
Мелкий рогатый скот – инфекции дыхательных путей, метрит, диарея, пастереллез, сальмонеллез, эймериоз и др.;
Свиньи
— инфекции дыхательных путей, метрит, бактериальная дизентерия, пастереллез, паратиф, колибактериоз, синдром ММА, злокачественный отек, эймериоз, изоспороз и др.;
Лошади – бактериальная пневмония, септикопиемия, паратиф, диарея жеребят;
Собаки – кишечные и легочные инфекции, цистоизоспороз;
Кролики – эймериоз;
Куры, утки, индейки – эймериоз.
Сельскохозяйственным животным Дитрим® применяется в виде внутримышечных инъекций в дозе 1 мл на 10 кг живой массы (лошадям лучше внутривенно), один раз в сутки.
При острых инфекциях первые 2–3 дня препарат вводят в ударной дозе (1 мл на 10 кг дважды в день с интервалом 12 часов).
Лечение продолжают в течение 2 дней после исчезновения клинических признаков заболевания.
Не рекомендуется продолжать лечение более 7–8 суток. В одно место инъекции вводить не более 20 мл препарата.
Кроликам и домашней птице препарат применяют в виде свежеприготовленных растворов для питья по следующей схеме:
| Профилактика | Лечение | |
| Кролики | 1 мл/л воды в течение трех дней | 1 мл/л воды в течение 5 дней или по схеме: 3 дня применения + 2 дня перерыв + 3дня применения |
| Куры, индейки | 1 мл/л воды в течение трех дней | 1 мл/л воды в течение 5 дней или по схеме: 3 дня применения + 2 дня перерыв + 3 дня применения |
| Утки | 2 мл/л воды в течение трех дней | 1 мл/л воды в течение 5 дней или по схеме: 3 дня применения + 2 дня перерыв + 3 дня применения |
При применении в рекомендуемых дозах побочных явлений и осложнений, как правило, не наблюдается.
У некоторых животных возможно появление на месте инъекции покраснения и припухлости, которые самопроизвольно проходят и не требуют применения лекарственных средств. При передозировке или превышении продолжительности рекомендуемого курса лечения возможны нарушения деятельности почек и желудочно-кишечного тракта (дисбактериоз).
В этом случае необходимо прекратить применение препарата и назначить симптоматическое лечение (щелочные жидкости, витамины и пробиотики).
Противопоказанием к применению является гиперчувствительность к сульфаниламидным препаратам.
Дитрим® не следует применять беременным самкам и животным с заболеваниями печени и почек.
Особые указания
Убой животных на мясо разрешается не ранее чем через 28 дней после последнего применения лекарственного средства.
При вынужденном убое ранее установленного срока мясо может быть использовано в корм пушным зверям или для производства мясокостной муки.
Молоко дойных животных запрещается использовать в пищевых целях в течение 5 суток после последнего введения лекарственного средства.
Такое молоко может быть использовано после термической обработки для кормления животных.
Выпускают в форме стерильного раствора светло-желтого цвета, расфасованным по 20, 50 и 100 мл в герметично закрытые стеклянные флаконы.
Вы здесь
Помощь для начинающих животноводов — корова. Часть 4. Страница 748 из 1889
Нажмите, чтобы скрыть
Перейти к полной версии/Вернуться

Самые популярные темы
- Помощь для начинающих животноводов — корова. Часть 4
- Помощь для начинающих животноводов — корова
- Нормированное кормление высокопродуктивных коров
- Симменталки от тёлочки до коровы
- Консультации ветеринара практика. КРС.
- Бычки на откорме
- Джерсейская порода
- Помощь для начинающих животноводов — корова. Часть 2
- Доильные аппараты
- Какое сочетание кормовых трав лучше высевать для сена для КРС
Топ20 в других разделах
Синонимы, аналоги
Статьи
Регистрационный номер
П N013153/01
Торговое наименование препарата
М-М-Р II® (Вакцина против кори, краснухи и паротита, живая)
Международное непатентованное наименование
Вакцина для профилактики кори, краснухи и паротита
Лекарственная форма
лиофилизат для приготовления раствора для подкожного введения
Состав
1 доза содержит:
Действующие вещества:
вирус кори с низкой вирулентностью, полученный из аттенуированного (Enders’) штамма Edmonston и выращенный в культуре клеток куриного эмбриона, не менее 1000 ТЦД50; вирус паротита, полученный из штамма Jeryl Lynn™ (уровень В) и выращенный в культуре клеток куриного эмбриона, не менее 12500 ТЦД50; вирус краснухи, полученный из живого аттенуированного штамма Wistar RA 27/3 и выращенный в культуре диплоидных клеток легочных фибробластов человека (WI-38), не менее 1000 ТЦД50.
Вспомогательные вещества:
натрия гидрофосфат 2,2 мг, натрия дигидрофосфата моногидрат 3,1 мг, натрия гидрокарбонат 0,5 мг, среда 199 с солями Хенкса 3,3 мг, среда МЕМ Игла 0,1 мг, неомицина сульфат 25 мкг, феноловый красный 3,4 мкг, сорбитол 14,5 мг, калия гидрофосфат 30 мкг, калия дигидрофосфат 20 мкг, желатин гидролизованный 14,5 мг, сахароза 1,9 мг, натрия L-глутамата моногидрат 20 мкг.
Примечание: препарат содержит следовые количества альбумина человека рекомбинантного (не более 0,3 мг), бычьего сывороточного альбумина (не более 50 нг).
Стерильный растворитель:
Вода для инъекций: 0,7 мл.
Примечание: первичная упаковка содержит 0,7 мл растворителя для растворения лиофилизата до необходимого объема (0,7 мл). Избыток 0,2 мл необходим для компенсации потерь и обеспечения введения 1 дозы вакцины в объеме 0,5 мл.
Описание
Лиофилизат: светло-желтого цвета.
Восстановленный раствор: прозрачная жидкость желтого цвета.
Растворитель: прозрачная, бесцветная жидкость.
Фармакотерапевтическая группа
МИБП — вакцина
Код АТХ
J07BD52
Фармакодинамика:
Вакцина М-М-Р II® представляет собой стерильный лиофилизированный препарат, содержащий (1) ATTENUVAX* (живая вакцина против кори, MSD) — более аттенуированная линия вируса кори, полученная из аттенуированного (Enders1) штамма Edmonston и выращенная в культуре клеток куриного эмбриона, (2) MUMPSVAX* (живая вакцина против паротита, MSD), штамм Jeryl Lynn™ (уровень В) вируса паротита, выращенный в культуре клеток куриного эмбриона и (3) MERUVAX* II (живая вакцина против краснухи, MSD), штамм Wistar RA 27/3 живого аттенуированного вируса краснухи, выращенный в культуре диплоидных клеток легочных фибробластов человека (WI-38).
ИММУНОБИОЛОГИЧЕСКИЕ СВОЙСТВА
Корь, паротит и краснуха являются распространенными заболеваниями у детей, вызываемыми вирусами кори, паротита (парамиксовирусы) и краснухи (тогавирус) соответственно. Данные заболевания могут быть причиной серьезных осложнений и/или смерти. Например, корью могут быть вызваны пневмония и энцефалит. Паротит может вызывать асептический менингит, глухоту и орхит. Краснуха, перенесенная во время беременности, может вызывать краснушный синдром у детей, рожденных от инфицированных матерей.
Клинические исследования с участием 284 детей в возрасте от 11 месяцев до 7 лет, серонегативных к трем вирусам показали, что вакцина М-М-Р II® является высокоиммуногенной и обычно хорошо переносится. В этих исследованиях одна доза вакцины индуцировала выработку противокоревых антител (анализ с помощью реакции торможения гемагглютинации — РТГА) в 95% случаев, противопаротитных нейтрализующих антител в 96% случаев, противокраснушных антител (РТГА) в 99% случаев. Однако у небольшого числа вакцинированных лиц (1-5%) после введения первой дозы сероконверсия может не произойти.
Эффективность вакцин для профилактики кори, паротита и краснухи была установлена в серии двойных слепых контролируемых исследований, которые показали высокий уровень протективной эффективности индивидуальных вакцинных компонентов. Эти исследования подтверждают, что сероконверсия в ответ на вакцинацию против кори, паротита и краснухи совпадает с появлением защиты от этих заболеваний.
Показания:
Профилактика кори, эпидемического паротита и краснухи у лиц с 12-месячного возраста и старше (см. раздел «СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ»).
Противопоказания:
— Гиперчувствительность к любому компоненту вакцины.
— Беременность (см. разделы «ОСОБЫЕ УКАЗАНИЯ», «ПРИМЕНЕНИЕ ПРИ БЕРЕМЕННОСТИ И В ПЕРИОД ГРУДНОГО ВСКАРМЛИВАНИЯ»),
— Анафилактические и анафилактоидные реакции на неомицин (каждая доза восстановленного раствора вакцины содержит около 25 мкг неомицина).
— Лихорадочные заболевания дыхательной системы или другие острые инфекции, сопровождающиеся лихорадкой.
— Острый нелеченый туберкулез.
— Пациенты, получающие иммуносупрессивную терапию. Данное противопоказание не распространяется на пациентов, получающих заместительную терапию кортикостероидами, например, по поводу Аддисоновой болезни.
— Болезни крови, лейкозы, лимфомы всех типов, другие злокачественные новообразования, поражающие костный мозг или лимфатическую систему.
— Первичные и вторичные иммунодефициты, включая пациентов с иммуносупрессией в результате СПИДа или с другими клиническими проявлениями инфицирования вирусом иммунодефицита человека; нарушения клеточного иммунитета; гипогаммаглобулинемия и дисгаммаглобулинемия. Имеются сообщения, что у лиц с тяжелым состоянием иммунодефицита непреднамеренное введение коревой вакцины приводило к коревому энцефалиту (с включением телец), пневмониту или летальному исходу.
— Наличие врожденных или наследственных иммунодефицитов у родственников (до тех пор, пока не будет доказана достаточная иммунокомпетентность пациента).
— Анафилактические или анафилактоидные реакции на куриные яйца в анамнезе.
С осторожностью:
С особой осторожностью вакцину М-М-Р II® следует вводить лицам, у которых в анамнезе наблюдались судороги (в том числе у родственников), повреждение ткани головного мозга и любые другие состояния, когда необходимо избегать воздействий, связанных с лихорадкой. В случае повышения температуры тела после вакцинации необходимо вызвать врача (см. раздел «ПОБОЧНОЕ ДЕЙСТВИЕ»).
У лиц с наличием тромбоцитопении после вакцинации может развиться более тяжелая форма тромбоцитопении. Кроме того, у лиц, перенесших тромбоцитопению после первой вакцинации М-М-Р II® (или вакциной, входящей в ее состав), тромбоцитопения может развиться и при введении последующих доз. В последнем случае для определения необходимости повторной вакцинации следует провести серологическую оценку специфического иммунитета. В подобных случаях перед вакцинацией необходимо тщательно оценить соотношение потенциального риска и пользы (см. раздел «ПОБОЧНОЕ ДЕЙСТВИЕ»),
Дети и подростки, инфицированные вирусом иммунодефицита человека и не имеющие признаков иммуносупрессии, могут быть вакцинированы. Однако иммунизация у них может быть менее эффективной, чем у неинфицированных лиц, и данных пациентов следует тщательно наблюдать по поводу развития кори, паротита и краснухи (см. раздел «ПРОТИВОПОКАЗАНИЯ»).
Беременность и лактация:
Поскольку неизвестно, может ли вакцина М-М-Р II® оказать вредное действие на плод в случае вакцинации беременной женщины, вакцину не следует вводить во время беременности. Более того, следует избегать беременности в течение 3 мес. после вакцинации (см. раздел «ПРОТИВОПОКАЗАНИЯ»).
Неизвестно, выделяются ли вакцинные вирусы кори и паротита с грудным молоком. Недавние исследования показали, что при иммунизации живой аттенуированной вакциной против краснухи женщин в период лактации вирус может определяться в грудном молоке и передаваться новорожденным. Случаи тяжелого течения заболевания у новорожденных с серологическими признаками инфицирования вирусом краснухи не встречались, однако у одного ребенка развилась типичная краснуха в легкой форме. В связи с изложенным следует соблюдать осторожность при введении вакцины М-М-Р II® кормящим женщинам.
Способ применения и дозы:
ДЛЯ ПОДКОЖНОГО ВВЕДЕНИЯ.
ВАКЦИНУ НЕЛЬЗЯ ВВОДИТЬ ВНУТРИВЕННО.
Одновременно с вакциной нельзя вводить иммуноглобулин человека (см. раздел «ВЗАИМОДЕЙСТВИЕ С ДРУГИМИ ЛЕКАРСТВЕННЫМИ ПРЕПАРАТАМИ»—).
Вакцину вводят подкожно, предпочтительно в наружную поверхность верхней трети плеча. Доза вакцины одинаковая для всех возрастов и составляет 0,5 мл.
Предостережения
Для каждой инъекции и/или растворения вакцины следует использовать стерильный шприц, не содержащий консервантов, антисептиков и детергентов, т.к. эти вещества могут инактивировать живой вакцинный вирус.
Для растворения вакцины используют только поставляемый с вакциной стерильный растворитель (вода для инъекций), т.к. он не содержит консервантов и других антивирусных веществ, которые могут инактивировать вакцину.
Каждый флакон с восстановленным раствором вакцины М-М-Р II® перед проведением инъекции должен быть визуально проверен на отсутствие механических частиц и изменение цвета. Восстановленный раствор вакцины М-М-Р II® должен быть прозрачным и иметь желтый цвет.
Рекомендуемая схема вакцинации
Дети, впервые привитые в возрасте 12 месяцев и старше, должны быть ревакцинированы в соответствии с национальным календарем прививок в 6-летнем возрасте.
Другие аспекты вакцинации
Женщины детородного возраста
Иммунизация небеременных неимунных девушек и женщин детородного возраста живой аттенуированной вакциной против краснухи, кори и паротита показана при соблюдении определенных мер предосторожности (см. раздел «ПРИМЕНЕНИЕ ПРИ БЕРЕМЕННОСТИ И В ПЕРИОД ГРУДНОГО ВСКАРМЛИВАНИЯ»).
Вакцинация неиммунных женщин детородного возраста защищает их от заболевания краснухой во время беременности, что в свою очередь предотвращает инфицирование плода и развитие у него поражений, обусловленных врожденной краснухой.
Женщинам детородного возраста рекомендуется предохраняться от беременности в течение 3 месяцев после вакцинации. Их следует проинформировать о причинах подобных мер предосторожности (см. раздел «ПРИМЕНЕНИЕ ПРИ БЕРЕМЕННОСТИ И В ПЕРИОД ГРУДНОГО ВСКАРМЛИВАНИЯ»),
Проведение серологических исследований женщин детородного возраста с целью определения их восприимчивости к краснухе с последующей прививкой серонегативных лиц является желательным, но не обязательным.
Женщин детородного возраста следует проинформировать о высокой вероятности развития через 2-4 недели после прививки обычно преходящих артралгий или артритов, (см. раздел «ПОБОЧНОЕ ДЕЙСТВИЕ»)
Женщины в послеродовом периоде
Во многих случаях оправдана вакцинация женщин, восприимчивых к краснухе, сразу после родов (см. раздел «ПРИМЕНЕНИЕ ПРИ БЕРЕМЕННОСТИ И В ПЕРИОД ГРУДНОГО ВСКАРМЛИВАНИЯ»),
Другие группы населения
Непривитые и не болевшие краснухой дети старше 12 месяцев, находящиеся в контакте с восприимчивой беременной женщиной, должны быть привиты против краснухи (моновалентной краснушной вакциной или вакциной М-М-РII®) для снижения риска возможного заражения беременной женщины.
Вакцинация рекомендована также для восприимчивых лиц из групп высокого риска, таких как учащиеся, медицинские работники, военнослужащие.
Неиммунные лица в период пребывания за границей могут инфицироваться вирусами кори, паротита и краснухи и привезти их в страну постоянного проживания. До поездки лицам, восприимчивым к одному или более из указанных заболеваний, можно ввести как моновалентную вакцину, так и вакцину М-М-Р II®.
Лицам, восприимчивым к вирусам паротита и краснухи, рекомендуется ввести вакцину М-М-Р II®; лицам, восприимчивым к вирусу кори в случае отсутствия моновалентной коревой вакцины, рекомендуется ввести вакцину М-М-Р II® независимо от их иммунного статуса относительно вирусов паротита и краснухи.
Постэкспозиционная вакцинация
Вакцинация лиц, находящихся в контакте с пациентом с корью, может обеспечить определенную защиту в случае, если вакцина введена в первые 72 ч после контакта. Если вакцина была введена за несколько дней до заражения, то в этом случае будет достигнут высокий профилактический эффект. Окончательные данные об эффективности вакцинации лиц, контактировавших с пациентом с паротитом и краснухой, отсутствуют.
Применение с другими вакцинами
Вакцину М-М-Р II® следует назначать за 1 месяц до или через 1 месяц после введения других живых вирусных вакцин.
Вакцину М-М-Р II® применяли одновременно с конъюгированной инактивированной вакциной против гемофильной инфекции типа b (Haemophilus influenza type b) и живой аттенуированной вакциной против ветряной оспы, при этом вакцины вводились разными шприцами в разные участки тела. Не было обнаружено нарушений иммунного ответа на вводимые антигены, а характер, частота и выраженность побочных реакций были сходными с таковыми при введении вакцин по отдельности.
Применение АКДС (вакцина против коклюша, дифтерии и столбняка) и/или ОПВ (вакцины оральной полиомиелитной) одновременно с вакциной против кори, паротита и краснухи не рекомендуется в связи с ограниченными данными по результатам их одновременного введения.
Также использовались иные схемы иммунизации. Данные опубликованных исследований, касающиеся одновременного введения рекомендованных вакцин для плановой иммунизации (например, АКДС [или АаКДС], ИПВ [или ОПВ], вакцины против гемофильной инфекции типа b с/или без вакцины для профилактики гепатита В, и вакцины против ветряной оспы) с другими педиатрическими вакцинами (живыми, аттенуированными или инактивированными) не выявили какого-либо взаимодействия между ними.
Рекомендации по подготовке и проведению вакцинации
Наберите полностью растворитель в шприц. Введите весь растворитель во флакон с лиофилизированной вакциной и тщательно перемешайте. Наберите все содержимое флакона в шприц и введите полностью подкожно. Рекомендуется использовать вакцину как можно раньше после растворения.
Для предупреждения передачи вируса гепатита В и других инфекционных агентов следует использовать одноразовые стерильные шприцы и иглы.
Побочные эффекты:
Ниже перечислены нежелательные реакции в порядке снижения их серьезности и без учета причины их возникновения. Нежелательные реакции указаны в соответствии с поражением органов и систем органов.
Обо всех перечисленных нежелательных реакциях сообщалось с учетом результатов клинических исследований, а также исходя из опыта практического применения вакцины М-М-Р II®, или моновалентных, или комбинированных вакцин, предназначенных для иммунизации против кори, эпидемического паротита и краснухи.
Общие расстройства
Панникулит; атипичные формы кори; лихорадка; обморок; головная боль; головокружение; недомогание; раздражительность.
Нарушения со стороны сосудов
Васкулит.
Нарушения со стороны желудочно-кишечного тракта
Панкреатит; диарея; рвота; паротит; тошнота.
Эндокринная система
Сахарный диабет.
Нарушения со стороны крови и лимфатической системы
Тромбоцитопения (см. раздел «С ОСТОРОЖНОСТЬЮ»); пурпура; региональная лимфаденопатия; лейкоцитоз.
Нарушения со стороны иммунной системы
Сообщалось об анафилактических и анафилактоидных реакциях, а также о связанных с ними явлениях, таких как ангионевротический отек (включая периферические отеки или отек лица) и бронхоспазм у лиц с аллергией или без аллергии в анамнезе.
Нарушения со стороны скелетно-мышечной и соединительной ткани
Артралгия и/или артрит (см. ниже); миалгия.
Артралгия и/или артрит
Артралгия и/или артрит (обычно транзиторные и редко хронические), а также полиневрит являются характерными симптомами при инфицировании диким типом краснухи и варьируются по частоте и тяжести в зависимости от возраста и пола. Наиболее выраженными они бывают у взрослых женщин, а наименее выражены у детей в препубертатном возрасте.
Хронический артрит сочетается с инфицированием диким типом краснухи и связан с персистенцией вирусов и/или вирусных антигенов, определяемых в тканях тела. У вакцинированных лиц хронические симптомы со стороны суставов развиваются редко.
У детей реакции со стороны суставов после вакцинации встречаются редко и являются кратковременными.
У женщин частота артрита и артралгии обычно выше, чем у детей (женщины: 12-26%; дети: 0-3%), а реакции, как правило, более выражены и более длительны. Симптомы могут персистировать в течение нескольких месяцев и в редких случаях в течение нескольких лет.
У девочек-подростков реакции со стороны суставов бывают чаще, чем у детей, но реже, чем у взрослых женщин. Даже у женщин старше 35 лет эти реакции в целом хорошо переносятся и редко влияют на качество жизни.
Нарушения со стороны нервной системы
Энцефалит; энцефалопатия (см. ниже); коревой энцефалит (с включением телец) (см. раздел «ПРОТИВОПОКАЗАНИЯ»); подострый, склерозирующий панэнцефалит (ПСПЭ); синдром Гийена-Барре; острый диссеминированный энцефаломиелит, поперечный миелит, фебрильные судороги; судороги без лихорадки или судорожные припадки; атаксия; полиневрит; полинейропатия; паралич зрительного нерва; парестезии.
Подострый склерозирующий панэнцефалит (ПСПЭ)
Сообщалось о развитии ПСПЭ у детей с отсутствием данных об инфицировании диким штаммом вируса кори в анамнезе, но получавших вакцинацию против кори. Некоторые из этих случаев могли быть вызваны недиагностированной инфекцией в первый год жизни или, возможно, вакцинацией против кори.
Национальные расчеты о распространенности вакцинации против кори показывают, что связь между ПСПЭ и вакцинацией против кори соответствует соотношению 1 случай на миллион распространенных доз. Это значительно меньше частоты развития ПСПЭ при заболевании корью, вызванной диким штаммом вируса, которая составляет 6-22 случая на миллион случаев кори. Результаты ретроспективного случай-контроль исследования, проведенного Центром по Контролю и Профилактике Заболеваний США, позволяют предположить, что вакцинация защищает от развития ПСПЭ путем предотвращения заболевания корью, которая характеризуется высоким риском развития ПСПЭ.
Асептический менингит
Сообщалось о развитии асептического менингита после использования вакцины против кори, паротита и краснухи. Хотя была продемонстрирована причинная связь между штаммом паротита Urabe и асептическим менингитом, нет данных, которые бы свидетельствовали о существовании связи между штаммом паротита Jeryl Lynn™ и асептическим менингитом.
Энцефалит/энцефалопатия
На каждые 3 миллиона доз вакцины для профилактики кори, краснухи и паротита, произведенной компанией Мерк Шарп и Доум, приходился примерно один случай энцефалита/энцефалопатии. Пострегистрационное наблюдение, продолжающееся с 1978 г., свидетельствует о том, что о серьезных нежелательных явлениях, таких как энцефалит/энцефалопатия, по-прежнему сообщается редко. Риск возникновения таких серьезных неврологических заболеваний после введения живой вирусной вакцины для профилактики кори остается намного меньшим, чем риск возникновения энцефалита/энцефалопатии после перенесенного заболевания диким типом вируса кори (один на тысячу случаев заболевания).
У лиц с тяжелым иммунодефицитом, непреднамеренно привитых коревой вакциной, регистрировались случаи коревого энцефалита с тельцами- включениями, пневмонита и случаи летального исхода как прямого следствия диссеминированной инфекции, вызванной вакцинным вирусом (см. раздел «ПРОТИВОПОКАЗАНИЯ»); также сообщалось о диссеминированной инфекции, вызванной вакцинными вирусами паротита и краснухи.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Пневмония; пневмонит (см. раздел «ПРОТИВОПОКАЗАНИЯ»); боль в горле; кашель; ринит.
Нарушения со стороны кожи и подкожных тканей
Синдром Стивенса-Джонсона; многоформная эритема; крапивница; сыпь; сыпь, напоминающая коревую; зуд.
Местные реакции, включающие чувство жжения и/или покалывания в месте инъекции; волдыри или гиперемию в месте введения; покраснение (эритему); отек; уплотнение; болезненность; образование везикул в месте введения, пурпуру Шенлейна- Геноха, острый геморрагический отек у детей грудного возраста.
Нарушения со стороны органа слуха и лабиринтные нарушения
Нейросенсорная потеря слуха; средний отит.
Нарушения со стороны органа зрения
Ретинит; невриты зрительного нерва; папиллит; ретробульбарный неврит; конъюнктивит.
Мочеполовая система
Эпидидимит; орхит.
Прочие
Редко сообщалось о смерти по разным, порой неизвестным, причинам, последовавшей после введения вакцины против кори, паротита и краснухи; тем не менее среди здоровых лиц не была установлена причинно-следственная связь (см. раздел «ПРОТИВОПОКАЗАНИЯ»). В опубликованном пострегистрационном исследовании, проведенном в Финляндии и охватившем 1,5 миллиона детей и взрослых, получивших вакцинацию препаратом М-М-Р II® в период с 1982 по 1993 гг., отсутствуют сообщения о летальных исходах или длительных осложнениях.
Передозировка:
Редкие случаи передозировки препарата не сопровождались серьезными нежелательными явлениями.
Взаимодействие:
Введение иммуноглобулинов совместно с вакциной М-М-Р II® может нарушить ожидаемый иммунный ответ. Вакцинацию следует отложить на 3 месяца или провести за 4 недели до введения иммуноглобулинов человека, а также переливания крови или плазмы.
Особые указания:
Как любая вакцина, М-М-Р II® может не обеспечить защиту от заболевания у 100% вакцинированных.
Учитывая возможность анафилактических и анафилактоидных реакций, следует иметь в наличии необходимые средства их лечения, включая адреналин для инъекций (1:1000). Вакцину необходимо хранить в защищенном от света месте, поскольку свет может инактивировать вирусы. Восстановленную вакцину необходимо использовать как можно раньше после растворения.
У большинства восприимчивых лиц наблюдается выделение небольших количеств живого аттенуированного вируса краснухи через нос или глотку в период с 7-й по 28-й день после вакцинации.
Достоверные данные о том, что данный вирус может передаваться восприимчивым лицам, находящимся в контакте с вакцинированным лицом, отсутствуют. Таким образом, риск заражения при тесном личном контакте не является значительным, хотя теоретически заражение возможно. Однако имеются подтверждения передачи вакцинного вируса краснухи детям через грудное молоко (см. раздел «ПРИМЕНЕНИЕ ПРИ БЕРЕМЕННОСТИ И В ПЕРИОД ГРУДНОГО ВСКАРМЛИВАНИЯ»)
Сообщения о передаче аттенуированного живого вируса кори или паротита от вакцинированных восприимчивым лицам отсутствуют.
Имеются сообщения о том, что живые вакцины против кори, паротита и краснухи, введенные раздельно, могут привести к временному снижению туберкулиновой чувствительности кожи. Следовательно, если необходимо провести туберкулиновый тест, он должен быть сделан либо до, либо одновременно с вакцинацией препаратом М-М-Р II®.
У детей, находящихся на лечении по поводу туберкулеза, не наблюдалось обострения заболевания при иммунизации живой коревой вакциной. Сообщения об исследованиях влияния живой коревой вакцины на детей с нелеченым туберкулезом отсутствуют.
Консультируя женщину, которая была случайно вакцинирована во время беременности или забеременела в течение 3 мес. после вакцинации, врач должен учитывать следующие факты: 1) в 10-летнем исследовании более 700 беременных женщин, вакцинированных против краснухи в течение 3 мес. до или после зачатия (189 из них получали штамм Wistar RA 27/3), ни у одного из новорожденных не выявлено врожденных пороков, характерных для синдрома врожденной краснухи; 2) паротитная инфекция во время первого триместра беременности может повысить риск спонтанного аборта. Хотя было показано, что вакцинный вирус паротита инфицирует плаценту и плод, данные о том, что он может вызывать врожденные пороки у человека, отсутствуют; 3) имеются сообщения о том, что естественное заражение корью во время беременности повышает риск для плода. Увеличение частоты спонтанных абортов, мертворождений, врожденных дефектов и преждевременных родов наблюдалось при заболевании диким штаммом вируса кори во время беременности.
Адекватные исследования по влиянию аттенуированного вакцинного штамма вируса кори на беременность не проводились, однако оправдано предположение о том, что вакцинный штамм вируса кори также способен оказывать повреждающее действие на плод.
Живая коревая вакцина и живая вакцина против паротита выращены в культуре клеток куриного эмбриона. Лица, у которых в анамнезе присутствуют анафилактические, анафилактоидные и другие реакции гиперчувствительности немедленного типа (например, крапивница, отек слизистой рта и глотки, затруднение дыхания, артериальная гипотония или шок) после употребления куриных яиц, имеют повышенный риск развития реакции гиперчувствительности немедленного типа после введения вакцины, содержащей следы антигенов куриного эмбриона. В подобных случаях перед вакцинацией необходимо тщательно оценить соотношение потенциального риска и пользы. Таких пациентов следует вакцинировать в исключительных случаях, имея в наличии все средства, необходимые в случае возникновения аллергической реакции.
Влияние на способность управлять транспортными средствами и механизмами:
Исследований влияния вакцины М-М-Р II® на способность управлять транспортными средствами, а также работать с механизмами не проводилось.
Форма выпуска/дозировка:
Лиофилизат для приготовления раствора для подкожного введения, 1 доза.
Упаковка:
Первичная упаковка
Вакцина:
Лиофилизат для приготовления раствора для подкожного введения 1 доза во флаконе из бесцветного стекла вместимостью 3 мл. Флакон укупорен пробкой серого бутилового или серого хлорбутилового каучука с покрытием В2-42 под алюминиевой обкаткой и закрыт отщелкивающейся пластиковой крышкой с контролем первого вскрытия.
Растворитель (флаконы):
Вода для инъекций 0,7 мл во флаконе из бесцветного стекла. Флакон укупорен пробкой серого хлорбутилового каучука с покрытием В2-42 под алюминиевой обкаткой и закрыт отщелкивающейся пластиковой крышкой с контролем первого вскрытия.
Растворитель (шприцы):
Вода для инъекций по 0,7 мл в одноразовом стерильном шприце вместимостью 1 мл из боросиликатного стекла (тип 1, USP/EP). Шприц оснащен защитным хлорбутиловым или стирол-бутадиеновым колпачком и хлорбутиловым ограничителем хода поршня.
Вторичная упаковка (флакон с вакциной и флакон с растворителем):
1 флакон с вакциной и 1 флакон с растворителем помещены в картонную пачку с инструкцией по медицинскому применению.
10 флаконов с вакциной помещены в картонную пачку (А) с инструкцией по медицинскому применению. 10 флаконов с растворителем помещены в картонную пачку (Б).
Вторичная упаковка (флакон с вакциной и шприц с растворителем):
1 флакон с вакциной и 1 шприц с растворителем в комплекте с 1 или 2 стерильными иглами (или без игл) в контурной ячейковой упаковке, закрытой фольгой.
1 контурная ячейковая упаковка помещена в картонную пачку с инструкцией по медицинскому применению.
Условия хранения:
Хранить при температуре от 2 до 8 °С, в защищенном от света месте.
Растворитель может храниться вместе с вакциной при температуре от 2 до 8 °С или отдельно при температуре не выше 25 °С.
Рекомендуется использовать вакцину как можно раньше после растворения.
Хранить в недоступном для детей месте.
Примечание: хранение растворителя отдельно от вакцины при температуре не выше 25 °С возможно только при условии, что растворитель упакован в картонную пачку Б.
Срок годности:
Лиофилизат: 2 года.
Растворитель: 3 года.
Не применять по истечении срока годности.
Примечание: на первичной и вторичной упаковке вакцины в комплекте с растворителем указывают срок годности — 2 года. Срок годности комплекта считается с даты производства лиофилизата.
Условия отпуска
По рецепту
Производитель
Мерк Шарп и Доум Б.В., Waarderweg 39, 2031 BN, Haarlem, the Netherlands, Нидерланды
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
Мерк Шарп и Доум Б.В.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Мабтера (500 мг/50мл)
МНН: Ритуксимаб
Производитель: Рош Диагностикс ГмбХ
Анатомо-терапевтическо-химическая классификация: Rituximab
Номер регистрации в РК:
№ РК-ЛС-5№021270
Информация о регистрации в РК:
30.03.2015 — 30.03.2020
Информация о реестрах и регистрах
Информация по ценам и ограничения
Предельная цена закупа в РК:
380 152.76 KZT
- Скачать инструкцию медикамента
Торговое название
Мабтера
Международное непатентованное название
Ритуксимаб
Лекарственная форма
Концентрат для приготовления раствора для внутривенных инфузий
100 мг/10 мл, 500 мг/50 мл
Состав
Один мл концентрата содержит
активное вещество — ритуксимаб 10 мг,
вспомогательные вещества: натрия цитрата дигидрат, полисорбат 80, натрия хлорид, вода для инъекций, кислота хлороводородная или натрия гидроксид
Описание
Прозрачная или слегка опалесцирующая жидкость от бесцветного до бледно-желтого цвета.
Фармакотерапевтическая группа
Противоопухолевые препараты. Противоопухолевые препараты другие. Моноклональные антитела. Ритуксимаб
Код АТХ L01XС02
Фармакологические свойства
Фармакокинетика
У больных, получавших ритуксимаб путем внутривенной инфузии в дозах 125, 250 или 375 мг/м2 поверхности тела один раз в неделю четыре раза, концентрация антител в сыворотке крови возрастала по мере увеличения дозы. У больных, получавших дозу 375 мг/м2, после первой инфузии средний период полувыведения ритуксимаба из сыворотки крови составил 68,1 часа, максимальная концентрация — 238,7 мкг/мл, а средний плазменный клиренс — 0,0459 л/час. После четвертой инфузии средний период полувыведения из сыворотки крови, максимальная концентрация и плазменный клиренс составили 189,9 часа, 480,7 мкг/мл и 0,0145 л/час, соответственно.
У больных, у которых ритуксимаб оказывал положительный эффект, его сывороточные концентрации до и после четвертой инфузии и после лечения были достоверно выше. Их значения отрицательно коррелировали с величиной опухолевой нагрузки. Ритуксимаб определяется в организме в течение 3-6 месяцев после последней инфузии.
Фармакодинамика
Ритуксимаб — химерические рекомбинантные моноклональные антитела мыши/человека, которые специфически связываются с трансмембранным антигеном CD20. Этот антиген расположен на пре-В-лимфоцитах и зрелых В-лимфоцитах, но отсутствует на стволовых гемопоэтических клетках, про-В-клетках, здоровых плазматических клетках и здоровых клетках других тканей. Экспрессия антигена СD20 характерна более чем для 95% В-клеточных неходжкинских лимфом. После связывания с антителом CD20 не интернализуется и не сбрасывается с клеточной мембраны в окружающую среду. CD20 не циркулирует в крови в виде свободного антигена и поэтому не конкурирует за связывание с антителами.
Ритуксимаб связывается с антигеном CD20 на В-лимфоцитах и вызывает иммунологические реакции, способствующие лизису В-клеток. Возможные механизмы клеточного лизиса включают комплемент-зависимую цитотоксичность (КЗЦ) и антитело-зависимую клеточную цитотоксичность (АЗКЦТ). Уровень В-клеток в периферической крови после первого введения препарата становится ниже нормы, а через 6 месяцев начинает восстанавливаться, возвращаясь к норме между 9 и 12 месяцами после завершения терапии.
Антихимерные антитела были выявлены у 1,1% (4 больных) из 356 обследованных.
Показания к применению
Мабтера показана к применению у взрослых пациентов при следующих заболеваниях:
Неходжкинская лимфома (НХЛ)
-
фолликулярная лимфома III-IV стадии в комбинации с химиотерапией у ранее нелеченных пациентов
-
фолликулярная лимфома в качестве поддерживающей терапии после ответа на индукционную терапию
-
фолликулярная лимфома III-IV стадии в монотерапии у пациентов с резистентностью к химиотерапии или у пациентов с повторной химиотерапией или последующим после химиотерапии рецидивом
-
CD20-положительная диффузная В-крупноклеточная неходжкинская лимфома в комбинации с химиотерапией по схеме СНОР (циклофосфамид, доксорубицин, винкристин, преднизолон)
Хронический лимфолейкоз (ХЛЛ)
-
хронический лимфолейкоз в комбинации с химиотерапией у пациентов, ранее не получавших стандартную терапию, а также с последующим после химиотерапии рецидивом/устойчивостью к химиотерапии. Имеются лишь ограниченные данные об эффективности и безопасности препарата у пациентов, ранее получавших лечение моноклональными антителами, включая препарат Мабтера, или у пациентов с резистентностью при лечении комбинацией Мабтера + химиотерапия
Ревматоидный артрит
-
тяжелый ревматоидный артрит (активная форма) у взрослых пациентов в комбинации с метотрексатом при непереносимости или неадекватном ответе на другие базисные противовоспалительные препараты (DMARD), включающие один или более ингибиторов фактора некроза опухолей (ФНО).
Мабтера показана для торможения рентгенологически доказанной деструкции суставов и улучшения физических функций в суставе в комбинации с метотрексатом
Гранулематоз с полиангиитом (гранулематоз Вегенера) и микроскопический полиангиит
-
тяжелые формы активного гранулематоза с полиангиитом (гранулематоза Вегенера) и микроскопического полиангиита в комбинации с глюкокортикостероидами.
Способ применения и дозы
Инфузионное введение препарата Мабтера следует осуществлять под тщательным контролем врача, имеющего опыт в применении противоопухолевых препаратов, а также при условии доступности средств и оборудования, необходимых для проведения реанимационных мероприятий.
Перед каждой инфузией препарата Мабтера необходимо проводить премедикацию антипиретическими и антигистаминными препаратами, например, парацетамолом и дифенгидрамином.
Пациентам с НХЛ и ХЛЛ следует провести премедикацию глюкокортикоидами в тех случаях, когда терапия Мабтерой не сочетана со схемой химиотерапии (ХТ), в состав которой входят стероиды.
Пациентам с ревматоидным артритом за 30 минут до инфузии Мабтеры проводят премедикацию путем внутривенного введения 100 мг метилпреднизолона для снижения частоты и выраженности острых инфузионных реакций (ОИИ).
Пациентам с гранулематозом с полиангиитом (гранулематоз Вегенера) или микроскопическим полиангиитом до начала первой инфузии препарата Мабтера рекомендуется внутривенное введение метилпреднизолона в течение 1-3 дней в дозе 1000 мг/сутки (последняя доза метилпреднизолона может быть введена непосредственно в день первой инфузии препарата Мабтера). Затем следует пероральный прием преднизолона в дозе 1 мг/кг/сутки (но не более 80 мг/сутки) c постепенным снижением дозы последнего до полной отмены (темпы снижения дозы, определяются конкретной клинической ситуацией). Терапию глюкокортикортикостероидами следует продолжать во время и после завершения терапии препаратом Мабтера.
Неходжкинская лимфома (НХЛ)
Фолликулярная неходжкинская лимфома
Комбинированная терапия
Рекомендованная доза препарата Мабтера в комбинации с химиопрепаратами в индукционной терапии у пациентов, ранее не получавших терапию, а также у пациентов с последующим после химиотерапии рецидивом/устойчивостью к химиотерапии составляет 375 мг/м2 поверхности тела на 1 цикл, общим количеством до 8 циклов.
Инфузию препарата Мабтера проводят в 1-й день каждого цикла химиотерапии после внутривенного введения глюкокортикоидного компонента схемы химиотерапии (в тех случаях, когда терапия Мабтерой не сочетана со схемой химиотерапии, в состав которой входят стероиды).
Поддерживающая терапия
Пациенты, ранее не получавшие терапию
Рекомендуемые доза и режим у пациентов с положительным ответом на индукционную терапию: 375 мг/м2 поверхности тела 1 раз в 2 месяца (через 2 месяца после приема последней дозы индукционной терапии) до прогрессирования заболевания или максимум в течение 2 лет.
Рецидивирующая/резистентная фолликулярная лимфома
У пациентов с положительным ответом на индукционную терапию рекомендованная доза составляет 375 мг/м2 поверхности тела 1 раз в 3 месяца (через 3 месяца после приема последней дозы индукционной терапии) до прогрессирования заболевания или максимум в течение 2 лет.
Монотерапия
Рецидивирующая/резистентная фолликулярная лимфома
Рекомендуемая доза в качестве индукционной терапии у взрослых пациентов с фолликулярной лимфомой III-IV стадии с резистентностью к химиотерапии или у пациентов с повторной химиотерапией или последующим после химиотерапии рецидивом: 375 мг/м2 поверхности тела 1 раз в неделю в течение 4 недель путем внутривенной инфузии.
Для повторного цикла монотерапии у пациентов с ответом на предыдущую монотерапию препаратом Мабтера рекомендуемая доза составляет 375 мг/м2 поверхности тела 1 раз в неделю в течение 4 недель путем внутривенной инфузии.
Диффузная В-крупноклеточная неходжкинская лимфома
Мабтеру применяют в комбинации с химиотерапией по схеме СНОР. Рекомендованная доза Мабтеры составляет 375 мг/м2 поверхности тела, вводимая в 1-й день каждого цикла в течение 8 циклов химиотерапии после внутривенного введения глюкокортикостероидного компонента схемы СНОР. Эффективность и безопасность препарата Мабтера у пациентов с диффузной В-крупноклеточной неходжкинской лимфомой при лечении в комбинации с другими химиотерапевтическими препаратами не установлены.
Коррекция дозы во время лечения
Снижение дозы не рекомендуется. В случаях назначения препарата в комбинации с химиотерапией следует применять стандартное снижение дозы химиотерапевтических препаратов.
Хронический лимфолейкоз (ХЛЛ)
Больным ХЛЛ для профилактики и снижения риска развития синдрома быстрого лизиса опухоли рекомендуется проводить достаточную гидратацию и введение препаратов, снижающих концентрацию мочевой кислоты в крови (урикостатиков) за 48 часов до введения Мабтеры. Для снижения риска и тяжести острых инфузионных реакций и/или синдрома выброса цитокинов больным ХЛЛ с уровнем лимфоцитов ˃25 Х 109 /л рекомендуется ввести преднизон/преднизолон в дозе 100 мг внутривенно незадолго до инфузии Мабтеры.
Рекомендуемая доза Мабтеры в комбинации с химиотерапией у пациентов, ранее не получавших терапию, а также у пациентов с рецидивирующим/резистентным ХЛЛ – 375 мг/м2 поверхности тела в 0-й день первого цикла, затем – 500 мг/м2 поверхности тела в каждый 1-й день последующих циклов, всего на протяжении 6 циклов. Цитостатические препараты вводят после инфузии Мабтеры.
Ревматоидный артрит
Курс лечения состоит из 2-х внутривенных инфузий по 1000 мг препарата Мабтера. После введения рекомендуемой дозы 1000 мг через 2 недели следует 2-я внутривенная инфузия 1000 мг.
Пациентам с ревматоидным артритом вводят 100 мг метилпреднизолона за 30 минут до введения Мабтеры для снижения частоты и выраженности острых инфузионных реакций. Премедикацию анальгетиками/антипиретиками (например, парацетамолом) и антигистаминными препаратами (например, дифенгидрамином) следует всегда проводить перед каждой инфузией Мабтеры (см. раздел «Побочные действия»).
Необходимость дальнейшего курса лечения оценивается по истечении 24 недель после предыдущего курса. Повторное лечение может быть назначено в этот период, если остаются остаточные явления заболевания, в противном случае повторный курс может быть отложен до повторного появления симптомов активности заболевания.
Имеющиеся данные позволяют предположить, что клинический ответ обычно достигается на 16-24 неделе индукционной терапии. В этот период, в случае отсутствия доказательств эффективности проведенного лечения, следует тщательно оценить необходимость продолжения терапии.
Первая инфузия каждого цикла
Рекомендованная начальная скорость инфузии составляет 50 мг/час; в дальнейшем ее можно увеличивать на 50 мг/час каждые 30 минут, доводя до максимальной скорости 400 мг/час.
Вторая инфузия каждого цикла
Последующие инфузии Мабтеры можно начинать со скорости 100 мг/час и увеличивать на 100 мг/час каждые 30 минут до максимальной скорости 400 мг/час.
Гранулематоз с полиангиитом (гранулематоз Вегенера) и микроскопический полиангиит
Рекомендуемый режим дозирования составляет 375 мг/м2 поверхности тела, вводимых путем внутривенной инфузии 1 раз в неделю в течение 4 недель (всего 4 инфузии).
Первая инфузия
Рекомендованная начальная скорость инфузии 50 мг/час; затем скорость можно увеличить на 50 мг/час каждые 30 минут до максимальной 400 мг/час.
Последующие инфузии (2-4)
Последующие инфузии Мабтеры можно начинать со скорости 100 мг/час и повышать ее каждые 30 минут на 100 мг/час до максимальной 400 мг/час.
Во время и после завершения терапии препаратом Мабтера у пациентов с гранулематозом с полиангиитом (гранулематозом Вегенера) и микроскопическим полиангиитом рекомендуется проведение профилактики пневмоцистной пневмонии (вызываемой Pneumocystis jiroveci).
Дозирование в особых случаях
Дети. Безопасность и эффективность препарата Мабтера у пациентов в возрасте до 18 лет не установлены.
Пожилые пациенты. У пожилых пациентов (в возрасте старше 65 лет) корректировка дозы препарата не требуется.
Способ применения
Необходимое количество препарата набирают в асептических условиях и разводят до расчетной концентрации ритуксимаба (1-4 мг/мл) в инфузионном флаконе (пакете) со стерильным апирогенным 0,9% раствором натрия хлорида или 5 % раствором глюкозы. Для перемешивания раствора аккуратно переворачивают флакон (пакет) во избежание пенообразования. Следует предпринять все необходимые меры для обеспечения стерильности препарата. Требуется соблюдение асептических условий разведения препарата, т.к. препарат не содержит консервантов и бактериостатических агентов. Препараты для парентерального введения следует вначале осмотреть на предмет посторонних частиц или изменения окраски.
Неиспользованный препарат следует утилизировать в соответствии с локальными требованиями.
Побочные действия
Опыт лечения НХЛ и ХЛЛ
Общий профиль безопасности препарата Мабтера у пациентов с НХЛ и ХЛЛ основан на данных, полученных в клинических и постмаркетинговых исследованиях. Пациенты в этих исследованиях получали Мабтеру в монотерапии (в качестве индукционной терапии или последующей поддерживающей терапии) или в сочетании с химиотерапией.
Наиболее часто наблюдаемыми побочными реакциями у пациентов были реакции, связанные с инфузией, большая часть которых имела место во время первой инфузии. Частота развития инфузионных реакций значительно снижалась с каждой последующей инфузией и составляла 1% после 8 инфузий Мабтеры.
Случаи инфицирования (в основном бактериального или вирусного) в период клинических исследований наблюдались приблизительно у 30-55% пациентов с НХЛ и у 30-50% пациентов с ХЛЛ.
Наиболее частые зарегистрированные или наблюдаемые серьезные побочные реакции на лекарственный препарат включают:
-
инфузионные реакции (включая синдром высвобождения цитокинов, синдром лизиса опухоли)
-
инфекции
-
сердечно-сосудистая недостаточность
Другие зарегистрированные побочные реакции на лекарственный препарат включают реактивацию гепатита В и прогрессирующую многоочаговую лейкоэнцефалопатию (ПМЛ).
Частота зарегистрированных побочных реакций на лекарственный препарат Мабтера в сочетании с химиотерапией приведена ниже. В каждой группе частотности нежелательные эффекты представлены в порядке убывания по степени тяжести. Частота определяется как «Очень часто» (≥ 1/10), «Часто» (от ≥ 1/100 до < 1/10), «Нечасто» (от ≥ 1/1,000 до < 1/100), «Редко» (от ≥ 1/10000 до < 1/1000) и «Очень редко» (< 1/10000). Побочные реакции на лекарственный препарат, наблюдавшиеся в постмаркетинговом исследовании, для которых невозможно было установить частоту, перечислены ниже в группе «Частота неизвестна».
Таблица 1: Побочные реакции на лекарственный препарат, зарегистрированные в клинических исследованиях или в постмаркетинговый период у пациентов с НХЛ и ХЛЛ, получавших Мабтеру в качестве монотерапии/поддерживающей терапии или в сочетании с химиотерапией.
|
Системно-органный класс |
Очень часто |
Часто |
Нечасто |
Редко |
Очень редко |
Частота неизвестна |
|
Инфекционные и паразитарные заболевания |
Бактериальные, вирусные инфекции, +бронхит |
Сепсис, +пневмония, +лихорадка, +Herpes zoster, +инфекции дыхательной системы, грибковые инфекции, инфекции неизвестной этиологии, +острый бронхит, +синусит, гепатит B1 |
Тяжелые вирусные инфекции2, пневмоцистная пневмония |
Прогрессирующая многоочаговая лейкоэнцефалопатия (ПМЛ) |
||
|
Нарушения со стороны кровеносной/ лимфатической систем |
Нейтропения, лейкопения, +фебрильная нейтропения, +тромбоцитопения |
Анемия, +панцитопения, +гранулоцитопения |
Нарушения коагуляции, апластическая анемия, гемолитическая анемия, лимфаденопатия |
Транзиторное повышение уровня IgM в сыворотке3 |
Поздняя отсроченная нейтропения3 |
|
|
Нарушения со стороны иммунной системы |
Инфузионные реакции4, ангионевротический отек |
Реакции гиперчувствительности |
Анафилаксия |
Синдром лизиса опухоли, синдром высвобождения цитокинов4, сывороточная реакция |
Инфузионная острая обратимая тромбоцитопения4 |
|
|
Нарушения со стороны обмена веществ и питания |
Гипергликемия, снижение веса, периферический отек, отек лица, повышение уровня лактатдегидрогеназы, гипокальциемия |
|||||
|
Психические расстройства |
Депрессия, нервозность |
|||||
|
Нарушения со стороны нервной системы |
Парестезия, гипестезия, беспокойство, бессонница, вазодилатация, головокружение, тревожность |
Дисгевзия |
Периферическая нейропатия, паралич лицевого нерва5 |
Невропатия черепно-мозговых нервов, утеря функций других органов чувств5 |
||
|
Нарушения со стороны органа зрения |
Слезотечение, конъюнктивит |
выраженная потеря зрения5 |
||||
|
Нарушения со стороны органа слуха и равновесия |
Звон в ушах, боль в ушах |
Потеря слуха5 |
||||
|
Нарушения сердечной деятельности |
+инфаркт миокарда4 и 6, аритмия, +фибрилляция предсердий, тахикардия, +нарушение сердечной деятельности |
+Левожелудочковая недостаточность, +наджелудочковая тахикардия, +желудочковая тахикардия, +стенокардия + ишемия миокарда, брадикардия |
Тяжелые сердечные нарушения 4 и 6 |
Сердечная недостаточность 4 и 6 |
||
|
Сосудистые нарушения |
Гипертензия, ортостатическая гипотензия, гипотензия |
Васкулит (в основном кожный), лейкоцитокластический васкулит |
||||
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
Бронхоспазм4, респираторные заболевания, боль в груди, одышка, усиливающийся кашель, ринит |
Астма, облитерирующий бронхит, легочные заболевания, гипоксия |
Интерстициальная пневмония7 |
Нарушение дыхания4 |
Инфильтрация легких |
|
|
Нарушения со стороны желудочно-кишечного тракта |
Тошнота |
Рвота, диарея, боль в животе, затрудненное глотание, стоматит, запор, диспепсия, анорексия, раздражение гортани |
Увеличение живота |
Желудочно-кишечное прободение7 |
||
|
Нарушения со стороны кожи и подкожной клетчатки |
Кожный зуд, сыпь, +алопеция |
Крапивница, усиленное потоотделение, ночная потливость, +воспаление кожи |
Тяжелая буллезная кожная реакция, синдром Стивенса-Джонсона, токсический эпидермальный некролиз (синдром Лайелла)7 |
|||
|
Нарушения со стороны скелетно-мышечной и соединительной ткани, поражение костей |
Мышечный гипертонус, миалгия, артралгия, боли в спине и шее |
|||||
|
Нарушения со стороны почек и мочевыводящих путей |
Почечная недостаточность4 |
|||||
|
Общие расстройства и нарушения в месте введения |
Жар, озноб, общая слабость, головная боль |
Болезненная припухлость, гиперемия, дискомфорт, озноб, +усталость, +дрожь, +мультиорганная недостаточность4 |
Боль в месте инфузии |
|||
|
Исследование |
Уменьшение уровня IgG |
|||||
|
Для каждой категории расчет частотности основывался на реакциях любой тяжести (от легкой до тяжелой), кроме отмеченных «+» где частота основана только на тяжелом характере реакции (≥ уровня 3 общего критерия токсичности NCI). Указывается только наибольшая частота, наблюдаемая в исследованиях.
|
Следующие реакции были зарегистрированы как неблагоприятные события, имевшие место во время клинических исследований; однако в группах приема Мабтеры они наблюдались с аналогичной или меньшей частотой по сравнению с контрольными группами: гематотоксичность, инфекция при нейтропении, инфекция мочевых путей, сенсорные нарушения, лихорадка.
Реакции, связанные с инфузией.
Признаки и симптомы, предполагающие реакции, связанные с инфузией, были зарегистрированы у более чем 50% пациентов ходе клинических испытаний, и главным образом, наблюдались во время первых инфузий, как правило, в течение первых 1-2 часов. Эти симптомы включали в себя лихорадочное состояние, озноб, дрожь. Другие симптомы включали в себя гиперемию, сосудистый отек, бронхоспазм, тошноту, рвоту, крапивницу/кожную сыпь, усталость, головную боль, раздражение гортани, ринит, кожный зуд, боль, тахикардию, гипертензию, гипотензию, затруднение дыхания, диспепсию, астению и признаки синдрома лизиса опухоли. Тяжелые реакции, связанные с инфузией (такие как бронхоспазм, гипотензия) возникали в 12% случаев. Дополнительные зарегистрированные в некоторых случаях реакции: инфаркт миокарда, мерцательная аритмия, отек легких, острая обратимая тромбоцитопения. Обострение существующих сердечных болезней, таких как стенокардия или застойная сердечная недостаточность или серьезные кардиальные события (сердечная недостаточность, инфаркт миокарда, мерцательная аритмия), отек легких, функциональная недостаточность нескольких органов, синдром лизиса опухоли, синдром высвобождения цитокинов, почечная и дыхательная недостаточность, были зарегистрированы как редко возникающие или неизученные. Частота возникновения симптомов, связанных с инфузией, значительно снижалась с каждой последующей инфузией и к восьмому циклу терапии Мабтеры составляла менее 1% пациентов.
Инфекции
Мабтера вызывает истощение В-клеток у 70-80% пациентов, но лишь у небольшой доли пациентов прием Мабтеры был связан с уменьшением уровня сывороточного иммуноглобулина .
Локализованные грибковые инфекции, а также Herpes zoster в рандомизированных исследованиях чаще наблюдались в группе Мабтеры. Тяжелые инфекции были зарегистрированы приблизительно у 4% пациентов проходивших монотерапию Мабтерой. Более частые случаи инфекций в целом, включая 3-4 степени тяжести, по сравнению с контрольными группами, наблюдались при поддерживающем лечении Мабтерой, в течение периода до 2-х лет. За 2 года наблюдений накопления токсичности в аспекте инфекций не наблюдалось. Кроме того, при лечении Мабтерой были зарегистрированы другие серьезные вирусные инфекции, как новые, так и реактивированные или обостренные, некоторые из которых имели летальный исход. Большинство пациентов получали Мабтеру в сочетании с ХТ или в рамках трансплантации гематологической стволовой клетки. Примером этих серьезных вирусных инфекций являются инфекции, вызванные вирусами герпеса (цитомегаловирус, вирус ветряной оспы и вирус простого герпеса), вирус Джона Каннингема (прогрессирующая многоочаговая лейкоэнцефалопатия (ПМЛ)) и вирус гепатита С. В клинических исследованиях также были зарегистрированы случаи с ПМЛ с летальным исходом, которые возникали после прогрессирования болезни и повторного лечения. Были зарегистрированы случаи реактивации гепатита В, большинство из которых наблюдалось у пациентов, получавших Мабтеру в сочетании с цитотоксической ХТ. У пациентов с повторным/неподдающимся лечению ХЛЛ, частота инфекции гепатита В 3-4 степени тяжести (реактивация и первичное инфицирование) составляла 2% при режиме R-FC по сравнению с 0% при режиме FC. У пациентов с существующей саркомой Капоши, принимавших препарат, наблюдалось прогрессирование процесса. Эти случаи имели место при неутвержденных показаниях и большинство пациентов были ВИЧ-инфицированы.
Гематологические реакции
В клинических исследованиях при монотерапии Мабтерой, проводимых в течение 4 недель, гематологические отклонения возникали у меньшей части пациентов, обычно имели умеренную степень и были обратимы. Тяжелые случаи нейтропении (степень тяжести 3-4) были зарегистрированы у 4,2%, анемия у 1,1% и тромбоцитопения у 1,7% пациентов. Во время поддерживающего курса Мабтеры, длившегося до 2 лет, лейкопения (5 % по сравнению с 2%, степень тяжести 3/4) и нейтропения (10% по сравнению с 4%, тяжесть 3/4) наблюдались чаще, чем в контрольных группах. Частота тромбоцитопении была очень низкой (<1, степень тяжести 3/4), и не отличались в группах лечения. Во время курса лечения Мабтерой в сочетании с ХТ, лейкопения со степенью 3-4 (R-CHOP 88% по сравнению с CHOP 79%, R-FC 23% по сравнению с FC 12%), нейтропения (R-CVP 24 % по сравнению с CVP 14%; R-CHOP 97 % по сравнению с CHOP 88%, R-FC 30% по сравнению с FC 19% при ранее нелеченом ХЛЛ), панцитопения (R-FC 3% по сравнению с FC 1% при ранее не леченом ХЛЛ) были зарегистрированы с более высокой частотой по сравнению с только ХТ. Тем не менее, высокая частота нейтропении у пациентов с курсом Мабтеры и ХТ не была связана с высокой частотой инфицирования и заражения паразитами по сравнению с пациентами, которые проходили только ХТ. Исследования с участием пациентов с ранее нелеченым и повторным//неподдающимся лечению ХЛЛ показали что у до 25% пациентов, проходивших лечение по режиму R-FC, нейтропения продолжалась (число нейтрофилов оставалось ниже 1×109/л между днем 24 и 42 после последней дозы) или появлялась отсроченно (число нейтрофилов оставалось ниже 1×109/л после 42 дня после последней дозы у пациентов, у которых раньше не было продленной нейропении, или выздоровевших до 42 дней) после лечения Мабтерой + FC. Не было отмечено разницы по частоте анемии. Были отмечены некоторые случаи отсроченной нейтропении, произошедшие по истечении более чем 4 недель после последней инфузии Мабтеры. В исследовании лечения ХЛЛ в первой линии, пациенты со стадией C по классификации Бине испытывали больше побочных явлений в группе R-FC по сравнению с группой FC (R-FC 83% по сравнению с FC 71%). При изучении повторяющегося/неподдающегося лечению ХЛЛ тромбоцитопения тяжестью 3/4 зарегистрирована в 11 % случаев пациентов в группе R-FC по сравнению с 9 % в группе FC.
В исследованиях с участием пациентов с макроглобулинемией Вальденстрема было замечено транзитное увеличение сывороточного уровня IgM после начала лечения, что может быть связно с повышенной вязкостью и сопутствующими симптомами. Повышенный уровень IgM обычно возвращался к нормальному уровню в течение 4 месяцев.
Сердечно-сосудистая система
В клинических исследованиях при монотерапии Мабтерой сердечно-сосудистые реакции, среди которых самыми распространенными были случаи гипотензии и гипертензии, наблюдались у 18,8% пациентов. Во время инфузии наблюдались случаи аритмии 3-4 степени тяжести (включая желудочковую и наджелудочковую тахикардию) и приступы стенокардии. Во время поддерживающего лечения частота нарушений со стороны сердечно-сосудистой системы 3-4 степени тяжести в группе Мабтеры и в контрольной группе была сопоставима. Сердечные события регистрировались как серьезные побочные явления (включая мерцательную аритмию, инфаркт миокарда, левожелудочковую недостаточность, ишемию миокарда) у 3% пациентов, получавших Мабтеру, по сравнению с 1% в контрольной группе. В исследованиях по оценке применения Мабтеры в сочетании с ХТ частота таких событий, как сердечная аритмия 3-4 степени тяжести, преимущественно наджелудочковая аритмия, такая как тахикардия, мерцание предсердий, была выше в группе, получавшей схему R-CHOP (14 пациентов, 6,9%) по сравнению с группой, получавшей схему CHOP (3 пациента, 1,5%). Все эти случаи аритмии были связаны как с применением Мабтеры, так и с предрасполагающими состояниями, такими как лихорадка, инфекции, острый инфаркт миокарда, существовавшие ранее респираторные или сердечно-сосудистые заболевания. Не наблюдалось различия между группами, получавшими схему R-CHOP и CHOP в том, что касалось частоты других сердечных событий со степенью тяжести 3-4, включая сердечную недостаточность, заболевания миокарда и проявления ишемической болезни сердца. При ХЛЛ, общая частота сердечных расстройств со степенью тяжести 3-4 были низкими, как в исследовании терапии первой линии (4% R-FC, 3% FC), так и при изучении состояний с повторяющимся/неподдающимся лечению заболеванием (4% R-FC, 4% FC).
Дыхательная система
Зарегистрированы случаи развития интерстициальной пневмонии, некоторые с летальным исходом.
Нервная система
У 2-х пациентов (2%) из группы R-СНОР c сердечно-сосудистыми факторами риска развились тромбоэмболические нарушения мозгового кровообращения в ходе первого цикла терапии, в отличие от пациентов из группы CHOP, у которых нарушения мозгового кровообращения развились в период наблюдения без лечения. Разница между группами в частоте других тромбоэмболий отсутствовала. У 3-х пациентов в группе CHOP (1,5%) были зарегистрированы нарушения мозгового кровообращения в период последующего наблюдения. Общая частота неврологических нарушений 3 и 4 степени тяжести была низкой как при первой линии терапии (4% в группе R-FC, 4% в группе FC), так и при терапии рецидивирующего/резистентного ХЛЛ (3% в группе R-FC, 3% в группе FC).
Были зарегистрированы случаи развития синдрома обратимой энцефалопатии с поражением задних отделов головного мозга (PRES)/синдрома обратимой лейкоэнцефалопатии с поражением задних отделов головного мозга (PRLS). Симптоматика включала нарушение зрения, головную боль, судороги и психические нарушения, сопровождаемые или нет повышением артериального давления. Подтвердить диагноз PRES/PRLS можно с помощью методов визуализации головного мозга. В описанных случаях пациенты имели факторы риска развития PRES/PRLS, такие как основное заболевание, повышенное артериальное давление, иммуносупрессивная терапия и/или хи-
миотерапия.
Желудочно-кишечный тракт
У пациентов, получавших Мабтеру для лечения НХЛ, наблюдались желудочно-кишечные прободения, в некоторых случаях с летальным исходом. В большинстве этих случаев Мабтера применялась совместно с ХТ.
Уровень иммуноглобулина IgG
В клиническом исследовании по оценке поддерживающей терапии Мабтерой у пациентов с рецидивирующей/резистентной фолликулярной лимфомой, медиана уровней IgG была ниже нижнего предела нормы (НПН) (< 7 г/л) после индукционной терапии, как в группе наблюдения, так и в группе Мабтеры. В группе наблюдения медиана уровня IgG соответственно поднималась выше НПН, но оставалась постоянной в группе Мабтеры. Доля пациентов с уровнем IgG ниже НПН составила около 60 % в группе Мабтеры в течение двухлетнего периода лечения, а в группе наблюдения она упала до 36% после двух лет терапии.
Кожа и ее придатки
Имелись сообщения о редких случаях токсического эпидермального некролиза (синдром Лайелла) и синдрома Стивенса-Джонсона, в ряде случаев с летальным исходом.
Монотерапия у пожилых пациентов (≥ 65 лет)
Частота побочных реакций всех степеней тяжести и реакций со степенью тяжести 3/4 у пожилых и более молодых пациентов (<65 лет) были сопоставимы.
Генерализированная лимфаденопатия (ГЛ)
Среди пациентов с ГЛ частота побочных реакций 3/4 степени тяжести была выше, чем среди пациентов без ГЛ (25,6% по сравнению с 15,4%). Частота развития побочных реакций всех степеней в этих группах была сопоставимой.
Повторная терапия
Частота и степень тяжести нежелательных реакций не отличается от таковых при проведении первоначальной терапии.
Комбинированная терапия у пожилых пациентов (≥ 65 лет)
Частота побочных явлений со стороны кровеносной и лимфатической систем с 3/4 степенью тяжести у пожилых пациентов была выше, чем у более молодых пациентов (<65 лет) с ранее нелеченным, рецидивирующим/резистентным ХЛЛ.
Общий профиль безопасности Мабтеры при ревматоидном артрите основан на данных, полученных в клинических исследованиях и пост-маркетинговых наблюдениях.
Профиль безопасности у пациентов с ревматоидным артритом (РА) средней и тяжелой степени тяжести приведен в разделах ниже. В клинических исследованиях более 3100 пациентов получили как минимум 1 курс терапии и находились под наблюдением от 6 месяцев до 5 лет; приблизительно 2400 пациентов получили 2 или более курсов лечения, около 1000 — 5 или более. Информация о безопасности, полученная в постмаркетинговый период, отражает ожидаемый профиль побочных явлений, наблюдаемый в клинических исследованиях.
Пациенты получали 2 x 1000 мг Мабтеры с интервалом в 2 недели в дополнение к метотрексату (10-25 мг в неделю). Мабтера вводилась после внутривенного инфузии 100 мг метилпреднизона; пациенты также получали преднизон перорально в течение 15 дней.
Побочные реакции перечислены в таблице 2. Частота определена как «Очень часто» (≥1/10), «Часто» (от ≥1/100 до <1/10), «Редко» (от ≥1/1000 до <1/100) и «Очень редко» (<1/10000). В каждой группе нежелательный эффект представлен в порядке снижения тяжести реакции.
Инфузионные реакции были наиболее часто встречавшейся нежелательной реакцией при применении препарата. Общая частота реакций, связанных с инфузией, составляла 23 % при первой инфузии и уменьшалась с последующими инфузиями. Тяжелые инфузионные реакции были редкими (0,5 % пациентов) и в основном наблюдались при первой инфузии. Помимо нежелательных реакций, наблюдаемых в клинических исследованиях с участием пациентов с РА, в постмаркетинговый период были зарегистрированы прогрессирующая многоочаговая лейкоэнцефалопатия (ПМЛ) и сывороточная реакция.
Таблица 2: Побочные реакции на лекарственный препарат, зарегистрированные в клинических исследованиях или в постмаркетинговый период у пациентов с РА, получавших терапию Мабтерой.
|
Системно-органный класс |
Очень часто |
Часто |
Нечасто |
Редко |
Очень редко |
|
Инфекционные и паразитарные заболевания |
Инфекции верхних дыхательных путей, инфекции мочевыводящих путей |
Бронхит, синусит, гастроэнтерит, дерматофития стоп |
ПМЛ, реактивация гепатита B |
||
|
Нарушения со стороны кровеносной/ лимфатической систем |
Нейтропения1 |
Отсроченная нейтропения2 |
Сывороточная реакция |
||
|
Нарушения сердечной деятельности |
Стенокардия, мерцательная аритмия, сердечная недостаточность, инфаркт миокарда |
Трепетание предсердий |
|||
|
Нарушения со стороны иммунной системы |
3 Инфузионные реакции, (гипертензия, тошнота, сыпь, лихорадка, кожный зуд, крапивница, першение в горле, приливы, гипотензия, ринит, напряжение мускулатуры, тахикардия, усталость, боль в ротоглотке, периферический отек, эритема) |
3Реакции, связанные с инфузией (анасарка, бронхоспазм, свистящее дыхание, отек гортани, ангионевротический отек, генерализованный кожный зуд, анафилаксия, анафилактоидная реакция |
|||
|
Общие расстройства и нарушения в месте введения |
|||||
|
Нарушения со стороны обмена веществ и питания |
Гиперхолестеринемия |
||||
|
Нарушения со стороны нервной системы |
Головная боль |
Парестезия, мигрень, головокружение, ишиас |
|||
|
Нарушения со стороны кожи и подкожной клетчатки |
Алопеция |
Токсический эпидермальный некролиз (синдром Лайелла), синдром Стивенса-Джонсона |
|||
|
Психические нарушения |
Депрессия, тревожность |
||||
|
Нарушения со стороны желудочно-кишечного тракта |
Диспепсия, диарея, гастро-эзофагеальный рефлюкс, стоматит, боль в верхней части живота |
||||
|
Нарушения со стороны скелетной мускулатуры |
Артралгия, боли в мышцах и костях, остеоартрит, бурсит |
||||
|
Исследования |
Снижение IgM4 |
Снижение уровня IgG4 |
|||
|
1 расчет частотности основывался на лабораторных данных собранных в рамках текущего лабораторного мониторинга в клинических исследованиях 2 расчет частотности основывался на данных постмаркетинговых наблюдений 3 реакции, развившиеся во время инфузии или в течение 24 часов после инфузии. См. также Реакции, связанные с инфузией ниже. Реакции, связанные с инфузией, могут возникать вследствии гиперчувствительности и/или механизма действия. 4 включая наблюдения, собранные в рамках текущего лабораторного мониторинга 5 включая летальный исход |
Повторные курсы
При повторных курсах терапии профиль нежелательных явлений такой же, как и при первом. Частота развития нежелательных явлений после первой инфузии Мабтеры была наиболее высокой в течение первых 6 месяцев и затем уменьшалась. При этом наиболее частыми во время первого курса лечения были инфузионные реакции, обострение РА и инфекции, которые чаще встречались в течение первых 6 месяцев лечения.
Инфузионные реакции
В клинических исследованиях наиболее частыми нежелательными явлениями были реакции, связанные с инфузией (см. таблицу 2). Из 3189 пациентов, 1135 (36%) испытывали хотя бы одну инфузионную реакцию и у 733 (23%) пациентов развивалась инфузионная реакция после первой инфузии. Проявление реакций, связанных с инфузией, снижалось при каждой последующей инфузии. Менее 1% (17 из 3189) пациентов испытывали серьезную инфузионную реакцию. В клинических исследованиях не было зарегистрировано ни инфузионных реакций 4 степени тяжести согласно Общей терминологии критериев побочных реакций (CTC), а также ни одного летального исхода, связанного с инфузионными реакциями. Доля инфузионных реакций 3 степени тяжести согласно CTC и инфузионных реакций, приводящих к отмене лечения, уменьшалась с каждым курсом, и к 3 курсу такие явления были редкими. Внутривенная премедикация глюкокортикоидами значительно снижала частоту и тяжесть реакций. В постмаркетинговых наблюдениях были зарегистрированы тяжелые реакции, связанные с инфузией, с летальным исходом.
В клиническом исследовании по оценке безопасности проведения ускоренной инфузии у пациентов с РА, а также с РА умеренной и тяжелой степени тяжести в активной фазе, при отсутствии тяжелых реакций во время первой ускоренной инфузии или в течение 48 часов после инфузии, последующая инфузия проводилась в течение 2-х часов. В исследование не были включены пациенты, у которых наблюдалась тяжелая инфузионная реакция во время первого курса биологической терапии. Частота, вид и тяжесть инфузионных реакций была сопоставима с теми, что наблюдались ранее при применении препарата. Серьезных инфузионных реакций не зарегистрировано.
Инфекции
Общая частота инфекций составила приблизительно 94 на 100 пациенто-лет среди пациентов, принимавших Мабтеру. Инфекции преимущественно были легкой и умеренной степени тяжести (наиболее часто — инфекции верхних дыхательных путей и мочевыводящих путей). Частота серьезных инфекций, а также требовавших внутривенного введения антибиотиков, составила 4 на 100 пациенто-лет. Уровень серьезных инфекций не демонстрировал какого-либо значимого подъема после многократных курсов Мабтеры. В клинических исследованиях были зарегистрированы инфекции нижних дыхательных путей (включая пневмонию), с сопоставимой частотой в группе Мабтеры и в группе контроля.
В ходе лечения пациентов с аутоиммунными заболеваниями (ревматоидный артрит и аутоиммунные заболевания, при которых применение Мабтеры не показано (системная красная волчанка и васкулит) были зарегистрированы случаи прогрессирующей многоочаговой лейкоэнцефалопатии с летальным исходом.
У пациентов с НХЛ, получавших Мабтеру в сочетании с цитотоксической ХТ, были зарегистрированы случаи реактивации гепатита В. Среди пациентов с РА реактивация гепатита В отмечалась очень редко.
Сердечно-сосудистые реакции
Серьезные сердечные события были зарегистрированы с частотой 1,3 на 100 пациенто-лет среди пациентов, получавших Мабтеру по сравнению с 1,3 на 100 пациенто-лет среди пациентов, принимавших плацебо. Доли пациентов, перенесших кардиологические события (любой степени или серьезные) не увеличивались в последующих курсах терапии.
Неврологические нарушения
Были зарегистрированы случаи развития синдрома обратимой энцефалопатии с поражением задних отделов головного мозга (PRES)/синдрома обратимой лейкоэнцефалопатии с поражением задних отделов головного мозга (PRLS). Симптоматика включала нарушение зрения, головную боль, судороги и психические нарушения, сопровождаемые или нет повышением артериального давления. Подтвердить диагноз PRES/PRLS можно с помощью методов визуализации головного мозга. В описанных случаях пациенты имели факторы риска развития PRES/PRLS, такие как основное заболевание, повышенное артериальное давление, иммуносупрессивная терапия и/или хи-
миотерапия.
Нейтропения
Зарегистрированы случаи развития нейтропении, большинство из которых имели транзиторный характер, а по степени тяжести были умеренными и легкими. Нейтропения может развиваться через несколько месяцев после приема Мабтеры.
В плацебо-контролируемый период клинических исследований у 0,94% (13 из 1382) пациентов, получавших Мабтеру и 0,27% (2 из 731), принимавших плацебо, развивалась тяжелая нейтропения.
Случаи нейтропении, включая тяжелую позднюю форму и стойкую форму, редко отмечались в постмаркетинговый период. Некоторые из них были связаны с летальным исходом.
Лабораторные показатели
У пациентов с РА наблюдалась гипогаммаглобулинемия (снижение концентрации иммуноглобулинов IgG и IgM ниже нижней границы нормы), не сопровождающаяся увеличением общей частоты инфекций или частоты серьезных инфекций.
Имеются спонтанные сообщения, а также случаи, описанные в литературе, о развитии гипогаммаглобулинемии у детей на фоне приема Мабтеры, в некоторых случаях тяжелой и требующей заместительной терапии иммуноглобулинами. Последствия длительного В-клеточного истощения у детей неизвестны.
Опыт применения препарата при гранулематозе с полиангиитом (гранулематозе Вегенера) и микроскопическом полиангиите
В клинических исследованиях 99 пациентов с гранулематозом с полиангиитом и микроскопическим полиангиитом получали глюкокортикоиды и Мабтеру в дозе 375 мг/м2 в неделю на протяжении 4-х недель.
Таблица 3: Наиболее частые, чем в группе сравнения побочные реакции, зарегистрированные в основном клиническом исследовании в течение 6 месяцев у ≥ 5 % пациентов, получавших терапию Мабтерой
|
Системно-органный класс Нежелательное явление |
Мабтера (n=99) |
|
Нарушения со стороны кровеносной и лимфатической систем |
|
|
Тромбоцитопения |
7 % |
|
Нарушения со стороны желудочно-кишечного тракта |
|
|
Диарея |
18 % |
|
Диспепсия |
6 % |
|
Запор |
5 % |
|
Общие расстройства и нарушения в месте введения |
|
|
Периферический отек |
16 % |
|
Нарушения со стороны иммунной системы |
|
|
Синдром выброса цитокинов |
5 % |
|
Инфекционные и паразитарные заболевания |
|
|
Инфекции мочевыводящей системы |
7 % |
|
Бронхит |
5 % |
|
Herpes zoster |
5 % |
|
Назофарингит |
5 % |
|
Исследования |
|
|
Снижение уровня гемоглобина |
6 % |
|
Нарушения со стороны обмена веществ и питания |
|
|
Гиперкалиемия |
5 % |
|
Нарушения со стороны скелетно-мышечной и соединительной ткани |
|
|
Мышечный спазм |
18 % |
|
Артралгия |
15 % |
|
Боль в спине |
10 % |
|
Мышечная слабость |
5 % |
|
Мышечные боли |
5 % |
|
Боли в конечностях |
5 % |
|
Нарушения со стороны нервной системы |
|
|
Головокружение |
10 % |
|
Тремор |
10 % |
|
Психические нарушения |
|
|
Бессонница |
14 % |
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
|
|
Кашель |
12 % |
|
Одышка |
11 % |
|
Носовое кровотечение |
11 % |
|
Заложенность носа |
6 % |
|
Нарушения со стороны кожи и подкожной клетчатки |
|
|
Акне |
7 % |
|
Сосудистые нарушения |
|
|
Гипертензия |
12 % |
|
Приливы |
5 % |
Инфузионные реакции
Все инфузионные реакции, наблюдавшиеся во время введения Мабтеры или в течение 24 ч после нее, были 1 и 2 степени тяжести. Наиболее часто наблюдались синдром высвобождения цитокинов, покраснение, раздражение горла и тремор. Применение препарата Мабтера в комбинации с внутривенными глюкокортикостероидами могло уменьшить частоту и тяжесть описанных нежелательных явлений.
Инфекции
Общая частота инфекций при применении препарата Мабтера составила 237 на 100 пациенто-лет (CI 95% 197-285). Инфекции были преимущественно легкой или средней степени тяжести и чаще всего включали инфекции верхних дыхательных путей, инфекции мочевыводящих путей и опоясывающий герпес. Частота серьезных инфекций при применении препарата Мабтера составила 25 на 100 пациенто-лет. Среди серьезных инфекций при применении препарата Мабтера наиболее часто сообщалось о пневмонии (4%).
Злокачественные новообразования
Частота злокачественных заболеваний после назначения препарата Мабтера не превышает показатели в популяции, соответствующей по возрасту и полу, и составляет 2 на 100 пациенто-лет.
Сердечно-сосудистые реакции
Частота сердечных событий составляет 273 на 100 пациенто-лет (CI 95% 149-470). Уровень серьезных сердечных событий составляет 2.1 на 100 пациенто-лет (CI 95% 3-15). Наиболее часто наблюдалась тахикардия (4%) и мерцательная аритмия (3%).
Неврологические нарушения
На фоне аутоиммунных нарушений были зарегистрированы случаи развития синдрома обратимой энцефалопатии с поражением задних отделов головного мозга (PRES)/синдрома обратимой лейкоэнцефалопатии с поражением задних отделов головного мозга (PRLS). Симптоматика включала нарушение зрения, головную боль, судороги и психические нарушения, сопровождаемые или нет повышением артериального давления. Подтвердить диагноз PRES/PRLS можно с помощью методов визуализации головного мозга. В описанных случаях пациенты имели факторы риска развития PRES/PRLS, такие как основное заболевание, повышенное артериальное давление, иммуносупрессивная терапия и/или химиотерапия.
Реактивация гепатита В
В постмаркетинговый период сообщалось об очень редких случаях реактивации гепатита В у пациентов с гранулематозом с полиангиитом и микроскопическим полиангиитом, в некоторых случаях с летальным исходом,
Гипогаммаглобулинемия
У пациентов с гранулематозом с полиангиитом и микроскопическим полиангиитом наблюдалась гипогаммаглобулинемия (снижение концентрации иммуноглобулинов IgА, IgG и IgM ниже нижней границы нормы), не сопровождающаяся увеличением общей частоты инфекций или частоты серьезных инфекций. В 6-тимесячном контролируемом рандомизированном двойном слепом многоцентровом неинтервенционном исследовании у 27%, 58% и 51% пациентов в группе Мабтеры наблюдалось снижение уровней иммуноглобулинов IgА, IgG и IgM по сравнению с таковым у 25%, 50% и 46% пациентов в группе циклофосфамида.
Нейтропения
В контролируемом рандомизированном двойном слепом многоцентровом неинтервенционном исследовании у 24% пациентов с гранулематозом с полиангиитом и микроскопическим полиангиитом в группе Мабтеры (единичный курс) и у 23% пациентов в группе циклофосфамида развивалась нейтропения 3 степени тяжести и выше. Нейтропения не была связана с наблюдавшимся увеличением случаев развития тяжелых инфекций. Влияние многократных курсов терапии Мабтерой на развитие нейтропении у пациентов с гранулематозом с полиангиитом и микроскопическим полиангиитом не изучалось.
Кожа и ее придатки
Имелись сообщения об очень редких случаях токсического эпидермального некролиза (синдром Лайелла) и синдрома Стивенса-Джонсона, в ряде случаев с летальным исходом.
Противопоказания
-
гиперчувствительность к активному веществу или любому другому компоненту препарата, а также к протеинам мышиного происхождения
-
наличие острых инфекционных процессов
-
пациенты с ослабленным иммунитетом
-
тяжелая сердечная недостаточность (класс IV по NYHA) или тяжелые неконтролируемые заболевания сердца на фоне ревматоидного артрита, гранулематоза с полиангиитом и микроскопического полиангиита
Лекарственные взаимодействия
В настоящее время данные о лекарственных взаимодействиях Мабтеры ограничены.
У пациентов с ХЛЛ совместное применение Мабтеры не оказывает влияния на фармакокинетику флударабина или циклофосфамида. Кроме того, флударабин и циклофосфамид не оказывают значимого влияния на фармакокинетику Мабтеры.
Одновременный прием метотрексата не влияет на фармакокинетику Мабтеры у пациентов с ревматоидным артритом.
При назначении с другими моноклональными антителами с диагностической или лечебной целью у пациентов, имеющих антитела против белков мыши или антихимерные антитела, могут развиться аллергические реакции или реакции гиперчувствительности.
У пациентов с ревматоидным артритом частота серьезных инфекций во время терапии препаратом Мабтера (до терапии другими биологическими базисными противовоспалительными препаратами (БПВП)) составляет 6.01 на 100 пациенто-лет, в то время как во время последующей терапии другими БПВП – 4.97 на 100 пациенто-лет.
Особые указания
В медицинской документации пациента следует указывать торговое наименование препарата (Мабтера). Замена препарата на какой-либо другой биологический лекарственный препарат требует согласования с лечащим врачом. Информация, представленная в данной инструкции, относится только к препарату Мабтера.
Прогрессирующая многоочаговая лейкоэнцефалопатия (ПМЛ)
Пациенты должны быть предупреждены о риске развития инфекции, включая ПМЛ, на фоне приема Мабтеры.
Имеются очень редкие сообщения о единичных случаях ПМЛ с летальным исходом после применения Мабтеры. Необходимо регулярно наблюдать пациентов на предмет появления новых нежелательных явлений или усугубления имеющихся неврологических симптомов, которые могут являться признаками ПМЛ. При подозрении на развитие ПМЛ необходимо приостановить введение препарата до полного исключения ПМЛ. Лечащий врач должен оценить связь симптомов с неврологическими нарушениями, и если таковые наблюдаются, их принадлежность к ПМЛ. Следует рассмотреть необходимость консультации невропатолога.
В случае какого-либо сомнения следует рассмотреть необходимость дальнейшего исследования, включая сканирование с помощью магнитной резонансной томографии (предпочтительно с контрастом), обследование спинномозговой жидкости на наличие вирусной ДНК (вирус Джона Каннингема) и повторную неврологическую оценку.
Лечащий врач должен особенно внимательно следить за симптомами, характерными для ПМЛ, поскольку пациент не всегда в состоянии заметить некоторые симптомы (когнитивные, неврологические, психические). Пациенту следует предупредить близких или ухаживающих лиц о своем лечении, поскольку они могут заметить симптомы, которые сам он не всегда способен отслеживать самостоятельно.
При развитии ПМЛ введение препарата должно быть окончательно прекращено.
После восстановления иммунитета у ослабленных пациентов с ПМЛ наблюдались случаи стабилизации или улучшения исхода. Остается неизвестным, может ли ранее обнаружение ПМЛ и прекращение лечение Мабтерой привести к стабилизации или улучшению исхода болезни.
Неходжкинская лимфома и хронический лимфолейкоз
Инфузионные реакции.
Инфузионные реакции, развивающиеся при введении Мабтеры могут быть связаны с синдромом высвобождения цитокинов и/или других медиаторов. Клинические проявления синдрома высвобождения цитокинов могут быть очень схожи с острыми реакциями гиперчувствительности.
Совокупность реакций, включающих синдром высвобождения цитокинов, синдром лизиса опухоли, анафилактическую реакцию и реакцию гиперчувствительности, описана ниже.
В постмаркетинговый период были описаны случаи развития тяжелых инфузионных реакций с летальным исходом, развивавшиеся через 30 минут — 2 часа после первой инфузии. Случаи характеризовались симптомами со стороны дыхательной системы и, в ряде случаев, кроме лихорадки, озноба, гипотензии, крапивницы, ангионевротического отека и других симптомов, включали быстрый лизис опухоли и признаки синдрома лизиса опухоли.
Тяжелый синдром высвобождения цитокинов характеризуется затруднением дыхания, часто сопровождающимся бронхоспазмами и гипоксией в сочетании с ознобом, лихорадкой, дрожью, крапивницей и ангионевротическим отеком. Данный синдром может быть связан с некоторыми симптомами синдрома лизиса опухоли, такими как гиперурикемия, гиперкалиемия, гипокальциемия, гиперфосфатемия, острая почечная недостаточность, повышенный уровень лактатдегидрогеназы (ЛДГ), и может вызывать острую дыхательную недостаточность и смерть. Острая дыхательная недостаточность может сопровождаться интерстициальным отеком или интерстициальной болезнью легких, визуализируемых при рентгенографии органов грудной клетки. Синдром нередко развивается в течение одного или двух часов после первой инфузии. Пациенты с легочной недостаточностью или опухолевым процессом в легких подвергаются высокому риску отрицательного исхода и нуждаются в более тщательном наблюдении.
При проявлении синдрома высвобождения цитокинов следует незамедлительно прекратить введение препарата и назначить интенсивную симптоматическую терапию. Поскольку первичное сглаживание клинических симптомов может сменяться ухудшением состояния, такие пациенты должны находиться под строгим наблюдением до исключения синдрома лизиса опухоли и легочной инфильтрации. Последующее лечение пациентов после полного исчезновения признаков и симптомов редко вызывает повторный острый синдром высвобождения цитокинов.
Пациенты с интенсивно развивающейся опухолью или с высоким числом циркулирующих злокачественных клеток (≥25 x 109/л), такие как пациенты с ХЛЛ, находятся в группе высокого риска развития тяжелого синдрома высвобождения цитокинов, и поэтому их лечение следует проводить с особой осторожностью. При первой инфузии за такими пациентами следует вести тщательное наблюдение. Следует рассмотреть решение о снижении скорости первой инфузии или ее делении на 2 дозы в течение 2 дней во время первого цикла и всех последующих циклов, если число лимфоцитов остается >25 x 109/л.
Побочные инфузионные реакции всех видов (включая синдром высвобождения цитокинов, сопровождающийся гипотонией и бронхоспазмом у 10% пациентов) наблюдались у 77% пациентов. Эти симптомы обычно обратимы в случае прекращения введения препарата и применения жаропонижающих, антигистаминных средств, и, в ряде случаев, кислорода, физиологического раствора внутривенно и, при наличии показаний, глюкокортикоидов.
После внутривенного введения белковых препаратов у пациентов наблюдались анафилаксия и другие реакции гиперчувствительности. В отличие от синдрома высвобождения цитокинов, истинные реакции гиперчувствительности, как правило, наблюдаются в течение нескольких минут после начала инфузии. При проведении инфузии препарата Мабтера необходимо иметь под рукой все необходимые препараты для купирования реакций повышенной чувствительности (эпинефрин (адреналин), антигистаминные препараты, глюкокортикоиды). Клиническое проявление анафилаксии может быть сходным с клиническим проявлением синдрома высвобождения цитокинов, описанным выше. Реакции, вызванные гиперчувствительностью, наблюдаются реже, чем реакции, связанные с синдромом высвобождения цитокинов.
Также среди других реакций наблюдались: инфаркт миокарда, мерцательная аритмия, отек легких, острая обратимая тромбоцитопения.
Поскольку при введении Мабтеры может развиваться гипотония, следует рассмотреть возможность приема антигипертензивного препарата не позднее чем за 12 часов до инфузии.
Кардиологические расстройства
У пациентов во время лечения наблюдались стенокардия, сердечные аритмии, (трепетание и фибрилляция предсердий), сердечная недостаточность и/или инфаркт миокарда,. Поэтому пациенты с патологией сердечно-сосудистой системы и/или проходившие кардиотоксическую ХТ, должны находиться под тщательным наблюдением.
Гематологическая токсичность
Несмотря на то, что миелосупрессия для Мабтеры в монотерапии нехарактерна, особую осторожность следует проявлять при лечении пациентов с числом нейтрофилов в крови <1,5 x 109/л и/или с количеством тромбоцитов <75 x 109/л, поскольку клинический опыт лечения таких пациентов ограничен.
Во время терапии следует регулярно проводить развернутый анализ крови с подсчетом числа нейтрофилов и тромбоцитов.
Инфекции
Во время лечения Мабтерой могут развиваться серьезные инфекции, в том числе с летальным исходом. Препарат не должен вводиться пациентам с острыми и тяжелыми инфекциями (например, туберкулез, сепсис, оппортунистические инфекции).
Следует проявлять осторожность при назначении Мабтеры пациентам с повторными или хроническими инфекционными процессами в анамнезе или пациентам с патологией, которая может спровоцировать развитие у пациента тяжелого инфекционного процесса.
При применении Мабтеры наблюдались случаи реактивации гепатита В, включая его фульминантную форму с летальным исходом. Большинство таких пациентов проходило также цитотоксическую ХТ. Ограниченные данные одного исследования с участием пациентов с повторным/неподдающимся терапии ХЛЛ позволяют предположить, что лечение Мабтерой может ухудшить исход первичной инфекции гепатита В. Перед назначением Мабтеры все пациенты с риском инфицирования вирусом гепатита В (ВГВ) должны проходить скрининг на ВГВ. В исследование, как минимум, должны быть включены маркеры HBsAg и HBcAb. Также могут быть включены другие маркеры согласно локальным руководствам. Пациентам с гепатитом в активной фазе не следует проводить инфузию Мабтеры. Пациенты с положительным результатом серологического исследования при гепатите B (HBsAg или HBcAb) перед началом лечения должны быть проконсультированы гепатологом, а также должны иметь уход и наблюдение согласно местным медицинским стандартам для предотвращения реактивации гепатита B.
Зарегистрированы очень редкие случаи прогрессирующей многоочаговой лейкоэнцефалопатии (ПМЛ) после применения Мабтеры при НХЛ и ХЛЛ. Большинство пациентов получали Мабтеру в сочетании с ХТ или с иммунносупрессивной терапией.
Иммунизация
Безопасность и эффективность иммунизации живыми вирусными вакцинами после лечения препаратом Мабтера не изучалась. Вакцинация живыми вирусными вакцинами не рекомендуется. Возможна вакцинация инактивированными вакцинами, однако частота ответа может снижаться. В нерандомизированном исследовании у пациентов с рецидивирующей НХЛ низкой степени злокачественности при монотерапии Мабтерой наблюдалось снижение частоты ответа на введение столбнячного анатоксина и КНL-неоантигена (КНL-гемоцианин моллюска фиссурелии) по сравнению со здоровыми пациентами, не получавшими препарат Мабтера (16% против 81% и 4% против 76% (критерий оценки – более чем 2х-кратное повышение титра антител), соответственно). У пациентов с ХЛЛ предполагается аналогичный результат ввиду сходства этих двух заболеваний, однако специальных клинических исследований не проводилось.
Среднее значение титра антител к набору антигенов (Streptococcus pneumoniae, influenza А, паротит, краснуха, ветряная оспа) не изменялась как минимум в течение 6 месяцев после терапии препаратом Мабтера (при сравнении с титром антител до лечения).
Кожные реакции
Зарегистрированы случаи развития таких тяжелых кожных реакций как токсический эпидермальный некролиз и синдром Стивенса-Джонсона, в ряде случаев с фатальным исходом. При выявлении данных реакций препарат Мабтера следует отменить.
Ревматоидный артрит, гранулематоз с полиангиитом и микроскопический полиангиит
Пациенты с ревматоидным артритом, ранее не получавшие метотрексат
В связи с отсутствием данных о благоприятном соотношении польза/риск препарат не рекомендуется назначать пациентам, ранее не получавшим метотрексат.
Реакции, связанные с инфузией
Развитие инфузионных реакций может быть обусловлено высвобождением цитокинов и/или других медиаторов. Перед каждой инфузией препарата Маб-
тера необходимо проводить премедикацию анальгетиком/антипиретиком и антигистаминным препаратом. Кроме того, перед каждой инфузией препарата Мабтера пациенты с ревматоидным артритом должны получать премедикацию глюкокортикостероидами для уменьшения частоты и тяжести инфузионных реакций.
В постмаркетинговый период были зарегистрированы тяжелые инфузионные реакции с фатальным исходом. В большинстве случаев инфузионные реакции у больных с ревматоидным артритом, были легкой или средней степени тяжести. Наиболее часто наблюдались аллергические реакции в виде головной боли, зуда, ощущения першения в горле, приливов, сыпи, крапивницы, повышения артериального давления и лихорадки. Инфузионные реакции чаще наблюдались после первой инфузии любого курса лечения, чем после второй инфузии. Частота развития инфузионных реакций уменьшается с последующими курсами терапии. Наблюдавшиеся инфузионные реакции обычно были обратимыми после замедления или прерывания инфузии и медикаментозной терапии антипиретическими, антигистаминными средствами и иногда кислородом, внутривенного введения физиологического раствора натрия хлорида, бронходилататоров и при необходимости глюкокортикостероидов. Необходимо тщательно наблюдать пациентов с ранее выявленными заболеваниями сердечно-сосудистой системы, а также тех, у кого ранее отмечались нежелательные реакции со стороны сердца и легких. В зависимости от тяжести инфузионных реакций и необходимого лечения, введение препарата следует временно приостановить или отменить. В большинстве случаев после полного исчезновения симптоматики инфузию можно возобновить со скоростью, составляющей 50% от предшествовавшей (например, 50 мг/ч вместо 100 мг/ч).
Во время проведения инфузии в свободном доступе необходимо иметь медицинские препараты на случай развития реакций гиперчувствительности (эпинефрин (адреналин), антигистаминные средства и глюкокортикоиды).
Данные о безопасности применения препарата у пациентов с умеренной сердечной недостаточностью (класс III по классификации NYHA) или с тяжелыми неконтролируемыми сердечно-сосудистыми заболеваниями отсутствуют. У определенной доли пациентов, получавших Мабтеру, наблюдались клинические проявления существующей ишемии, а также трепетание и фибрилляция предсердий. Поэтому перед началом лечения для пациентов с сердечной патологией в анамнезе, а также для пациентов, перенесших нежелательные реакции со стороны сердечно-легочной системы, следует учитывать риск сердечно-сосудистых осложнений и вести за ними тщательное наблюдение во время инфузии.
Из-за возможности развития гипотензии не менее чем за 12 ч до инфузии препарата Мабтера следует отменить антигипертензивные лекарственные средства.
Во время клинических исследований частота развития инфузионных реакций у пациентов с гранулематозом с полиангиитом и микроскопическим полиангиитом была аналогична таковой у пациентов с ревматоидным артритом.
Кардиологические расстройства
У пациентов наблюдались стенокардия, сердечные аритмии (трепетание и фибрилляция предсердий), сердечная недостаточность и/или инфаркт миокарда. В этой связи пациенты с наличием в анамнезе заболеваний сердечно-сосудистой системы должны находиться под тщательным наблюдением.
Инфекции
Учитывая механизм действия препарата Мабтера и важность В-клеток в поддержании нормального иммунного ответа, пациенты подвергаются повышенному риску развития инфекционных процессов. В период лечения возможно развитие тяжелых инфекций, в том числе с летальным исходом. Препарат не следует назначать пациентам с имеющимися острыми и тяжелыми инфекционными процессами (например, туберкулез, сепсис, оппортунистические инфекции) или пациентам с тяжелыми нарушениями иммунитета (с низким уровнем CD4 и CD8). Следует проявлять осторожность при назначении препарата пациентам с рецидивирующими или хроническими инфекционными заболеваниями в анамнезе или пациентам с патологиями, которые могут спровоцировать развитие у пациента серьезной инфекции, такими, как гипогаммаглобулинемия. Перед началом лечения рекомендуется определить уровень иммуноглобулина.
Пациентов с признаками и симптомами инфекционных осложнений, необходимо незамедлительно обследовать и назначить соответствующее лечение. Перед назначением повторного курса препарата Мабтера пациенты должны быть обследованы с целью исключения риска инфицирования.
Зарегистрированы очень редкие случаи прогрессирующей многоочаговой лейкоэнцефалопатии (ПМЛ) после применения Мабтеры у пациентов с ревматоидным артритом и аутоиммунными заболеваниями, включая системную красную волчанку и васкулит.
Гепатит В
У пациентов с ревматоидным артритом, гранулематозом с полиангиитом и микроскопическим полиангиитом, получавших лечение препаратом Мабтера были зарегистрированы случаи реактивации гепатита В, включая летальные. Перед назначением препарата всем пациентам следует пройти скрининг на гепатит B. Минимальный набор тестов должен включать определение HBsAg и HBсAb, в соответствии с локальными рекомендациями перечень тестов может быть дополнен. Препарат Мабтера не следует применять у пациентов с активным гепатитом В. Пациентам с положительными серологическими маркерами гепатита В следует проконсультироваться с врачом-гепатологом перед применением препарата Мабтера; в отношении таких пациентов необходимо проводить соответствующий мониторинг и принимать меры по профилактике реактивации вируса гепатита В в соответствии с локальными стандартами.
Отсроченная нейтропения
Необходимо определять абсолютное число нейтрофилов в крови перед каждым курсом Мабтеры, а также регулярно в течение периода в 6 месяцев после прекращения лечения и при появлении признаков развития инфекционных осложнений.
Кожные реакции
Зарегистрированы случаи развития таких тяжелых кожных реакций как токсический эпидермальный некролиз и синдром Стивенса-Джонсона, в ряде случаев с фатальным исходом. При выявлении данных реакций препарат следует отменить.
Иммунизация
Перед применением препарата следует изучить вакцинальный статус пациента и действовать согласно соответствующим рекомендациям по вакцинации. Вакцинацию следует завершить не менее чем за 4 недели до назначения терапии препаратом Мабтера.
Безопасность и эффективность иммунизации живыми вирусными вакцинами после лечения препаратом Мабтера не изучалась. Вакцинация живыми вирусными вакцинами во время лечения или при снижении количества периферических В клеток не рекомендуется.
Возможна вакцинация инактивированными вакцинами, однако частота ответа может снижаться. Через 6 месяцев терапии Мабтерой и метотрексатом наблюдалось снижение частоты ответа на введение полисахаридной пневмококковой вакцины (43% против 82%, как минимум 2 серотипа антител к пневмококку), КНL-неоантигена (КНL – гемоцианин моллюска фиссурелии) (47% против 93%) по сравнению с монотерапией метотрексатом. После терапии препаратом Мабтера и метотрексатом частота ответа на введение столбнячного анатоксина была сходной с таковой после монотерапии метотрексатом (39% против 42%). В случае необходимости вакцинация инактивированными вакцинами должна быть завершена не менее чем за 4 недели до повторного курса терапии.
Количество пациентов с ревматоидным артритом и положительным титром антител к Streptococcus pneumonia, influenza A, паротиту, краснухе, ветряной оспе и столбнячному токсину до и через 1 год после начала терапии препаратом Мабтера не изменялось.
Комбинированная терапия / Последующее назначение других базисных препаратов для лечения ревматоидного артрита (DMARD)
Комбинированная терапия препаратом Мабтера и другими противоревматическими препаратами, не имеющими показаний для применения при ревматоидном артрите, не рекомендуется.
Данные клинических испытаний для полной оценки безопасности последующего применения других DMARD препаратов (включая препараты, блокирующие фактор некроза опухоли TNF и другие биологические препараты) после терапии препаратом Мабтера, ограничены. Имеющиеся данные свидетельствуют о том, что уровень инфекционных осложнений остается неизменным при назначении DMARD-терапии пациентам, получавшим Мабтеру. Тем не менее пациенты требуют тщательного наблюдения на наличие признаков инфекций, если после терапии Мабтерой назначается биологическая терапия и/или DMARD.
Малигнизация
Иммуномодулирующие препараты могут увеличивать риск малигнизации. Имеющиеся данные, полученные на основании ограниченного опыта применения Мабтеры у пациентов с ревматоидным артритом, позволяют предположить отсутствие повышенного риска малигнизации. Тем не менее, на данный момент возможный риск развития солидных опухолей не может быть исключен.
Беременность и грудное вскармливание
Иммуноглобулины класса IgG проходят через плацентарный барьер. Описаны случаи истощения пула В-клеток и лимфоцитопении у новорожденных, чьи матери во время беременности получали Мабтеру. Поэтому Мабтеру не следует назначать беременным женщинам, если только возможные преимущества терапии не превышают потенциальный риск. Во время лечения и в течение 12 месяцев после окончания лечения Мабтерой женщины детородного возраста и мужчины должны использовать эффективные методы контрацепции.
Неизвестно, выделяется ли ритуксимаб с грудным молоком. Однако с учетом того, что иммуноглобулины класса IgG, циркулирующие в крови матери, проникают в грудное молоко, Мабтеру не следует назначать кормящим матерям.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
Исследования по влиянию Мабтеры на возможность управления автомобилем и потенциально опасными механизмами не проводились, фармакологическая активность и собранные отчеты о побочных эффектах до настоящего времени не указывают на возможность такого эффекта. Следует учитывать возможность развития побочных реакций при занятии данными видами деятельности.
Передозировка
Симптомы неизвестны. Однако при введении дозы, превышающей терапевтическую, надо немедленно прекратить или замедлить инфузию препарата и организовать тщательное наблюдение за состоянием больного. В последующем необходимо наблюдать за клеточным составом крови и учитывать риск возникновения инфекционных заболеваний из-за возможного снижения количества В-лимфоцитов.
Форма выпуска и упаковка
По 100 мг/10 мл или 500 мг/50 мл препарата в стеклянный флакон (стекло гидролитического типа 1 ЕФ), укупоренный пробкой из бутилкаучука, ламинированного фторполимером, обжатый алюминиевым колпачком и закрытый пластмассовой крышкой.
2 флакона по 100 мг/10 мл или 1 флакон 500 мг/50 мл вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в картонную пачку.
Условия хранения
Хранить в оригинальной упаковке при температуре от 2 °С до 8 °С.
Хранить в недоступном для детей месте!
Срок хранения
2,5 года
Не применять по истечении срока годности, указанного на упаковке
Условия отпуска из аптек
По рецепту
Производитель
Рош Диагностикс ГмбХ, Германия
Sandhofer Strasse 116, D-68305 Mannheim, Germany
Упаковщик
ОАО «Фармстандарт-УфаВИТА», Россия
Владелец регистрационного удостоверения
Ф. Хоффманн-Ля Рош Лтд., Швейцария
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству товара:
ТОО «Рош Казахстан»
050000, г. Алматы, ул. Кунаева, 77
Бизнес-центр «Park View Office Tower», 15 этаж
Тел.: + 7 (727) 321 24 24
Факс: + 7 (727) 321 24 25
e-mail: kz.safety@roche.com, kz.quality@roche.com
EU SmPC
May 2014
| 833335901477976503_ru.doc | 279 кб |
| 822132061477977664_kz.doc | 328.5 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
Программа лечения Врачи Цены Отзывы
Содержание
- Описание хондропротекторов
- Механизм действия препаратов
- Показания к применению
- Помогут ли хондропротекторы при грыже
- Виды хондропротекторов
- По главному активному компоненту
- Хондропротекторы природного происхождения
- На основе хондроитина
- На основе глюкозамина
- На основе гиалуроновой кислоты
- Препараты 1-го, 2-го и 3-го поколения
- По форме выпуска
- По главному активному компоненту
- Самые эффективные хондропротекторы
- Таблетки и капсулы
- Пиаскледин
- Формула-С
- Артра
- Дона, Глюкозамин и Сустилак
- Структум
- Терафлекс
- Раствор для употребления внутрь
- Инъекции
- Мукосат
- Алфлутоп
- Хондроитин сульфат
- Эльбона
- Заменители внутрисуставной жидкости
- Ферматрон
- Синокром
- Остенил
- Синвиск
- Таблетки и капсулы
- Рекомендации пациентам
- Противопоказания
- Частые вопросы
Врачи назначают хондропротекторы для позвоночника при грыже, чтобы восстановить фиброзно-хрящевую ткань межпозвонковых дисков. Препараты содержат вещества, которые улучшают метаболизм хондроцитов, задерживают разрастание костных наростов, тормозят сужение щели между суставами. Это позволяет позвоночному столбу оставаться гибким, подвижным, справляться с нагрузкой, предотвратить появление грыжи. В этой статье мы расскажем, какие хондропротекторы лучше других помогают при грыже позвоночника.
Описание хондропротекторов
Хондропротекторы – это препараты, содержащие вещества, из которых состоит сустав (гиалуроновая кислота, коллаген, глюкозамин, хондроитин). Их назначают в профилактических и лечебных целях, чтобы:
- Улучшить синтез макромолекул хрящевых клеток, коллагена, гликопротеинов.
- Обеспечить синтез гиалуроновой кислоты, которая делает синовиальную жидкость вязкой, улучшая ее смазывающие и амортизирующие свойства. Тем самым она обеспечивает нормальное, безболезненное движение сочленений.
- Подавить действие ферментов, разрушающие клетки хряща.
- Растворить фибрины, липиды, тромбы, которые застряли в кровеносных сосудах в зоне позвонков.
- Снизить боль и воспаление в районе межпозвоночных дисков.
В продаже есть хондропротекторы, которые содержат одно активное вещество, но достичь всех вышеперечисленных эффектов можно лишь комбинированными средствами. Например, глюкозамин способен решить задачи № 1, 2, 5, тогда как хондроитин эффективно справляется с целями 1, 3, 4, 5.
Механизм действия препаратов
Задача хондропротекторов – восстановить и сохранить целостность хрящевой ткани. Чтобы добиться поставленной задачи, они:
- Стимулируют развитие хондроцитов. Это основные клетки хряща, которые не только формируют его структуру, но и восстанавливают поврежденные клетки.
- Снижают активность лизосомальных ферментов (металлопротеиназ), которые разрушают хрящевую ткань.
- Увеличивают стойкость хондроцитов к противовоспалительным цитокинам.
- Активируют анаболические процессы (рост) в матриксе хряща.
- Создают все условия для формирования здорового сочленения.
Показания к применению
При грыже хондропротекторы назначаются при:
- болях и хрусте в суставах;
- тугоподвижности;
- анемении конечностей и ощущении ползания мурашек по ним;
- шейном, поясничном или грудном простреле;
- парезах и параличах.
Врач прописывает хондропротекторы и для профилактики и/или устранения состояний и болезней, которые приводят к грыже межпозвонковых дисков:
- поясничный, шейный, грудной остеохондроз;
- разные виды артроза;
- сколиоз и другие патологии, связанные с искривлением позвоночника;
- травма позвоночного столба, падение на спину, удар о копчик;
- дистрофические повреждения хрящей;
- артрит – периартрит (воспаление крупных сочленений).
Помогут ли хондропротекторы при грыже
Межпозвоночные диски – это образования, которые соединяют позвонки, обеспечивают подвижность и гибкость позвоночника. Внутри диска – ядро, окруженное прочной оболочкой (фиброзным кольцом). Если она разрывается, ядро выходит наружу и сдавливает нервы, которые проходят по центру позвоночного столба. Результат – сильнейшая боль.
Диски, как и фиброзное кольцо, состоят из нескольких видов хрящевой ткани. В отличие от других органов и тканей, она не способна получать питание из кровеносных сосудов. Хондропротекторы действительно помогают при грыже, так как их активные ингредиенты стимулируют регенерацию соединительной ткани, предотвращают процесс старения и разрушения диска, усиливают выработку хрящевой ткани, подавляют активность гиалуронидазы, стимулируют репарацию хряща. Они укрепляют диски, не позволяя оболочке разрушиться, предупреждают выпячивание.
Некоторые хондропротекторы для позвоночника при грыже содержат анестетики, поэтому их лучше принимать в период острой боли (Терафлекс-Адванс). Когда дискомфорт стихает, врачи рекомендуют вернуться к лекарствам без анестетиков.
Виды хондропротекторов
Существует несколько классификаций хондропротекторов:
- по активному веществу;
- по поколениям;
- форме выпуска.
Классификация по главному активному компоненту
Хондропротекторы для позвоночника при грыже содержат такие вещества:
- хондроитин;
- глюкозамин;
- гиалоурановую кислоту.
Хондропротекторы природного происхождения
Для Как это сделать, читайте в статье про лечения грыжи шейного отдела, грудного и поясничного отделов назначают препараты, богатые глюкозамином и хондроитином природного происхождения. Их получают из:
- хрящей животных и рыб (Румалон, Биртрон, Алфлутоп, Артрофиш);
- растительных компонентов — экстракта корня мартинии душистой, ростков пшеницы, грибов, орехов, брокколи, морских водорослей (Пиаскледин, Артро-Актив).
В отличие от синтетических БАДов, они хорошо усваиваются, а также содержат ингредиенты, которые положительно влияют на поврежденное сочленение.
На основе хондроитина
Хондроитин – это вещество, что входит в состав протеогликанов, которые вместе с коллагеном создают хрящевой матрикс. Хондролон, Хонсурид, Структум и другие хондропротекторы, что его содержат, выполняют такие задачи:
- Защищают хрящ, подавляя активность ферментов, которые его разрушают.
- Усиливают метаболизм в суставах и костях, способствует их восстановлению.
- Помогают сохранить воду в суставных тканях.
- Снижают воспаление, выраженность болевого синдрома.
- Нормализуют синтез суставной жидкости, что улучшает подвижность дисков между позвонками.
На основе глюкозамина
Глюкозамин входит в состав хондроитинов и суставной жидкости. Хондропротекторы на его основе (Сустилак, Арторон Флекс) улучшают проницаемость капсулы сустава, процессы ферментации в клетках хряща. Они нормализуют отложение солей кальция в костях, тормозят дегенерацию ткани.
Глюкозамин можно совмещать с глюкокортикостероидами и НПВП. Комплексная терапия позволяет снизить выраженность болевых симптомов при грыже позвоночника.
На основе гиалуроновой кислоты
Среди причин дегенерации хряща выделяют снижение вязкости синовиальной жидкости. Синокром, Ферматрон и другие хондропротекторы на основе гиалуроновой кислоты улучшают вяжущие свойства смазки, что позволяет дискам позвоночника выдерживать большую нагрузку.
Препараты 1-го, 2-го и 3-го поколения
Еще одна классификация делит хондропротекторы на 3 поколения:
- Натуральные средства, которые содержат хрящи животных или экстракты растений (Румалон, Биртрон, Пиаскледин).
- Монопрепараты, в составе которой лишь 1 активный компонент – Синокром (гиалуроновая кислота), Дона (глюкозамин) или Структум, АКОС (хондроитин).
- Комбинированные средства, в составе которых несколько активных компонентов. Они могут дополнены минералами, витаминами, жирными кислотами. Названия полезных хондропротекторов для позвоночника при грыже – Артра, Терафлекс, Артрон Триактив Форте.
По форме выпуска
- Капсулы;
- таблетки;
- порошок для приготовления жидкости для перорального употребления;
- растворы для в/м или внутрисуставных инъекций;
- жидкий заменитель синовиальной смазки для ввода в сочленение.
Список самых эффективных хондропротекторов при грыже
Для лечения грыжи межпозвоночного диска врачи сначала назначают капсулы и таблетки. К инъекциям прибегают в серьезных случаях, когда боль почти лишила человека подвижности.
Таблетки и капсулы
Лекарственные средства перорального употребления принимают во время или после еды, запивая стаканом воды. Курс терапии длится от 20 дней до 1,5 мес. Затем надо сделать перерыв. Добавки в таблетках отпускаются без рецепта врача.
Пиаскледин
- Цена: 300 капсул от 1,2 тыс. руб.
- Производитель: Laboratoires Expanscience (Франция).
- Активные вещества: масла авокадо и соевых бобов.
Пиаскледин регулирует метаболизм в хряще, стимулирует синтез коллагена в хондроцитах, предотвращает разрушение сустава. Этот хондропротектор для позвоночника при грыже устраняет воспаление, боль, восстанавливает двигательную функцию. Средство нельзя принимать при аллергии на бобы, авокадо.
Формула-С
- Стоимость: от 308 руб. за 60 шт.
- Производитель: CSB Nutrition Group (США)
- Действующие компоненты: глюкозамин, хондроитин, иммуноглобулины G, марганец, экстракты растений.
Формула-С – лекарство комплексного действия, которое:
- стимулирует синтез коллагена, клеток костно-хрящевой ткани;
- снижает боль в сочленениях, воспаление;
- устраняет спазмы;
- улучшает эластичность связок;
- помогает устранить хруст при разгибании позвоночника;
- стимулирует усвоение кальция.
Препарат оказывает мощное тонизирующее и омолаживающее действие, повышает иммунитет. Формула-С ускоряет регенерацию клеток, срастание переломов, заживление. Средство повышает физическую активность, работоспособность, улучшает выработку белков, энергообмен в мышцах. Взаимодействие Формулы-С с другими лекарствами не изучалось.
Артра
- Цена: от 1,3 тыс. за 60 шт.
- Производитель: Unipharm, Inc. (США)
- Активные компоненты: хондроитин и глюкозамин
Артра – новейшая разработка американских фармацевтов. Препарат восстанавливает фиброзно-хрящевой ткани, блокирует ферменты, которые разрушают межпозвонковые диски, снимает воспаление, боль. Под его влиянием улучшается синтез коллагена и протеогликанов, свойства синовиальной жидкости.
Артра запрещен при аллергии на компоненты препарата. Его нельзя пить, если проблемы с почками, фенилкетонурия. Средство осторожно назначают при сахарном диабете, астме, склонности к кровотечениям. Лекарство может вызывать понос, запор, метеоризм, боль в животе, головокружение.
Артру можно применять в составе комплексной терапии. Лекарство усиливает действие антиагрегантов и антикоагулянтов, совместим с глюкокортикостероидами. Он улучшает абсорбцию антибиотиков тетрациклиновой группы, снижает действие пенициллина.
Дона, Глюкозамин и Сустилак
- Цена: за 60 таблеток от 900 руб.
- Производители: Дона — Meda Pharma GmbH & Co.KG (Германия) / Глюкозамин -Unipharm, Inc. (США) / Сустилак — Celebrity Biopharma, Ltd. (Индия)
- Активный компонент: глюкозамин
Дона, Глюкозамин, Сустилак – препараты-аналоги, которые устраняют воспаление, улучшают качество синовиальной жидкости. Эти хондропротекторы при грыже поясничного отдела позвоночника стимулируют метаболизм в суставах. Они нормализуют отложение кальция в костной ткани, останавливают дегенерацию хряща.
О других методах лечения читайте в статье «Лечение межпозвоночной грыжи поясничного отдела без операции».
Препараты совместимы с парацетамолом, другими НПВС, глюкокортикостероидами. Они усиливают их противовоспалительный и обезболивающий эффект.
Структум
- Стоимость: 1,5 тыс. руб. за 60 шт.
- Производитель: Pierre Fabre (Франция)
- Активное вещество: хондроитин
Структум – препарат нового поколения, которое стимулирует регенерацию хряща, улучшая его метаболизм. Он снижает потерю кальция, что положительно сказывается на состоянии костной системы. Лекарство блокирует воспалительные процессы, улучшают подвижность суставов, устраняют болевой синдром.
Структум осторожно назначают при склонности к кровотечениям. Осложнения бывают редко в виде зуда, крапивницы, тошноты, рвоты. При комплексном лечении Структум усиливает действие непрямых антикоагулянтов, фибринолитиков, антиагрегантов.
Терафлекс
- Цена: от 1,2 тыс. руб. за 60 капсул
- Производитель: США
- Активные компоненты: глюкозамин и хондроитин
Терафлекс – средство новейшего поколения, которое стимулирует регенерацию хряща, предотвращает воспаление сустава. Он делает хрящ стойким к механическому воздействию, снимает боль. Он подавляет работу ферментов, которые вызывают деградацию хряща.
Терафлекс нельзя пить при:
- аллергии;
- фенилкетонурии;
- серьезных поражениях почек;
- беременности и лактации.
В редких случаях вызывает головокружение, тошноту, рвоту.
Раствор для употребления внутрь
Если не любите таблетки, можно купить Артракам, который выпускают в виде порошка для употребления внутрь. Продукт российского производителя ФармВилар содержит глюкозамин, а потому является жидким аналогом Доны и Сустилака. Пьют его 1 раз в сутки в течение 6 недель, затем 2 мес. – перерыв. Цена за 20 пак. по 1,5 г стартует от 715 руб.
Какие типы межпозвоночных грыж сложнее всего лечатся
4 этапа лечения межпозвоночной грыжи
Инъекции
Хондропротекторы для позвоночника при грыже в уколах назначают, когда пользы от таблеток нет. Сначала врач прописывает внутримышечные уколы, в тяжелых случаях делают инъекцию в сустав. Лекарство напрямую попадает в кровь или сочленение, минуя пищеварительный тракт, поэтому вызывают меньше побочных эффектов. Из минусов – уколы должен делать только специалист.
Мукосат
- Цена: 5 амп. от 400 руб.
- Производитель: Синтез ОАО (Россия)
- Действующее вещество: глюкозамин и хондроитин
- Форма выпуска: раствор для в/м инъекций
Мукосат назначают при дегенеративных болезнях позвоночника. При серьезном повреждении хряща средство подойдет в качестве заместительной терапии. Мукосат вводят по 1 мл через день. Если лекарство переносится хорошо, на 4 день дозу увеличивают до 2 миллилитров. Терапевтический эффект заметен через 3 недели. Курс лечения – 25-30 инъекций, повторный курс через 6 месяцев.
Алфлутоп
- Стоимость: 10 амп. от 1 тыс. руб.
- Производитель: S.C. Zentiva (Румыния)
- Активные компоненты: биоактивный концентрат мелких морских рыб
- Форма выпуска: в/м и внутрисуставная инъекция
Афлутоп – продукт нового поколения, который содержит хондроитин, аминокислоты, калий, кальций и другие вещества, способствующие регенерации костей. Средство блокирует воспаление, боль, нормализует метаболизм в фиброзно-хрящевой ткани дисков.
Афлутоп применяют:
- Внутримышечно: 1 мл по 20 дней или 2 мл по 10 дней.
- Как внутрисуставную инъекции: 1-2 миллилитра каждые 3-4 дня. Курс лечения – 5-6 уколов.
Средство нельзя принимать при аллергии на компоненты препарата, морепродукты. Афлутоп не назначают беременным, кормящим матерям, людям до 18 лет.
Хондроитин сульфат
- Цена: 10 пакетиков от 210 руб.
- Производитель: Эллара МЦ (Россия)
- Активный компонент: хондроитин в виде порошка для инъекций
- Форма выпуска: в/м инъекция
Хондроитин сульфат – средство нового поколения, который снимает болевой синдром, защищает хрящ от разрушения. Он стимулирует синтез хондроцитов, останавливает дегенерацию сустава. Препарат хорошо влияет на кости, улучшая фосфорно-кальциевый обмен. Противопоказан при склонностях к тромбозу, кровоточивости, беременным, в период лактации.
Эльбона
- Цена: 6 амп. от 700 руб.
- Производитель: Эллара МЦ (Россия)
- Действующее вещество: глюкозамин
- Форма выпуска: в/м инъекция
Эльбона улучшает регенерацию костной и хрящевой ткани, подвижность суставов, снимает боль и воспаление. Среди противопоказаний – фенилкетонурия. Средство осторожно назначают при сердечной недостаточности, низком артериальном давлении. Во время лечения запрещено спиртное, надо ограничить прием сахара и жидкости.
Заменители внутрисуставной жидкости
При дефиците синовиальной жидкости врач вводит в сустав специальный эндопротез, который являет собой аналог суставной смазки. В его основе – гиалуроновая кислота, которая после ввода равномерно покрывает сочленение. Суставная щель расширяется, грыжа начинает меньше давить на нервные окончания, снижая боль.
Содержимое ампул стерильно. Если упаковка была повреждена, средство нельзя вводить в сустав. Если после укола остался раствор, повторно применять его запрещено.
Заменители нельзя использовать с антисептиками, в составе которых четвертичные соли аммония, поскольку гиалуроновая кислота может выпасть в осадок.
Ферматрон
- Цена: от 2 тыс. руб. за 1 амп.
- Производитель: Hyaltech Ltd. (Англия)
Рекомендуемая доза – 3-5 инъекций раз в неделю. Длительность курса определяет врач. Эндопротез нельзя вводить в область, где проходят инфекционные процессы. С другими лекарствами совмещать не рекомендуется.
Синокром
- Стоимость: 1 амп. от 1,2 тыс. руб.
- Производитель: Croma Pharma (Германия)
Рекомендованный курс – 3-5 уколов по 1 инъекции в неделю, позволяет избавиться от боли на полгода. Препарат нельзя вводить при аллергии на его компоненты, бактериальном артрите. Комментарии от производителя о совместимости эндопротеза с другими внутрисуставными растворами отсутствуют.
Остенил
- Цена: 1 шт. от 1,5 тыс. руб.
- Производитель: TRB Chemedica AG (Германия)
Укол делают 1 раз в неделю не больше 5 раз, повторный курс через 6 месяцев. Сведения о совместимости Остенила с другими внутрисуставными жидкостями отсутствуют. Пациент может дополнительно принимать оральные анальгетики при сильной боли в первые дни лечения.
Синвиск
- Стоимость: 2 мл от 5 тыс. руб.; 6 мл от 15 тыс. руб.
- Производитель: Aventis Pharma (Россия)
Активный компонент, который содержит Синвик, называется гилан G-F 20 – биологический аналог гиалуронана. Препарат не оказывает общего действия, влияет только на поврежденный сустав.
Противопоказанием являются инфекция в зоне больного диска, его воспаление. Синвиск нельзя вводить в синовиальные ткани или капсулу сочленения – строго в суставное пространство.
Рекомендации пациентам
Лекарства для защиты суставов надо применять только с разрешения врача. Это препараты замедленного и длительного действия, поэтому нельзя ждать от них мгновенного результата.
Во время лечения пациент должен соблюдать такие инструкции:
- Не поднимать тяжести, не перегружать позвоночник.
- Следить за весом, при необходимости – похудеть.
- Хорошо одеваться, зимой носить теплую обувь, если ноги промокли, сразу переобуваться.
- Побольше двигаться, ходить пешком, заниматься ЛФК, когда нет обострения (острой боли).
- Не забывать отдыхать.
Ограничения к назначению и противопоказания
Абсолютным противопоказанием является аллергия на компоненты препарата. Почки отвечают за вывод лекарства из организма, поэтому при их тяжелой патологии средство лучше не принимать. Инъекции нельзя вводить в воспаленную зону, а также в область инфекции.
Нет данных, как влияют хондропротекторы при беременности, в период лактации, а также на подростков. Поэтому врачи не рекомендуют принимать препараты этим категориям населения.
Частые вопросы
Есть ли альтернатива/заменители хондропротекторов?
При каких еще заболеваниях применяют хондропротекторы?
Препараты назначают при всех болезнях, связанных с поражением суставов и хряща.
Бывают ли хондропротекторы в виде мазей?
Такие препараты есть (например Хондроитиновая мазь), но действуют они хуже, чем лекарства, употребляемые внутрь. Эффективность и фармакодинамика хондропротекторов наружного применения неизучена.
Литература:
- Dr Jason Theodosakis, Connaître, prévenir, soigner l’arthrose, éditions de Fallois, 1997
- Kahan, D.Uebelhart, F. De Vathaire, Arthrose et rhumatisme, février 2009, volume 60
- Никифоров А.С., Мендель О.И. Дегенеративные заболевания позвоночника, их осложнения и лечение // РМЖ. 2006
- Рациональная фармакотерапия ревматических заболеваний: Рук-во для практикующих врачей / Под общ. ред. В.А. Насоновой, Е.Л. Насонова. М.: Литтерра, 2003. Т. 3.
Оценка читателей
Болезни опорно-двигательного аппарата — бич 21-го века. Ученые связывают их распространение с 3-мя факторами: увеличение продолжительности жизни, малоподвижный образ жизни и питание, в котором практически отсутствуют глюкозамин, хондроитин и коллаген 2-го типа. Чтобы восполнить этот дефицит, были разработаны специальные препараты — хондропротекторы для суставов.
Содержание
Что такое хондропротекторы?
Хондропротекторы — спасение для суставов?
Показания и противопоказания к приему хондропротекторов
Классификация хондропротекторов
Эффективные хондропротекторы — список
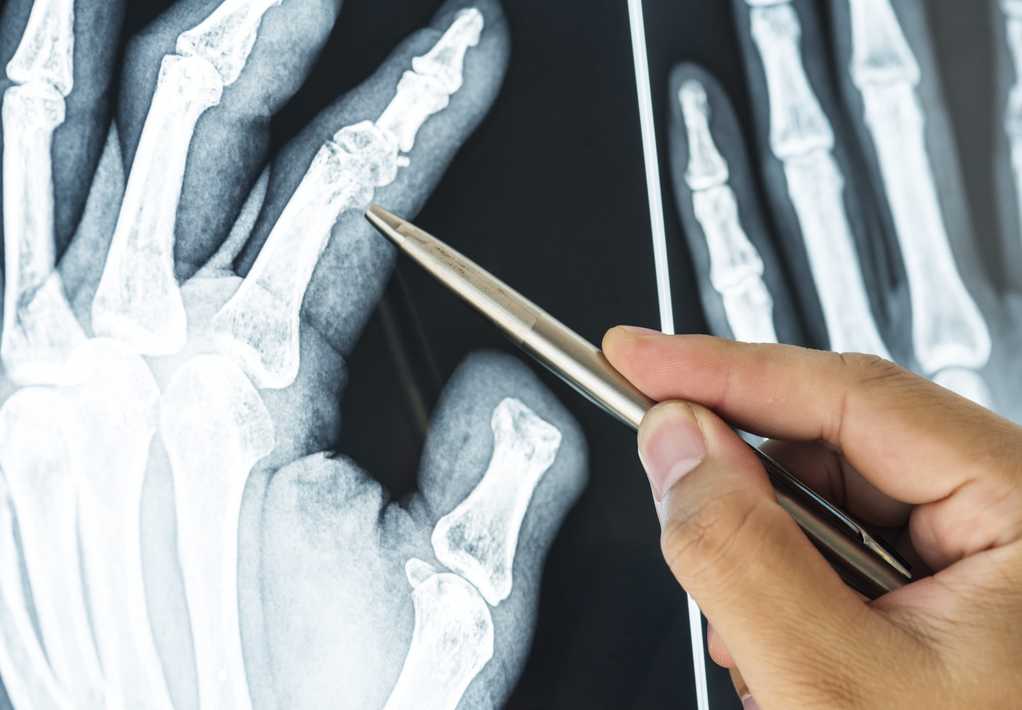
Хондропротекторы – эффективная защита для ваших суставов
Что такое хондропротекторы?
Хондропротекторы для суставов (порошки для лечения суставов) — это препараты замедленного действия, которые содержат белки, необходимые для построения суставного хряща, костей и других функциональных тканей скелетно-мышечной системы. Препараты хондропротекторы используются в комплексной терапии болезней опорно-двигательного аппарата совместно с противовоспалительными и другими средствами. Однако главная их задача — это профилактика дегенеративных изменений в суставах. Поэтому они эффективны до начала болезни, а также на ранних ее стадиях.
Хондропротекторы — спасение для суставов?
Подпитка и увлажнение хряща в суставе происходит при помощи синовиальной жидкости, в состав которой как раз входят уже упомянутые моно- и полисахариды. При травме, избыточной физической нагрузке или системном заболевании состав синовиальной жидкости может нарушаться. Из-за этого она становится менее вязкой и больше не может обеспечивать скольжение.
Попадая в синовиальную жидкость, компоненты хондропротекторов помогают восстановить ее консистенцию и нормальную деятельность хрящевых клеток. Суставы перестают болеть и опухать, их подвижность улучшается.
Параллельно с приемом хондропротекторов необходимы другие меры для активного восстановления и питания хряща — физиотерапия, лечебная физкультура, противовоспалительные препараты.
При каких болезнях применяются хондропротекторы
Препараты глюкозамина и хондроитина помогают защитить суставы от “голодания” и химически агрессивных веществ, которые скапливаются в них в результате воспаления. По этой причине они рекомендованы для вспомогательной терапии остеохондропатий — болезней, которые вызывают омертвение губчатой костной ткани (головок костей). Препараты-хондропротекторы применяются для лечения и профилактики:
-
остеохондроза;
-
остеоартроза (первичного и вторичного — на фоне воспалительных артритов -, посттравматического);
-
спондилёза (спондилоартроза);
- асептического некроза.
Хондропротекторы станут незаменимыми помощниками в борьбе с болезнями суставов
Препараты этой группы рекомендованы при врожденных и приобретенных патологиях костной ткани (например, деформация костей), грыжах и протрузиях. Хондроитин сульфат хорошо зарекомендовал себя в качестве вспомогательного вещества при лечении кератитов (воспаление глазной роговицы). Хондропротекторы при артрозе назначают на 1-2 стадии заболевания.
Действие хондропротекторов для суставов
Применение хондропротекторов позволяет уменьшить болевой синдром, замедлить прогрессирование болезни и улучшить подвижность сустава. Особенно эффективны они в лечении крупных сочленений — коленного, локтевого, тазобедренного.
Действие хондропротекторов при артрозе разделяют на:
- симптом-модифицирующее (уменьшение дискомфорта при износе хрящевой ткани);
- структурно-модифицирующее (улучшение структуры хряща, борьба с его дальнейшим разрушением).
Механизм действия хондропротективных препаратов основан на том, что они стимулируют рост хондроцитов, повышают их стойкость перед окислением, и подавляют активность ферментов, которые разрушают хрящевую ткань. Благодаря этому вместо дефектной хрящевой ткани начинает нарастать устойчивая, т.е., достаточно прочная, чтобы хрящ мог снова выполнять свои функции в суставе. Также протективные средства обладают слабым противовоспалительным эффектом, уменьшают отеки.
Хондропротекторы для суставов имеют накопительный эффект, действуют медленно и на протяжении длительного времени. Поэтому их используют для того, чтобы сократить потребность пациентов в нестероидных противовоспалительных и глюкокортикоидных средствах, увеличить длительность ремиссии. Глюкозамин также препятствует вымыванию кальция из костей, а хондроитин — нормализует кальциево-фосфорный обмен.
Показания и противопоказания к приему хондропротекторов
Основное применение в медицине у хондропротекторов — защита и восстановление суставов. Хондропротекторы для суставов производятся из натуральных продуктов, которые веками входили в рацион человека, поэтому побочные эффекты и противопоказания очень редки.
Кому нужны хондропротекторы для суставов?
Повреждение суставов — распространенное явление среди спортсменов, людей физического труда и лиц, ведущих малоподвижный образ жизни. В зоне риска также находятся люди с возрастными изменениями гормонального фона, лица старше 45 лет.
Начинать курс глюкозамина и хондроитина нужно:
- на 1-й и 2-й стадиях остеоартроза и других ревматических болезней;
- при заболеваниях связок и сухожилий;
- после травм и операций на суставах;
- при заболеваниях с тенденцией к поражению суставов;
- в других случаях по назначению врача.
Кому нельзя принимать хондропротекторы?
Абсолютные противопоказания к приему хондропротекторов для суставов — это фенилкетонурия (нарушение метаболизма аминокислот) и индивидуальная непереносимость их компонентов. Предварительная консультация специалиста перед приемом хондропротективных средств и дальнейшее наблюдение необходимо для:
- беременных и кормящих женщин;
- детей до 12 лет;
- астматиков (при затруднении дыхания препарат нужно отменить);
- диабетиков (глюкозамин изменяет толерантность к глюкозе);
- аллергиков (в особенности, с аллергией на различные виды белка и на моллюсков);
- пациентов с заболеваниями ЖКТ в фазе обострения (гастрит, язва желудка или 12-перстной кишки);
- людям с болезнями почек (в т.ч. желчно- и мочекаменная болезнь, почечная недостаточность) и печеночной недостаточностью;
- больных с сосудистыми патологиями (в т.ч. варикоз, тромбоз и тромбофлебит) и нарушениями свертываемости крови;
- лицам, у которых наблюдается оксалурический диатез;
- пациентов, у которых диагностированы злокачественные образования.
Классификация хондропротекторов
В медицинских источниках хондропротекторы для суставов разделяют по поколениям:
- 1-е поколение. Животные и растительные экстракты и концентраты, богатые глюкозамином и хондроитином;
- 2-е поколение. Препараты, которые содержат очищенный глюкозамин или хондроитин. Они быстрее и проще усваиваются, реже вызывают аллергию;
- 3-е поколение. Комбинированные средства, которые сочетают глюкозамин, хондроитин, препараты серы и другие компоненты. Состав хондропротекторов нового поколения нередко дополняется противовоспалительными средствами (ибупрофен, диклофенак), жирными кислотами (улучшают эластичность хряща и защищают его клетки от разрушения), витаминами (для лучшего усвоения действующих веществ и защиты клеточных мембран) и микроэлементами (для построения устойчивой хрящевой ткани).
Хондропротекторы нового поколения облегчают самочувствие больного гораздо быстрее, имеют меньше побочных эффектов.
Хондопротекторы выпускаются в различных формах Выберите то, что подходит именно вам.
Таблетки
Таблетки и капсулы назначаются курсами по 3-6 месяцев. Особенно эффективны они при поражениях крупных суставах или системных заболеваниях, которые затрагивают 4 и более сочленений. Капсулы усваиваются почти так же хорошо, как жидкий глюкозамин, но хранятся и дозируются гораздо лучше. Усвояемость этих хондропротекторов достаточно высока — 13-25%.
Мази-хондропротекторы
Местные хондропротекторы (мази и гели) используются при артрозах межпозвоночных, мелких и средних суставов. Наружные препараты обладают минимальной биодоступностью (менее 5%) и практически не влияют на структуру хряща, в особенности, если он залегает глубоко под кожей. Зато мази-хондропротекторы благотворно воздействуют на околосуставные ткани, снимают боль и отек, уменьшают воспаление. При отсутствии аллергической реакции их можно использовать постоянно.
Порошки для лечения суставов
Порошковые хондропротекторы — самая редкая форма выпуска. Порошок глюкозамина хорошо усваивается организмом (биодоступность свыше 26%), но не рекомендован при заболеваниях ЖКТ. Обычно производители включают в состав дополнительные компоненты, которые улучшают метаболизм хрящевой ткани.
Хондропротекторы в уколах
Уколы хондропротекторов максимально эффективны в сравнении с другими формами глюкозамина и хондроитина. Они ставятся внутримышечно и внутрисуставно. Инъекционные препараты — хорошая альтернатива пероральным, если у пациента есть заболевания ЖКТ.
Внутримышечный укол хондропротектора можно сделать самостоятельно или при помощи близких, а вот инъекция в сустав должна проводиться только опытным медицинским работником.
Внутрисуставное введение ХП (обычно с обезболивающими и противовоспалительными) считается наиболее эффективным. Хондропротекторы в уколах помогают при нарушениях синтеза — когда хрящевая ткань перестает вырабатывать вещества, необходимые для роста и увлажнения хряща.
Натуральные хондропротекторы в еде
Желательно ежедневно есть яйца, чаще употреблять говядину, красную рыбу, сыр.
Людям с больными суставами полезны и растительные коллагеноподобные соединения, которые содержатся в ростках пшеницы, грибах, орехах, брокколи, морских водорослях. В рационе стоит увеличить содержание цитрусовых, листовой зелени.
Даже ежедневное употребление хондропротективных продуктов не гарантирует здоровье хряща при:
-
метаболических нарушениях;
-
высоких профессиональных или бытовых нагрузках на сустав;
-
возрастных изменениях, когда клетки хряща перестают активно расти и размножаться.
В этих случаях в меню стоит включить лекарственные препараты — хондропротекторы с глюкозамином и хондроитином.
Эффективные хондропротекторы — список
К числу лучших хондропротекторов относятся глюкозамин, хондроитин, метилсульфонилметан, гиалуроновая кислота, коллаген II типа, а также ряд вспомогательных средств. Лучше всех, по отзывам пациентов, себя зарекомендовали следующие препараты-хондропротекторы:
-
Артрадол. Хондроитина сульфат в виде порошка для приготовления внутримышечных инъекций.
Курс лечения — 25-35 уколов хондропротектора через день. Повторный курс возможен через 6 месяцев. Цена от 600 до 1100 р., в зависимости от упаковки (5 и 10 ампул).
-
Артракам.Глюкозамина гидрохлорид в форме саше (порошок для приема внутрь раствором). Стимулирует восстановление хряща.
Курс лечения — 6 недель (1 пакетик раз в сутки), повторить курс можно через 2 месяца. Цена — 800-900 р. за 20 пакетиков.
- Алфлутоп. Препарат 1-го поколения из мелких морских рыб (шпроты, анчоусы) с хондроитинсульфатом, пептидами и минералами. Курс лечения хондропротекторами в уколах:
- внутримышечно: 20 дней (20 инъекций) с повтором каждые 6 месяцев;
- внутрисуставно: 1-2 мл раз в 3-4 дня. В курсе 5-6 инъекций.
Форма выпуска — раствор для в/м и в/с инъекций. Цена — 1500-1600 р. за 10 ампул.
-
Артра.Обладает обезболивающими свойствами, помогает восстановить сустав. Производится в США.
Курс: от 6 месяцев и более. В первые 3 недели по 1 таблетке 2 раза в день, с 22-го дня — по 1 таблетке 1 раз в день.
Форма выпуска — таблетки. Цена — от 900 до 1900 р., в зависимости от упаковки (30, 60, 120 шт.)
-
Дона. Глюкозамина сульфат. Выпускается в виде таблеток, саше и раствора для внутримышечного введения. Курс применения:
- таблетки: 1 таблетка 2 раза в сутки сроком от 4-6 недель, перерыв между курсами — от 2 месяцев;
- саше: 1 пакетик в день, курсом от 6 недель;
- инъекции: 1 ампула 3 раза в неделю курсом 4-6 недели.
Цена — от 1200 до 2500 р.
-
Румалон. Препарат 1-го поколения в виде раствора для внутримышечных инъекций. Содержит экстракт хрящей и костного мозга крупного рогатого скота.
Курс: 5-6 недель, 3 раза в неделю по 1 мл.
Цена — 1250-1400 р. за 10 ампул и 2300-2500 р. за 25 ампул.
-
Структум. Хондроитина сульфат. Производится во Франции. Форма выпуска — капсулы. Способ применения: 1 капсула 2 раза в день в течение 3-6 месяцев. Повторный курс возможен через 2-5 месяцев. Цена — 1200-1400 р. за 60 капсул.
-
Терафлекс. Комбинированный хондропротектор нового поколения — содержит хондроитина и глюкозамина сульфат. Допускается применение на 3-й стадии остеоартроза. Производится в Великобритании.
Способ применения: первый 21 день по 1 капсуле 3 раза в сутки, затем 1 капсулу 2 раза в сутки. Продолжительность курса — 3-6 месяцев.
Цена — от 1400 до 3200 р. (60, 100 или 200 шт. в упаковке).
-
Хондрогард. Выпускается в виде раствора хондроитинсульфата для внутримышечных и внутрисуставных инъекций.
Курс хондропротектора в уколах:
- внутримышечно: 25-30 инъекций, интервалы между курсами не менее 6 месяцев;
- комбинированный: 5 внутрисуставных инъекций с интервалом 3 дня, а затем 16 внутримышечных с интервалом 1 день.
Цена — 800-1200 р. за 10 ампул и 2200 р. за 25 ампул.
-
Хондроксид. Хондроитина сульфат в виде таблеток, геля или мази 5%.
Способ применения:
- таблетки: принимать по 2 таблетки 2 раза в сутки в течение 6 месяцев (эффект сохраняется в течение 3-5 месяцев);
- гель: втирать местно над пораженным суставом 2-3 раза в сутки курсом от 2 недель до 3 месяцев;
- мазь: аналогично гелю.
Цена — около 700 р. за 60 таблеток и около 350 р. за мазь или гель (30 г).
-
Эльбона. Глюкозамина сульфат. Форма выпуска — раствор для внутримышечных инъекций. Курс применения: 3 раза в неделю в течение 4-6 недель. Производится в России. Цена — 1100 р. за 6 ампул.
Перед применением хондропротекторов из списка желательно посоветоваться c врачом.
Надеемся, что смогли Вам помочь! Здоровья Вам и Вашим близким!
Монтрал МЛ (таблетки, покрытые пленочной оболочкой, 5 мг+10 мг), инструкция по медицинскому применению РУ № ЛП-005150
Дата последнего изменения: 04.02.2019
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Лекарственная форма
- Состав
- Описание лекарственной формы
- Фармакокинетика
- Фармакодинамика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
- Отзывы
Действующее вещество
ATX
Фармакологическая группа
Лекарственная форма
Таблетки,
покрытые пленочной оболочкой.
Состав
Каждая
таблетка, покрытая пленочной оболочкой содержит:
Действующие вещества:
Монтелукаст
10 мг (в виде монтелукаста натрия 10,4 мг), левоцетиризина
дигидрохлорид 5 мг;
Вспомогательные вещества:
Лактозы
моногидрат 93,25 мг, крахмал прежелатинизированный 36,55 мг,
кросповидон 1,4 мг, тальк 1,4 мг, магния стеарат 2 мг;
Состав пленочной оболочки:
гипромеллоза 4,4 мг, титана диоксид (E171) 1,7 мг, тальк 1,8 мг,
пропиленгликоль 0,7 мг, краситель железа оксид желтый (E172) 0,06 мг.
Описание лекарственной формы
Круглые,
двояковыпуклые таблетки, покрытые пленочной оболочкой желтого цвета, с риской
на одной стороне.
Фармакокинетика
Абсорбция
Монтелукаст
быстро и практически полностью всасывается после приема внутрь. Прием обычной
пищи не влияет на биодоступность и максимальную концентрацию в плазме (Cmax)
монтелукаста. У взрослых при приеме натощак монтелукаста в виде таблеток
покрытых пленочной оболочкой в дозировке 10 мг, Cmax
достигается через 3 часа. Биодоступность при приеме внутрь составляет 64%.
Левоцетиризин
быстро и полностью всасывается из желудочно-кишечного тракта при приеме внутрь;
прием пищи не оказывает влияния на полноту всасывания, но снижает его скорость.
Биодоступность достигает 100%. Время достижения максимальной концентрации
в плазме крови (TCmax)
— 0,9 часа, максимальная концентрация в плазме крови (Cmax)
— 270 нг/мл, равновесная концентрация достигается через 2 суток.
Распределение
Монтелукаст
связывается с белками плазмы крови более чем на 99%. Объем распределения
монтелукаста составляет в среднем 8–11 литров.
Левоцетиризин
на 90% связывается с белками плазмы крови. Объем распределения составляет
0,4 л/кг.
Метаболизм
Монтелукаст
активно метаболизируется в печени. При использовании терапевтических доз
концентрации метаболитов монтелукаста в плазме в равновесном состоянии у
взрослых и у детей не определяются. Предполагается, что в процесс
метаболизма монтелукаста вовлечены изоферменты цитохрома P450
CYP
(3A4
и 2C9), при этом в терапевтических концентрациях монтелукаст не ингибирует
изоферменты цитохрома P450
CYP:
3A4,
2C9, 1A2, 2A6, 2C19 и 2D6.
У
людей метаболизируется менее 14% дозы левоцетиризина, так как предполагаемые
различия в фармакокинетическом профиле левоцетиризина вследствие
генетического полиморфизма или одновременного приема ингибиторов ферментов
незначительны. Метаболические превращения заключаются в окислении
ароматического кольца, N- и O‑деалкилировании
и конъюгации с таурином.
Процесс деалкилирования, главным образом, осуществляется с помощью изофермента
CYP3A4, в то время как окисление ароматического кольца происходит с
помощью многих и/или неустановленных CYP‑изоформ.
Левоцетиризин при приеме внутрь в дозе 5 мг и/или при превышении
максимальных концентраций в плазме крови не оказывает влияния на активность
CYP‑изоферментов
1A2, 2C9, 2C19, 2D6, 2E1, 3A4.
Благодаря ограниченному метаболизму и отсутствию метаболической ингибирующей
активности взаимодействие левоцетиризина на уровне метаболизма с другими
веществами маловероятно.
Выведение
Клиренс
монтелукаста составляет у здоровых взрослых в среднем 45 мл/мин. После
перорального приема монтелукаста 86% от принятой дозы выводится кишечником
в течение 5 дней и менее 0,2% — почками, что подтверждает то, что
монтелукаст и его метаболиты экскретируются почти исключительно с желчью.
Период полувыведения у здоровых взрослых составляет от 2,7 до
5,5 часа. Фармакокинетика монтелукаста сохраняет практически линейный
характер при приеме внутрь доз свыше 50 мг.
При приеме монтелукаста в утренние и вечерние часы различий в фармакокинетике
не наблюдается. При приеме 1 раз в сутки монтелукаста в лекарственной
форме таблетки, покрытые пленочной оболочкой 10 мг наблюдается умеренная
(около 14%) кумуляция активного вещества в плазме.
Период
полувыведения левоцетиризина (T1/2) у взрослых составляет
7,9 ± 1,9 ч. Средний наблюдаемый общий клиренс —
0,63 мл/мин/кг. Полностью выводится из организма в течение
95 часов. Около 85,4% принятой дозы препарата выводится почками, около
12,9% — через кишечник. При почечной недостаточности (клиренс креатинина
(КК) менее 40 мл/мин) клиренс снижается (у пациентов, находящихся на
гемодиализе — на 80%, что требует изменения соответствующего режима
дозирования), период полувыведения (T1/2) — удлиняется. Менее
10% удаляется в ходе стандартной 4‑часовой процедуры гемодиализа.
Особенности фармакокинетики монтелукаста у различных групп
пациентов
Пол
Фармакокинетика
монтелукаста у женщин и мужчин одинакова.
Пожилые пациенты
При
приеме внутрь 1 раз в сутки таблеток покрытых пленочной оболочкой, содержащих
10 мг монтелукаста, фармакокинетический профиль и биодоступность сходны
у пожилых людей и пациентов молодого возраста.
Данные
по фармакокинетике левоцетиризина ограничены. При повторном приеме 30 мг
левоцетиризина один раз в сутки в течение 6 дней у пожилых пациентов общий
клиренс был приблизительно на 33% ниже, чем таковой у взрослых пациентов более
молодого возраста. Было показано, что распределение рацемата цетиризина больше
зависит от функции почек, чем от возраста, поэтому у пациентов
пожилого возраста доза препарата должна быть скорректирована в зависимости
от функции почек.
Печеночная недостаточность
У
пациентов с печеночной недостаточностью легкой и средней степени тяжести и
клиническими проявлениями цирроза печени отмечено замедление метаболизма
монтелукаста, сопровождающееся увеличением площади под фармакокинетической
кривой «концентрация-время» (AUC) приблизительно на 41% после однократного
приема 10 мг монтелукаста. Период выведения монтелукаста у пациентов
с печеночной недостаточностью незначительно увеличивается по сравнению
со здоровыми добровольцами (среднее время полувыведения — 7,4 часа).
Коррекция дозы монтелукаста у пациентов с печеночной недостаточностью
легкой и средней степени тяжести не требуется. Данных о характере
фармакокинетики монтелукаста у пациентов с тяжелой печеночной
недостаточностью (более 9 баллов по шкале Чайлд-Пью) нет.
Почечная недостаточность
Поскольку
монтелукаст и его метаболиты не экскретируются с мочой, фармакокинетика
монтелукаста у пациентов с почечной недостаточностью не оценивалась.
У
пациентов с почечной недостаточностью при клиренсе креатинина менее
40 мл/мин клиренс левоцетиризина уменьшается. У пациентов, находящихся на
гемодиализе, общий клиренс снижается на 80%, что требует изменения режима
дозирования. Менее 10% удаляется в ходе стандартной 4‑часовой процедуры
гемодиализа.
Дети
У
детей в возрасте от 6 до 11 лет с массой тела от 20 до 40 кг при
приеме внутрь однократно 5 мг левоцетиризина показатели Cmax
и площадь под кривой «концентрация-время» (AUC) примерно в два раза
превышают аналогичные показатели у взрослых здоровых людей. Прием
левоцетиризина в дозе 1,25 мг
у детей в возрасте от 6 месяцев до 5 лет приводит к концентрации
в плазме крови, соответствующей таковой у взрослых при приеме 5 мг
препарата один раз в сутки.
Раса
Клинически
значимых различий фармакокинетических параметров у пациентов различных
расово-этнических групп не выявлено.
Фармакодинамика
Препарат
представляет собой комбинацию монтелукаста (лейкотриеновых рецепторов блокатор)
и левоцетиризина (H1‑гистаминовых рецепторов блокатор).
Монтелукаст
селективно ингибирует CysLT‑рецепторы
цистеиниловых лейкотриенов эпителия дыхательных путей. Цистеинил лейкотриеновые
рецепторы 1 типа (CysLT‑рецепторы)
присутствуют в дыхательных путях человека, в том числе в клетках
гладких мышц бронхов, макрофагах и других провоспалительных клетках (включая
эозинофилы и некоторые миеловидные стволовые клетки). Цистеинил лейкотриены (LTC4,
LTD4,
LTE4)
относятся к классу эйкозаноидов, образующихся из арахидоновой кислоты, и
являются медиаторами воспаления, образующимися в различных клетках организма,
в том числе в тучных клетках и эозинофилах. Цистеинил лейкотриены
коррелируют с патофизиологией бронхиальной астмы и аллергического ринита.
При аллергическом рините после воздействия аллергена происходит высвобождение
цистеинил лейкотриенов из противовоспалительных клеток слизистой оболочки
полости носа во время ранней и поздней фаз аллергической реакции, что
проявляется симптомами аллергического ринита. При интраназальной пробе с
цистеинил лейкотриенами было продемонстрировано повышение симптомов назальной
обструкции. Монтелукаст с высоким сродством и избирательностью связывается
с CysLT‑рецепторами,
снижает число эозинофилов в периферической крови, в дыхательных путях.
Левоцетиризин
— R‑энантиомер цетиризина; конкурентный антагонист гистамина; блокирует H1‑гистаминовые
рецепторы, сродство к которым в 2 раза выше, чем у цетиризина.
Левоцетиризин оказывает влияние на гистаминозависимую стадию аллергических
реакций; уменьшает миграцию эозинофилов, уменьшает сосудистую проницаемость,
ограничивает высвобождение медиаторов воспаления и цитокинов (VCAM‑1 и
других).
Левоцетиризин
предупреждает развитие и облегчает течение аллергических реакций, оказывает
антиэкссудативное, противозудное действие; практически не оказывает
антихолинергического и антисеротонинового действия. В терапевтических дозах
практически не оказывает седативного действия.
Действие
начинается через 12 минут после приема однократной дозы у 50% пациентов, через
1 час — у 95% и продолжается в течение 24 часов.
Показания
Лечение
симптомов круглогодичного (персистирующего) и сезонного (интермиттирующего)
аллергических ринитов.
Противопоказания
Повышенная
чувствительность к монтелукасту, левоцетиризину (в том числе
к производным пиперазина), а также к другим компонентам препарата;
Дефицит
лактазы, непереносимость лактозы, глюкозо-галактозная мальабсорбция;
Терминальная
стадия почечной недостаточности (клиренс креатинина ниже 10 мл/мин);
Детский
возраст до 15 лет (ввиду ограниченности данных по безопасности и
эффективности);
Беременность
и период грудного вскармливания.
С осторожностью
Хроническая
почечная недостаточность (требуется коррекция режима дозирования); пожилой
возраст (возможно снижение клубочковой фильтрации); пациенты с повреждением
спинного мозга, гиперплазией предстательной железы, а также при наличии других
предрасполагающих факторов к задержке мочи, поскольку левоцетиризин может
увеличивать риск задержки мочи; при одновременном употреблении с алкоголем
(см. раздел «Взаимодействие с другими лекарственными средствами»).
Применение при беременности и кормлении грудью
Адекватных
и строго контролируемых клинических исследований по безопасности
применения препарата во время беременности не проводилось. Применение препарата
при беременности противопоказано.
Данных
о выделении монтелукаста с грудным молоком у человека нет. Левоцетиризин
выделяется с грудным молоком. Поэтому при необходимости применения
препарата при лактации рекомендуется прекратить грудное вскармливание.
Способ применения и дозы
Внутрь,
запивая водой, независимо от приема пищи.
Взрослым и детям старше 15 лет:
принимать по 1 таблетке 1 раз в сутки.
Пациентам
с печеночной недостаточностью коррекции дозы не требуется.
Пациентам
с хронической почечной недостаточностью и пациентам пожилого возраста следует
корректировать дозу в зависимости от степени почечной недостаточности.
Пациентам
с легким нарушением функции почек (клиренс креатинина 50–79 мл/мин)
коррекции дозы не требуется.
У
пациентов с умеренной почечной недостаточностью (клиренс креатинина от 30
до 49 мл/мин) рекомендуемая доза левоцетиризина 5 мг (1
таблетка) через день.
У
пациентов с тяжелой почечной недостаточностью (клиренс креатинина менее
30 мл/мин) рекомендуемая доза левоцетиризина 5 мг (1 таблетка)
1 раз в 3 дня.
Продолжительность приема препарата
При
лечении сезонного (интермиттирующего) ринита (наличие симптомов менее
4 дней в неделю или их общая продолжительность менее 4‑х недель)
продолжительность лечения зависит от длительности симптоматики; лечение
может быть прекращено при исчезновении симптомов и возобновлено при появлении
симптомов.
При
лечении круглогодичного (персистирующего) аллергического ринита (наличие
симптомов более 4‑х дней в неделю, и их общая продолжительность
более 4‑х недель) лечение может продолжаться в течение всего
периода воздействия аллергенов.
При
пропуске одного приема препарата не следует принимать дополнительную дозу
препарата для компенсации пропущенного приема, рекомендуется принять следующую
дозу в обычное время.
Побочные действия
Перечисленные
ниже нежелательные явления распределены по частоте возникновения
в соответствии со следующей градацией: очень часто (≥1/10),
часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000
до <1/100), редко (от ≥1/10000 до <1/1000), очень редко
(<1/10000), частота неизвестна (частота не может быть подсчитана по
имеющимся данным).
Монтелукаст
Нарушения со стороны крови и лимфатической системы:
Частота неизвестна
— повышенная склонность к кровотечениям, тромбоцитопения.
Нарушения со стороны иммунной системы:
Редко — реакция
гиперчувствительности, в том числе анафилаксия, очень редко — эозинофильная инфильтрация печени.
Нарушения психики:
Частота неизвестна
— ажитация, в том числе агрессивное поведение или враждебность, тревожность,
депрессия, дезориентация, патологические сновидения, галлюцинации, бессонница,
раздражительность, беспокойство, сомнамбулизм, суицидальные мысли и поведение
(суицидальность), тремор, нарушения внимания и памяти.
Нарушения со стороны нервной системы:
Редко — головная
боль, головокружение, сонливость; очень
редко — судороги; частота
неизвестна — парестезия/гипестезия.
Нарушения со стороны сердца:
Частота неизвестна
— учащенное сердцебиение.
Нарушения со стороны дыхательной системы, органов грудной
клетки и средостения:
Редко — носовое
кровотечение; частота неизвестна
— инфекции верхних дыхательных путей, фарингит, кашель, синусит, ринорея,
синдром Чарджа-Стросса.
Нарушения со стороны желудочно-кишечного тракта:
Редко — изжога,
отрыжка, боль в животе; частота неизвестна
— диарея, рвота, диспепсия, тошнота, запоры, панкреатит, сухость во рту.
Нарушения со стороны печени и желчевыводящих путей:
Редко — повышение
активности «печеночных» трансаминаз в сыворотке крови (аланинаминотрансфераза
(АЛТ), аспартатаминотрансфераза (АСТ)); очень
редко — гепатит (включая холестатические, гепатоцеллюлярные и
смешанные поражения печени).
Нарушения со стороны кожи и подкожных тканей:
Редко — кожная сыпь,
крапивница; частота неизвестна —
ангионевротический отек, появление экхимозов, узловатая эритема, многоформная
эритема, кожный зуд.
Нарушения со стороны скелетно-мышечной и соединительной
ткани:
Редко — артралгия; частота неизвестна — миалгия, включая
спазмы мышц.
Нарушения со стороны почек и мочевыводящих путей:
Частота неизвестна
— энурез у детей.
Общие расстройства и нарушения в месте введения:
Редко — астения
(слабость)/усталость; частота неизвестна
— отеки, пирексия, жажда.
Левоцетиризин
Нарушения со стороны иммунной системы:
Частота неизвестна
— реакции гиперчувствительности, в том числе анафилактические реакции.
Нарушения со стороны обмена веществ и питания:
Частота неизвестна
— повышение аппетита, повышение массы тела.
Нарушения психики:
Часто — головная
боль, сонливость, утомляемость; нечасто
— астения; частота неизвестна —
тревога, агрессия, возбуждение, бессонница, галлюцинации, депрессия,
суицидальные мысли.
Нарушения со стороны нервной системы:
Частота неизвестна
— судороги, тромбоз синусов твердой мозговой оболочки, парестезия, головокружение,
обморок, тремор, дисгевзия (нарушение вкуса).
Нарушения со стороны органа зрения:
Частота неизвестна
— нарушение зрения, диплопия, воспаление, нечеткость зрительного восприятия.
Нарушения со стороны органа слуха и лабиринтные нарушения:
Частота неизвестна
— вертиго.
Нарушения со стороны сердца:
Частота неизвестна
— тахикардия, стенокардия, ощущение сердцебиения.
Нарушения со стороны сосудов:
Частота неизвестна
— тромбоз яремной вены.
Нарушения со стороны дыхательной системы, органов грудной
клетки и средостения:
Частота неизвестна
— диспноэ, усиление симптомов ринита.
Нарушения со стороны желудочно-кишечного тракта:
Часто — сухость во
рту; нечасто — боль в животе; частота неизвестна — тошнота, диарея,
рвота.
Нарушения со стороны печени и желчевыводящих путей:
Частота неизвестна
— гепатит.
Нарушения со стороны кожи и подкожных тканей:
Частота неизвестна
— ангионевротический отек, стойкая лекарственная эритема, сыпь, зуд,
крапивница, гипотрихоз, трещины, фотосенсибилизация.
Нарушения со стороны скелетно-мышечной и соединительной
ткани:
Частота неизвестна
— боли в мышцах, артралгия.
Нарушения со стороны почек и мочевыводящих путей:
Частота неизвестна
— дизурия, задержка мочи, позывы на мочеиспускание.
Лабораторные и инструментальные данные:
Частота неизвестна
— изменение функциональных проб печени.
Прочее:
Частота неизвестна
— перекрестная реактивность, периферические отеки.
Если
любые из указанных в инструкции побочных эффектов усугубляются, или Вы заметили
любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
Взаимодействие
Монтелукаст
Монтелукаст
можно назначать вместе с другими лекарственными средствами, традиционно
применяемыми для профилактики и длительного лечения бронхиальной астмы и/или
аллергического ринита. Рекомендуемая терапевтическая доза монтелукаста не оказывает
клинически значимого влияния на фармакокинетику следующих препаратов:
теофиллина, преднизона, преднизолона, пероральных контрацептивов
(этинилэстрадиол/норэтистерон 35/1), терфенадина, дигоксина и варфарина.
Значение
AUC снижается при одновременном приеме фенобарбитала (примерно на 40%),
однако коррекция режима дозирования монтелукаста не требуется. Поскольку
монтелукаст метаболизируется изоферментом CYP3A4
следует соблюдать осторожность, если монтелукаст одновременно назначается с
препаратами, индуцирующими изофермент CYP3A4,
такими как фенитоин, фенобарбитал и рифампицин. Однако изменения дозы
монтелукаста не требуется.
Исследования
in vitro показали, что
монтелукаст является потенциальным ингибитором изофермента CYP2C8,
однако данные клинических исследований взаимодействия препарат — препарат,
включающих монтелукаст и росиглитазон (предварительный субстрат представителя
медицинских препаратов, первично метаболизирующихся изоферментом CYP2C 
показали, что дозы монтелукаста не ингибируют изоферменты CYP2C8
in vivo. Следовательно,
монтелукаст не оказывает заметного влияния на метаболизм препаратов,
метаболизирующихся этим ферментом (например, паклитаксел, росиглитазон и
репаглинид).
Гемфиброзил
(ингибитор CYP2C8
и 2C9) повышает эффект системного воздействия монтелукаста
в 4,4 раза. Однако влияние гемфиброзила на системное воздействие
монтелукаста не может считаться клинически значимым на основании данных
по безопасности при применении монтелукаста в дозах, превышающих
одобренную дозу 10 мг. Поэтому при совместном приеме вместе
с гемфиброзилом коррекция дозы монтелукаста не требуется. Совместный прием
итраконазола, мощного ингибитора CYP3A4,
вместе с гемфиброзилом и монтелукастом не приводил к дополнительному
повышению эффекта системного воздействия монтелукаста.
Левоцетиризин
При
изучении лекарственного взаимодействия рацемата цетиризина с феназоном,
псевдоэфедрином, циметидином, кетоконазолом, эритромицином, азитромицином,
глипизидом и диазепамом клинически значимых нежелательных взаимодействий
не выявлено.
Теофиллин
(400 мг/сутки) снижает общий клиренс левоцетиризина на 16%, при этом
кинетика теофиллина не изменяется.
В
исследовании при одновременном приеме ритонавира (600 мг 2 раза в
сутки) и цетиризина (10 мг в сутки) показано, что экспозиция
цетиризина увеличивалась на 40%, а экспозиция ритонавира
незначительно изменялась (−11%).
Совместное
применение с макролидами или кетоконазолом не вызывало достоверных изменений
на ЭКГ.
В
ряде случаев при одновременном применении левоцетиризина с алкоголем или
лекарственными препаратами, оказывающими подавляющее влияние на центральную
нервную систему (ЦНС), возможно усиление их влияния на ЦНС, хотя не доказано,
что рацемат цетиризина потенцирует эффект алкоголя.
Передозировка
Данных
о передозировке препаратом не поступало. Однако имеются данные
о передозировке отдельными компонентами препарата.
Монтелукаст
Симптомы:
Наиболее
частыми нежелательными явлениями были чувство жажды, сонливость, рвота,
психомоторное возбуждение, головная боль и боль в животе.
Лечение:
Лечение
симптоматическое. Отсутствует информация о специфическом лечении передозировки
монтелукастом. Данных о возможности выведения монтелукаста путем
перитонеального диализа и гемодиализа нет.
Левоцетиризин
Симптомы:
Сонливость
(у взрослых), возбуждение и беспокойство, сменяющиеся сонливостью (у детей).
Лечение:
Промывание
желудка, прием активированного угля, симптоматическая терапия. Специфического
антидота нет. Гемодиализ не эффективен.
Особые указания
Монтелукаст
В
редких случаях у пациентов, принимающих препараты для лечения бронхиальной
астмы, включая монтелукаст, может возникнуть системная эозинофилия, иногда
сопровождающаяся клиническими проявлениями васкулита и синдрома Чарджа-Стросса.
Такое состояние обычно лечат системными глюкокортикостероидами. Такие случаи
обычно, но не всегда, связаны с уменьшением дозы или отменой пероральных
глюкокортикостероидов. Врачи должны знать о возможности возникновения
у пациентов эозинофилии, васкулитной сыпи, нарастания легочных симптомов,
осложнений со стороны сердца и/или нейропатии.
Пациенты
с подтвержденной аллергией к ацетилсалициловой кислоте и другим нестероидным
противовоспалительным препаратам (НПВП) не должны принимать эти препараты в
период лечения монтелукастом, поскольку он, улучшая дыхательную функцию у пациентов
с аллергической бронхиальной астмой, тем не менее, не может полностью
предотвратить бронхоконстрикцию, вызванную НПВП.
У
пациентов, принимавших монтелукаст, были описаны психоневрологические
нарушения. Учитывая, что эти симптомы могли быть вызваны другими факторами,
неизвестно, связаны ли они с приемом монтелукаста. Врачу необходимо
обсудить данные нежелательные явления с пациентами и/или их
родителями/опекунами. Пациентам и/или их родителям/опекунам необходимо
объяснить, что в случае появления подобных симптомов необходимо сообщить
об этом лечащему врачу.
Левоцетиризин
Во
время лечения препаратом не рекомендуется принимать этанол.
Влияние на способность управлять
транспортными средствами, механизмами
Исследований
воздействия препарата на способность управлять транспортными средствами и
механизмами не проводилось. В период лечения необходимо соблюдать осторожность
при вождении автотранспорта и занятии другими потенциально опасными видами деятельности,
требующими повышенной концентрации внимания и быстроты психомоторных реакций,
так как препарат может вызывать слабость, сонливость и головокружение.
Форма выпуска
Таблетки,
покрытые пленочной оболочкой 5 мг + 10 мг.
По
10 таблеток в стрипы (алюминий/алюминий). По 1, 2, 3, или 5 стрипов вместе
с инструкцией по применению помещают в картонную пачку.
Условия отпуска из аптек
Условия хранения
При
температуре не выше 30 °С.
Хранить
в недоступном для детей месте.
Срок годности
3
года.
Не
использовать после истечения срока годности.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.