11.07.2022

11.07.2022
Описание препарата Ребамипид-СЗ (таблетки, покрытые пленочной оболочкой, 100 мг) основано на официальной инструкции, утверждено компанией-производителем в 2022 году
Дата согласования: 11.07.2022
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
- Отзывы
Действующее вещество
ATX
Фармакологическая группа
Состав
| Таблетки, покрытые пленочной оболочкой | 1 табл. |
| активное вещество: | |
| ребамипид | 100 мг |
| вспомогательные вещества: целлюлоза микрокристаллическая 102 — 56,7 мг; крахмал прежелатинизированный (крахмал 1500) — 46,8 мг; гипромеллоза (гидроксипропилметилцеллюлоза) — 5,8 мг; коллидон SR (поливинилацетат 80%, повидон 19%, натрия лаурилсульфат 0,8%, кремния диоксид 0,2%) — 19,2 мг; лимонная кислота — 2,3 мг; натрия лаурилсульфат — 2 мг; тальк — 4,8 мг; магния стеарат — 2,4 мг | |
| оболочка пленочная: гипромеллоза — 3,57 мг; полисорбат 80 (твин 80) — 1,49 мг; тальк — 1,19 мг; титана диоксид (Е171) — 0,75 мг |
Описание лекарственной формы
Таблетки, покрытые пленочной оболочкой, белого или почти белого цвета, круглые, двояковыпуклые.
На поперечном разрезе — ядро таблетки белого или почти белого цвета.
Фармакологическое действие
Фармакологическое действие
—
гастропротективное.
Фармакодинамика
Ребамипид повышает содержание ПГЕ2 в слизистой желудка и содержание ПГЕ2 и ПГI2 в содержимом желудочного сока. Оказывает цитопротекторное действие в отношении слизистой желудка при повреждающем воздействии этанола, кислот и щелочей, ацетилсалициловой кислоты. Способствует активации энзимов, ускоряющих биосинтез высокомолекулярных гликопротеинов и повышает содержание слизи на поверхности стенки желудка. Способствует улучшению кровоснабжения слизистой желудка, активизирует ее барьерную функцию, активизирует щелочную секрецию желудка, усиливает пролиферацию и обмен эпителиальных клеток желудка, очищает слизистую от гидроксильных радикалов и подавляет супероксиды, продуцируемые полиморфноядерными лейкоцитами и нейтрофилами в присутствии Helicobacter pylori, защищает слизистую желудка от поражения бактериями, оказывает гастропротекторное действие при воздействии НПВС на слизистую.
Фармакокинетика
Абсорбция при приеме внутрь — высокая. После приема в дозе 100 мг Cmax в плазме крови достигается приблизительно через 2 ч и составляет 340 нг/мл. Т1/2 равен приблизительно 1 ч. Повторные приемы препарата не приводят к его кумуляции в организме. Приблизительно 10% препарата выводится почками, преимущественно в неизмененном виде. При приеме в дозе 600 мг удается выделить следы гидроксилированного метаболита. В опытах in vitro показано, что от 98,4 до 98,6% препарата связывается белками плазмы.
Показания
язвенная болезнь желудка;
хронический гастрит с повышенной кислотообразующей функцией желудка в стадии обострения;
эрозивный гастрит;
предотвращение возникновения повреждений слизистой оболочки на фоне приема НПВС.
Может использоваться в составе комбинированной терапии.
Противопоказания
индивидуальная непереносимость ребамипида или других компонентов препарата;
беременность;
период лактации;
детский возраст до 18 лет.
С осторожностью: рекомендуется соблюдать осторожность при первом назначении ребамипида пациентам пожилого возраста в связи с возможностью возникновения повышенной чувствительности к препарату.
Применение при беременности и кормлении грудью
Безопасность применения ребамипида в период беременности не доказана. Не применять во время беременности.
Поскольку ребамипид проникает в грудное молоко, следует прекратить грудное вскармливание или решить вопрос об искусственном вскармливании ребенка в случае необходимости назначения матери ребамипида в период кормления грудью.
Способ применения и дозы
Внутрь, по 1 табл. 3 раза в сутки, запивая небольшим количеством жидкости. Курс лечения составляет 2–4 нед, в случае необходимости может быть продлен до 8 нед. Препарат не обладает особенностями действия при первом приеме или при его отмене. При пропуске приема одной дозы необходимо принять следующую дозу препарата в установленное время, не следует принимать удвоенную дозу препарата.
Побочные действия
Со стороны ЖКТ: запор, метеоризм, диарея, тошнота, рвота, боль в области живота, нарушение вкусовых ощущений, изжога.
Со стороны печени: признаки дисфункции печени, повышение сывороточной глютаминовой АЛТ и ACT.
Со стороны системы кроветворения: лейкопения, гранулоцитопения.
Аллергические реакции: зуд, кожная сыпь, экзематозные высыпания.
Другое: нарушение менструального цикла.
Взаимодействие
При применении ребамипида в составе традиционных схем терапии пациентов с инфицированием Helicobacter pylori эффективность эрадикационной терапии достоверно возрастает. Реакции взаимодействия с другими ЛС не изучены.
Передозировка
Симптомы передозировки ребамипида не описаны, до сегодняшнего дня сведений о случаях преднамеренной передозировки не поступало. Возможны тошнота, рвота, боль в животе, диарея или запор, головная боль.
Меры по оказанию помощи: специфический антидот неизвестен. В случае передозировки следует промыть желудок и проводить симптоматическую терапию.
Особые указания
Действие препарата на скорость психомоторных реакций и/или способность управлять транспортными средствами или механизмами не изучено. В случае приема препарата следует осторожно относиться к вождению автомобиля и другим видам деятельности, требующим повышенной концентрации внимания.
Форма выпуска
Таблетки, покрытые пленочной оболочкой, 100 мг. По 10 или 30 табл. в упаковке ячейковой контурной. По 30 табл. в банке полимерной типа БП из ПЭНД с крышкой из ПЭВД или во флаконе полимерном из ПЭНД с крышкой из ПЭВД.
Каждую банку, флакон, 3 упаковки ячейковые контурные по 10 табл. или 1, 2 упаковки ячейковые контурные по 30 табл. вместе с инструкцией по применению помещают в картонную пачку.
Производитель
НАО «Северная звезда», Россия, 188663, Ленинградская обл., Всеволожский муниципальный р-н, Кузьмоловское городское поселение, г.п. Кузьмоловский, ул. Заводская, 4; 4 корп. 1; 4 корп. 2.
Тел./факс: (812) 309-21-77.
Владелец регистрационного удостоверения/организация, принимающая претензии потребителя: НАО «Северная звезда», Россия.
Юридический адрес предприятия-производителя: 111524, Москва, ул. Электродная, 2, стр. 34, этаж 2, помещ. 47.
Адрес производителя и принятия претензий: 188663, Ленинградская обл., Всеволожский муниципальный р-н, Кузьмоловское городское поселение, г.п. Кузьмоловский, ул. Заводская, 4; 4 корп. 1; 4 корп. 2.
Тел./факс: (812) 309-21-77.
Условия отпуска из аптек
По рецепту.
Условия хранения
В защищенном от света месте, при температуре не выше 25 °C.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Ребамипид-СЗ (Rebamipide-SZ) инструкция по применению
📜 Инструкция по применению Ребамипид-СЗ
💊 Состав препарата Ребамипид-СЗ
✅ Применение препарата Ребамипид-СЗ
📅 Условия хранения Ребамипид-СЗ
⏳ Срок годности Ребамипид-СЗ
Актуальная Гастроэнтерология от Северной Звезды
Реклама. ООО Звезда Медиа erid:LatgBoUbV
Производство жидких лекарственных форм
Реклама. ООО Звезда Медиа erid:LatgBpV3H
В Ленобласти открылся новый корпус фармацевтического завода «Северная звезда»
Реклама. ООО Звезда Медиа erid:LatgBppXD
Фармзавод «Северная Звезда» в Ленобласти запустил производство спреев, глазных капель и инъекционных растворов
Реклама. ООО Звезда Медиа erid:LatgBuXGF
25 лет НАО «Северная звезда»
Гастропротекторы на страже слизистой желудка
Это видео содержит информацию, доступ к
которой могут иметь только специалисты в области медицины и фармации
Вы являетесь специалистом?
Да
Нет

Описание лекарственного препарата
Ребамипид-СЗ
(Rebamipide-SZ)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для электронного издания справочника Видаль 2023
года, дата обновления: 2023.01.31
Лекарственная форма
| Ребамипид-СЗ |
Таб., покр. пленочной оболочкой, 100 мг: 30, 60 или 90 шт. рег. №: ЛП-006193 |
Форма выпуска, упаковка и состав
препарата Ребамипид-СЗ
Таблетки, покрытые пленочной оболочкой белого или почти белого цвета, круглые, двояковыпуклые; на поперечном разрезе ядро таблетки белого или почти белого цвета.
Вспомогательные вещества: целлюлоза микрокристаллическая 102 — 56.7 мг, крахмал прежелатинизированный (крахмал 1500) — 46.8 мг, гипромеллоза (гидроксипропилметилцеллюлоза) — 5.8 мг, коллидон SR (поливинилацетат 80%, повидон 19%, натрия лаурилсульфат 0.8%, кремния диоксид 0.2%) — 19.2 мг, лимонная кислота — 2.3 мг, натрия лаурилсульфат — 2 мг, тальк — 4.8 мг, магния стеарат — 2.4 мг.
Состав оболочки: гипромеллоза — 3.57 мг, полисорбат-80 (твин-80) — 1.49 мг, тальк — 1.19 мг, титана диоксид (E171) — 0.75 мг.
10 шт. — упаковки ячейковые контурные (3) — пачки картонные.
30 шт. — упаковки ячейковые контурные (1) — пачки картонные.
30 шт. — упаковки ячейковые контурные (2) — пачки картонные.
30 шт. — упаковки ячейковые контурные (3) — пачки картонные.
30 шт. — банки полимерные (1) — пачки картонные.
30 шт. — флаконы полимерные (1) — пачки картонные.
Фармакологическое действие
Ребамипид повышает содержание простагландина Е2 (PGE2) в слизистой оболочке желудка и повышает содержание PGE2 и GI2 в содержимом желудочного сока. Оказывает цитопротекторное действие в отношении слизистой оболочки желудка при повреждающем воздействии этанола, кислот и щелочей, ацетилсалициловой кислоты. Способствует активации энзимов, ускоряющих биосинтез высокомолекулярных гликопротеинов, и повышает содержание слизи на поверхности стенки желудка.
Способствует улучшению кровоснабжения слизистой оболочки желудка, активизирует ее барьерную функцию, активизирует щелочную секрецию желудка, усиливает пролиферацию и обмен эпителиальных клеток желудка, очищает слизистую оболочку от гидроксильных радикалов и подавляет супероксиды, продуцируемые полиморфно-ядерными лейкоцитами и нейтрофилами в присутствии Helicobacter pylori, защищает слизистую оболочку желудка от поражения бактериями, оказывает гастропротекторное действие при воздействии на слизистую оболочку НПВП.
Фармакокинетика
Всасывание и распределение
Абсорбция при приеме внутрь – высокая. После приема в дозе 100 мг Сmax в плазме крови достигается приблизительно через 2 ч и составляет 340 нг/мл.
В опытах in vitro показано, что от 98.4% до 98.6% препарата связывается белками плазмы.
Метаболизм и выведение
При приеме в дозе 600 мг удается выделить следы гидроксилированного метаболита.
Т1/2 равен приблизительно 1 ч. Повторные приемы препарата не приводят к его кумуляции в организме. Приблизительно 10% препарата выводится почками, преимущественно в неизмененном виде.
Показания препарата
Ребамипид-СЗ
- язвенная болезнь желудка;
- хронический гастрит с повышенной кислотообразующей функцией желудка в стадии обострения;
- эрозивный гастрит;
- предотвращение возникновения повреждений слизистой оболочки на фоне приема НПВП.
Может использоваться в составе комбинированной терапии.
Режим дозирования
Препарат принимают внутрь, по 1 таблетке 3 раза/сут, запивая небольшим количеством жидкости.
Курс лечения составляет 2–4 недели, в случае необходимости может быть продлен до 8 недель.
Препарат не обладает особенностями действия при первом приеме или при его отмене.
При пропуске приема одной дозы необходимо принять следующую дозу препарата в установленное время, не следует принимать удвоенную дозу препарата.
Побочное действие
Со стороны пищеварительной системы: запор, метеоризм, диарея, тошнота, рвота, боль в области живота, нарушение вкусовых ощущений, изжога.
Со стороны печени: признаки дисфункции печени, повышение сывороточной АЛТ и сывороточной ACT.
Со стороны системы кроветворения: лейкопения, гранулоцитопения.
Аллергические реакции: зуд, кожная сыпь, экзематозные высыпания.
Другое: нарушение менструального цикла.
Противопоказания к применению
- индивидуальная непереносимость ребамипида или других компонентов препарата;
- беременность;
- период лактации;
- детский возраст до 18 лет.
С осторожностью
Рекомендуется соблюдать осторожность при первом назначении ребамипида пациентам пожилого возраста в связи с возможностью возникновения повышенной чувствительности к препарату.
Применение при беременности и кормлении грудью
Безопасность применения ребамипида в период беременности не доказана. Не применять во время беременности.
Поскольку ребамипид проникает в грудное молоко, следует прекратить грудное вскармливание или решить вопрос об искусственном вскармливании ребенка в случае необходимости назначения матери ребамипида в период кормления грудью.
Применение у детей
Противопоказано применение препарата в детском возрасте до 18 лет.
Применение у пожилых пациентов
Рекомендуется соблюдать осторожность при первом назначении ребамипида пациентам пожилого возраста в связи с возможностью возникновения повышенной чувствительности к препарату.
Особые указания
Влияние на способность к управлению транспортными средствами и механизмами
Действие препарата на скорость психомоторных реакций и/или способность управлять транспортными средствами или механизмами не изучено. В случае приема препарата следует осторожно относиться к вождению автомобиля и другим видам деятельности, требующих повышенной концентрации внимания.
Передозировка
Симптомы передозировки ребамипидом не описаны, до сегодняшнего дня сведений о случаях преднамеренной передозировки не поступало. Возможны тошнота, рвота, боль в животе, диарея или запор, головная боль.
Лечение: специфический антидот неизвестен. В случае передозировки следует промыть желудок и проводить симптоматическую терапию.
Лекарственное взаимодействие
При применении ребамипида в составе традиционных схем терапии пациентов с инфицированием Helicobacter pylori, эффективность эрадикационной терапии достоверно возрастает.
Реакции взаимодействия с другими лекарственными средствами не изучены.
Условия хранения препарата Ребамипид-СЗ
Препарат следует хранить в недоступном для детей, защищенном от света месте при температуре не выше 25°С.
Срок годности препарата Ребамипид-СЗ
Срок годности — 3 года. Не использовать по истечении срока годности, указанного на упаковке.
Условия реализации
Препарат отпускается по рецепту.
Контакты для обращений
СЕВЕРНАЯ ЗВЕЗДА НАО
(Россия)

|
|
СЕВЕРНАЯ ЗВЕЗДА НАО 111524 Москва, |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Ребамипид Канон — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-007696
Торговое наименование:
Ребамипид Канон
Международное непатентованное наименование:
ребамипид
Лекарственная форма:
таблетки, покрытые пленочной оболочкой
Состав
1 таблетка, покрытая пленочной оболочкой, содержит:
действующее вещество: ребамипид 100,0 мг.
вспомогательные вещества: крахмал кукурузный 64,7 мг, кремния диоксид коллоидный 2,4 мг, кроскармеллоза натрия 14,0 мг, лимонная кислота 2,3 мг, магния стеарат 2,4 мг, маннитол 48,0 мг, натрия лаурилсульфат 2,0 мг, повидон К-30 4,2 мг.
пленочная оболочка: Опадрай 20А28380 белый 8,0 мг, в том числе: гипромеллоза (гидроксипропилметил-целлюлоза) 2,7 мг, гипролоза (гидроксипропилцеллюлоза) 2,7 мг, тальк 1,6 мг, титана диоксид 1,0 мг.
Описание
Таблетки круглые двояковыпуклые, покрытые пленочной оболочкой белого или почти белого цвета. На поперечном разрезе почти белого цвета.
Фармакотерапевтическая группа:
гастропротекторное средство
Код ATX:
А02ВХ14
Фармакологические свойства
Фармакодинамика
Ребамипид повышает содержание простагландина Е2 (PGE2) в слизистой желудка, и повышает содержание PGE2 и GI2 в содержимом желудочного сока. Оказывает цитопротекторное действие в отношении слизистой желудка при повреждающем воздействии этанола, кислот и щелочей, ацетилсалициловой кислоты. Способствует активации энзимов, ускоряющих биосинтез высокомолекулярных гликопротеинов, и повышает содержание слизи на поверхности стенки желудка. Способствует улучшению кровоснабжения слизистой желудка, активизирует ее барьерную функцию, активизирует щелочную секрецию желудка, усиливает пролиферацию и обмен эпителиальных клеток желудка, очищает слизистую от гидроксильных радикалов и подавляет супероксиды, продуцируемые полиморфноядерными лейкоцитами и нейтрофилами в присутствии Helicobacter pylori, защищает слизистую желудка от поражения бактериями, оказывает гастропротекторное действие при воздействии на слизистую нестероидными противовоспалительными препаратами (НПВП).
Фармакокинетика
Абсорбция при приеме внутрь — высокая. После приема в дозе 100 мг пик концентрации в плазме крови (Сmax) достигается приблизительно через 2 ч и составляет 340 нг/мл. Период полувыведения (Т1/2) равен приблизительно 1,0 ч. Повторные приемы препарата не приводят к его кумуляции в организме. Приблизительно 10 % препарата выводится почками, преимущественно в неизмененном виде. При приеме в дозе 600 мг удается выделить следы гидроксилированного метаболита.
В опытах in vitro показано, что от 98,4 % до 98,6 % препарата связывается белками плазмы.
Показания к применению
Язвенная болезнь желудка. Хронический гастрит с повышенной кислотообразующей функцией желудка в стадии обострения, эрозивный гастрит. Предотвращение возникновения повреждений слизистой оболочки на фоне приема нестероидных противовоспалительных средств. Может использоваться в составе комбинированной терапии.
Противопоказания к применению
— Индивидуальная непереносимость ребамипида или других компонентов препарата.
— Беременность.
— Период лактации.
— Дети в возрасте до 18 лет.
С осторожностью
Рекомендуется соблюдать осторожность при первом назначении ребамипида пациентам с пожилого возраста в связи с возможностью возникновения повышенной чувствительности к препарату.
Применение при беременности и в период грудного вскармливания
Безопасность применения ребамипида в период беременности не доказана. Не применять во время беременности. Поскольку ребамипид проникает в грудное молоко, следует прекратить грудное вскармливание или решить вопрос об искусственном вскармливании ребенка в случае необходимости назначения матери ребамипида в период кормления грудью.
Способ применения и дозы
Внутрь, по 1 таблетке 3 раза в сутки (утром, в обед и вечером или утром, вечером и перед сном, в соответствии с образом жизни пациента), запивая небольшим количеством жидкости. Курс лечения составляет 2 — 4 недели, в случае необходимости может быть продлен до 8 недель.
Препарат не обладает особенностями действия при первом приеме или при его отмене.
При пропуске приема одной дозы необходимо принять следующую дозу препарата в установленное время, не следует принимать удвоенную дозу препарата.
Побочные реакции
Со стороны желудочно-кишечного тракта: запор, метеоризм, диарея, тошнота, рвота, боль в области живота, нарушение вкусовых ощущений, изжога.
Со стороны печени: признаки дисфункции печени, повышение сывороточной глютаминовой аланинаминотрансферазы (АЛТ) и сывороточной глютаминовой аспартатаминотрансферазы (ACT).
Со стороны системы кроветворения: лейкопения, гранулоцитопения.
Аллергические реакции: зуд, кожная сыпь, экзематозные высыпания.
Другое: нарушение менструального цикла.
Передозировка
Симптомы передозировки ребамипидом не описаны, до сегодняшнего дня сведений о случаях преднамеренной передозировки не поступало. Возможны тошнота, рвота, боль в животе, диарея или запор, головная боль. Меры по оказанию помощи: специфический антидот неизвестен. В случае передозировки следует промыть желудок и проводить симптоматическую терапию.
Взаимодействие с другими лекарственными средствами
При применении ребамипида в составе традиционных схем терапии пациентов с инфицированием Helicobacter pylori, эффективность эрадикационной терапии достоверно возрастает.
Реакции взаимодействия с другими лекарственными средствами не изучены.
Влияние на способность управлять транспортными средствами, механизмами
Действие препарата на скорость психомоторных реакций и/или способность управлять транспортными средствами или механизмами не изучено. В случае приема препарата следует осторожно относиться к вождению автомобиля и другим видам деятельности, требующих, повышенной концентрации внимания.
Форма выпуска
Таблетки, покрытые пленочной оболочкой, 100 мг.
По 10 или 30 таблеток в контурную ячейковую упаковку из пленки ПВХ/ПХТФЭ или ПВХ/ПЭ/ПВДХ и фольги алюминиевой печатной лакированной.
По 60 или 90 таблеток в банку полимерную для лекарственных средств из полиэтилена низкого давления с крышкой из полиэтилена или полиэтилентерефталата с крышкой из полипропилена или полиэтилена высокого давления.
По 1 или 3 контурных ячейковых упаковки или по 1 банке полимерной для лекарственных средств вместе с инструкцией по применению помещают в пачку из картона.
Срок годности
2 года. Не применять после истечения срока годности.
Условия хранения
При температуре не выше 25 °С.
Хранить в недоступном для детей месте.
Условия отпуска
Отпускают по рецепту.
Владелец регистрационного удостоверения/ организация, принимающая претензии потребителей
ЗАО «Канонфарма продакшн», Россия
141100, Московская обл., Щелковский район, г. Щелково, ул. Заречная, д. 105.
Производитель
ЗАО «Канонфарма продакшн»
Производство готовой лекарственной формы:
Московская обл., г.о. Щёлково, г. Щёлково, ул. Заречная, д. 105;
Московская обл., г.о. Щёлково, г. Щёлково, ул. Заречная, стр. 105Б, к. 12.
Первичная упаковка:
Московская обл., г.о. Щёлково, г. Щёлково, ул. Заречная, д. 105;
Московская обл., г.о. Щёлково, г. Щёлково, ул. Заречная, стр. 105Б, к. 12.
Вторич ная (потребительская) упаковка:
Московская обл., г.о. Щёлково, г. Щёлково, ул. Заречная, д. 105;
Московская обл., г.о. Щёлково, г. Щёлково, ул. Заречная, стр. 105Б, к. 12;
Московская обл., г.о. Щёлково, г. Щёлково, ул. Заречная, стр. 105Б, к. 1.
Выпускающий контроль качества
Московская обл., г.о. Щёлково, г. Щёлково, ул. Заречная, стр. 105Б, к. 11.
Купить Ребамипид Канон в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Несмотря на успехи в области диагностики и лечения, рак желудка остается серьезной проблемой в мировом масштабе, занимая пятое место по уровню заболеваемости и третье — в структуре смертности от онкологических заболеваний [1–2]. Самые высокие показатели отмечаются в странах Восточной и Центральной Азии, Латинской Америки, самые низкие — в Северной Америке. В Восточной Азии заболеваемость раком желудка составляет 32,1 на 100 000 у мужчин, 13,2 — у женщин, в Южной Корее — 57,8 и 23,5 на 100 000, в Японии 40,7 и 16,0 на 100 000 для мужчин и женщин соответственно [1–2]. Наименьшая заболеваемость наблюдается в Соединенных Штатах (5,5 на 100 000 у мужчин; 2,8 у женщин) [1]. Россия относится к странам с умеренным риском рака желудка, наряду с Португалией, Сингапуром, Эстонией. В 2018 г. в структуре заболеваемости удельный вес опухолей желудка составил 20,4 на 100 000 населения у мужчин и 8,8 на 100 000 населения у женщин [3]. Улучшение эпидемиологической ситуации по раку желудка наблюдается, как правило, в странах, где разработаны профилактические мероприятия, высокий уровень осведомленности населения и длительное время существуют национальные программы ведения пациентов с предраковыми заболеваниями и скрининга [4].
Целью представленного обзора является обобщение существующих международных рекомендаций по ведению пациентов с атрофическим гастритом, кишечной метаплазией и дисплазией желудка.
В 2012 г. Европейским обществом гастроинтестинальной эндоскопии (ESGE), Европейской группой по изучению Helicobacter pylori и микробиоты (EHMSG), Европейским обществом патологов (ESP) и Португальским обществом гастроинтестинальной эндоскопии (SPED) были разработаны первые международные рекомендации по лечению предраковых состояний и изменений желудка (MAPS). В 2019 г. опубликована обновленная версия рекомендаций под названием MAPS II [4]. Данные рекомендации были представлены на рассмотрение в разных странах.
Рак желудка — злокачественная опухоль, развивающаяся из эпителия слизистой оболочки желудка, которая представлена гетерогенной группой новообразований. Различные формы имеют свои специфические характеристики, знание которых позволит оптимизировать диагностику рака желудка на ранних стадиях. На основе гистологических характеристик рак желудка может быть представлен: кишечным типом (строение опухоли сходно с раком кишки, характерны отчетливые железистые структуры, состоящие из высокодифференцированного цилиндрического эпителия с развитой щеточной каемкой); диффузным типом (опухоль представлена слабо организованными группами или одиночными клетками с большим содержанием муцина (перстневидные клетки), характерен диффузный инфильтративный рост) и смешанным типом (в опухоли присутствуют участки и кишечного, и диффузного типа) [5]. Дифференцированный тип чаще встречается у пожилых мужчин и развивается медленно, тогда как диффузный тип чаще встречается у женщин более молодого возраста и имеет худший прогноз [5].
Обзор представленных рекомендаций не распространяется на наследственный/семейный диффузный рак желудка, для которого разработаны специальные рекомендации [6].
Аденокарцинома желудка кишечного типа представляет собой окончательный исход последовательности «воспаление — атрофия — метаплазия — дисплазия — карцинома», известной как каскад Корреа [7–11].
Рекомендация 1 (MAPS II). Пациенты с хроническим атрофическим гастритом или кишечной метаплазией подвержены риску развития аденокарциномы желудка (высокий уровень доказательности) [4].
Хронический атрофический гастрит и кишечную метаплазию (КМ) рассматривают как предраковые состояния, поскольку они сами по себе связаны с риском развития рака желудка и на их фоне возможно развитие дисплазии и аденокарциномы [7–11].
Рекомендация 2 (MAPS II). Гистологически подтвержденная кишечная метаплазия — наиболее надежный маркер атрофии слизистой оболочки желудка (высокий уровень доказательности) [4].
Рекомендация 3 (MAPS II). Необходимо выявлять пациентов с гастритом на поздних стадиях, т. е. с атрофией и (или) кишечной метаплазией, влияющей на слизистую оболочку как антрального отдела желудка, так и тела желудка, поскольку считается, что они подвержены более высокому риску развития аденокарциномы желудка (умеренный уровень доказательности, сильная рекомендация).
Рекомендация 4 (MAPS II). Дисплазию тяжелой степени и инвазивную карциному следует рассматривать как исходы, которые необходимо предотвратить при лечении пациентов с хроническим атрофическим гастритом или кишечной метаплазией (умеренный уровень доказательности, сильная рекомендация).
Рекомендация 5 (MAPS II). У пациентов с эндоскопически определяемыми патологическими изменениями, указывающими на дисплазию легкой или тяжелой степени или карциному, следует определить стадию заболевания и начать лечение (высокий уровень доказательности, сильная рекомендация).
Рекомендация 6 (MAPS II). Эндоскопия высокого разрешения в сочетании с хромоэндоскопией (ХЭ) более эффективна, чем эндоскопия высокого разрешения в белом свете, при диагностике предраковых состояний желудка и неопластических поражений на ранней стадии (высокий уровень доказательности).
Рекомендация 7 (MAPS II). При наличии возможности и после надлежащего обучения для диагностики предраковых состояний желудка следует применять виртуальную ХЭ с увеличением или без увеличения изображения, что позволяет выполнять контролируемую биопсию на участках атрофических и метапластических изменений, а также обеспечивает выявление неопластических поражений (умеренный уровень доказательности, сильная рекомендация).
Рекомендация 8 (MAPS II). Для надлежащего определения стадии предраковых состояний желудка первая диагностическая эндоскопия верхнего отдела желудочно-кишечного тракта должна включать взятие биопсийных образцов из желудка для определения наличия инфекции H. pylori и выявления атрофического гастрита на поздних стадиях (умеренный уровень доказательности, сильная рекомендация) [4].
Рекомендация 9 (MAPS II). Следует выполнить биопсию как минимум на двух топографических участках (по малой и большой кривизне, как в антральном отделе желудка, так и в теле желудка), используя две отдельные четко маркированные пробирки. Следует дополнительно выполнить биопсию видимых предполагаемых неопластических поражений (умеренный уровень доказательности, сильная рекомендация) [4].
Рекомендация 10 (MAPS II). Если эти системы применяются для стратификации пациентов, следует рассмотреть возможность выполнения дополнительной биопсии из угла желудка (умеренный уровень доказательности, слабая рекомендация) [4].
Данный подход позволяет обеспечить максимальную степень выявления пациентов с предраковыми состояниями, в особенности в случаях, когда применение ХЭ для прицельной биопсии невозможно.
Рекомендация 11 (MAPS II). Для выявления пациентов с гастритом на поздних стадиях можно использовать системы гистопатологического определения стадии заболевания (например, оперативную систему оценки гастрита (OLGA) и оперативную систему оценки гастрита, основанную на кишечной метаплазии (OLGIM)). Если эти системы применяются для стратификации пациентов, следует рассмотреть возможность выполнения дополнительной биопсии вырезки (умеренный уровень доказательности, слабая рекомендация) [4]. Стадии III и IV могут указывать на пациентов, подверженных более высокому риску развития рака желудка [12].
В случае выявления патологического изменения и результатов эндоскопической оценки, указывающих на наличие дисплазии, рекомендуется проводить резекцию патологического участка без дополнительной биопсии [4].
При наличии возможности для диагностики предраковых состояний желудка следует применять виртуальную ХЭ с увеличением или без увеличения изображения, что позволяет выполнять контролируемую биопсию на участках атрофических и метапластических изменений, а также обеспечивает выявление неопластических поражений. Эндоскопия высокого разрешения в сочетании с хромоэндоскопией более эффективна, чем эндоскопия высокого разрешения в белом свете, при диагностике предраковых состояний желудка и неопластических поражений на ранней стадии. Если при такой эндоскопии высокого разрешения не выявлены патологические изменения, рекомендуется выполнить биопсию для определения стадии гастрита (если ее не выполняли ранее) и эндоскопическое наблюдение в течение от 6 месяцев (при дисплазии тяжелой степени) до 12 месяцев (при дисплазии легкой степени) [4].
Дисплазия желудка представляет собой предпоследнюю стадию последовательности желудочного канцерогенеза. Ее определяют как гистологически подтвержденные неопластические изменения эпителия без признаков тканевой инвазии, что указывает на непосредственное неопластическое предраковое изменение [13]. Всемирная организация здравоохранения подтвердила классификацию дисплазии/интраэпителиальной неоплазии [14]:
- Интраэпителиальная неоплазия/дисплазия включает явные эпителиальные и опухолевые пролиферации, характеризующиеся различной клеточной и архитектонической атипией, но без убедительных признаков инвазии.
- Интраэпителиальная неоплазия/дисплазия легкой степени характеризуется минимальной архитектонической неупорядоченностью и цитологической атипией легкой или умеренной степени.
- Интраэпителиальная неоплазия/дисплазия тяжелой степени характеризуется наличием опухолевых клеток, обычно кубовидных, а не цилиндрических, с большим ядерно-цитоплазматическим отношением, определяемых амфофильными ядрышками, более выраженной архитектонической неупорядоченностью и многочисленными митозами, которые могут быть атипичными. Важно отметить, что ядрышки часто достигают люминальной поверхности клетки, а полярность ядер обычно утрачивается. Большинство пациентов с патологическими изменениями, классифицируемыми как дисплазия тяжелой степени, подвержены высокому риску одновременного или быстрого развития инвазивной карциномы.
- Внутрислизистая инвазивная неоплазия/внутрислизистая карцинома включает в себя разновидности карциномы, прорастающие в собственную пластинку слизистой оболочки и отличающиеся от интраэпителиальной неоплазии/дисплазии не только по наличию десмопластических изменений, которые могут быть минимальными или отсутствовать, но и по наличию характерных структурных аномалий, таких как выраженная скученность желез, избыточное ветвление, прорастание, а также сращение или крибриформные структуры желез. Диагноз «внутрислизистая карцинома» указывает на повышенный риск прорастания лимфатических сосудов и метастатического поражения лимфоузлов.
Диагноз «неопределенная дисплазия/неоплазия» не следует изначально рассматривать как безобидный, несмотря на то, что у большинства пациентов прогноз будет благоприятным. В действительности в одном из исследований было установлено, что 26,8% резецированных поражений, классифицированных как неопределенная дисплазия/неоплазия по результатам биопсии перед резекцией, фактически представляли собой неопластические поражения (5,0% — аденома и 21,8% — ранний рак желудка) [15].
Следует помнить, что даже дисплазия легкой степени (ДЛС) может представлять собой злокачественное новообразование. Согласно результатам метаанализа, в котором оценивали повышение стадии желудочной ДЛС после эндоскопической резекции, данное явление наблюдалось в 25% патологических изменений, а в 7% этих случаев было выявлено повышение стадии до злокачественного новообразования [16].
В случае видимых патологических изменений одной эндоскопической биопсии не достаточно для диагностики злокачественного новообразования, при наличии любого эндоскопически определяемого патологического изменения с любыми неопластическими изменениями необходимо производить его эндоскопическую резекцию [4].
Рекомендуется проверка гистологических препаратов и немедленная (в кратчайшие возможные сроки) повторная оценка с применением эндоскопии высокого разрешения и ХЭ [4].
При отсутствии эндоскопически определяемых патологических изменений у пациентов с дисплазией рекомендуется выполнять немедленную повторную оценку с применением эндоскопии высокого разрешения и ХЭ (виртуальной или с применением красителя) [4].
Пациентам с неопределенной дисплазией, дисплазией, как и с карциномой, диагностированными на основании результатов неприцельной биопсии, необходимо дообследование и лечение только в клиниках, специализирующихся на диагностике и эндоскопическом лечении рака желудка [4].
Неинвазивные методы диагностики предраковых изменений слизистой оболочки желудка
Низкий уровень пепсиногена I в сыворотке крови и (или) низкое соотношение пепсиногена I/II позволяют выявить пациентов с атрофическим гастритом на поздних стадиях. У таких пациентов рекомендуется выполнять эндоскопию, в особенности при отрицательном результате серологического теста на H. pylori. В качестве предельных значений указывается уровень пепсиногена I < 70 нг/мл и соотношение пепсиногена I/II < 3. Чувствительность и специфичность диагностики рака желудка составили 0,69 (95% ДИ 0,60–0,76) и 0,73 (95% ДИ 0,62–0,82) соответственно [24]. Эти предельные значения широко применяют при обследовании на выявление рака желудка в Японии [25].
Рекомендация 12 (MAPS II). Низкий уровень пепсиногена I в сыворотке крови и (или) низкое соотношение пепсиногена I/II позволяют выявить пациентов с атрофическим гастритом на поздних стадиях. У таких пациентов рекомендуется выполнять эндоскопию, в особенности при отрицательном результате серологического теста на H. pylori (умеренный уровень доказательности, слабая рекомендация).
Семейный анамнез
Несмотря на то, что в большинстве случаев развитие рака желудка носит спорадический характер, в 10% случаев в той или иной мере наблюдается его семейное накопление [17].
Выше было показано [12], что пациенты с дисплазией, обширной атрофией/КМ и (или) стадией III/IV согласно OLGA/OLGIM подвержены существенно более высокому риску рака и рекомендуется выполнять эндоскопическое наблюдение у таких пациентов, в идеале — с применением эндоскопии высокого разрешения. Тем не менее риск развития рака желудка также возрастает, хотя и в меньшей степени, у пациентов с менее тяжелыми стадиями предраковых изменений, например, с очаговой КМ (стадия I/II согласно OLGIM), в особенности при наличии КМ и (или) рака желудка в семейном анамнезе [4].
Наличие ближайшего родственника с раком желудка представляет собой устойчивый фактор риска развития данного заболевания, при отношении шансов от 2 до 10, в зависимости от географического региона и этнической принадлежности [18]. Важно отметить, что коррекция на факторы окружающей среды не влияет на данный риск. Наличие родственника второй степени с раком желудка также повышает риск развития данного заболевания, хотя и в меньшей степени [19]. Отягощенный семейный анамнез в отношении рака желудка обусловлен унаследованной генетической предрасположенностью, общими факторами окружающей среды или образа жизни, общей предрасположенностью к инфекции H. pylori, общим цитотоксичным штаммом H. pylori или сочетанием этих факторов. Соответственно, согласно результатам метаанализа, у ближайших родственников пациентов с раком желудка наблюдается повышенная частота возникновения инфекций H. pylori (ОШ 1,93), атрофии желудка (ОШ 2,2) и КМ (ОШ 1,98) [20]. Кроме того, у ближайших родственников пациентов с ранним раком желудка наблюдается повышенная частота возникновения тяжелых стадий гастрита (стадия III/IV согласно OLGA) и дисплазии, что, судя по всему, связано с высокой вирулентностью штаммов H. pylori и провоспалительными генотипами организма-хозяина [21].
Таким образом, эти данные свидетельствуют о том, что у ближайших родственников пациентов с раком желудка наблюдается повышенная частота возникновения инфекций H. pylori и предраковых состояний/изменений, а также повышенный риск развития рака желудка.
Выявлен повышенный риск прогрессирования у пациентов с КМ и раком желудка в семейном анамнезе (р = 0,002) [22]. В итальянской когорте семейный анамнез был также связан с более высоким риском прогрессирования у пациентов с атрофией желудка, хотя данные результаты не были статистически значимыми [23]. Несмотря на немногочисленность данных, согласно которым предраковые состояния у родственников пациента с раком желудка прогрессируют до рака быстрее за счет канцерогенного каскада по сравнению с аналогичными состояниями у соответствующих контрольных пациентов в общей популяции, кажется целесообразным рекомендовать более интенсивное последующее наблюдение у пациентов с обширной атрофией/КМ и при наличии рака желудка у ближайшего родственника в семейном анамнезе.
Пациентам с обширной КМ, а также со стойкой инфекцией H. pylori, или неполной КМ, или, в особенности, при наличии рака желудка у ближайшего родственника в семейном анамнезе необходимо более частое эндоскопическое наблюдение (например, каждые 1–2 года). Данные рекомендации не распространяются на наследственный/семейный диффузный рак желудка, для которого разработаны специальные рекомендации [6].
Аутоиммунный гастрит
Аутоиммунный гастрит — это хроническое прогрессирующее воспалительное заболевание, приводящее к замене париетальных клеток атрофической и метапластической слизистой оболочкой, в результате чего развивается атрофический гастрит, преимущественно поражающий тело желудка, снижается или прекращается образование кислоты и прекращается выработка внутреннего фактора, что может привести к развитию тяжелой формы анемии, обусловленной дефицитом витамина В12 и известной как пернициозная анемия. Некоторые существующие данные позволяют предположить, что аутоиммунный гастрит — это предраковое состояние, при котором оправдано проведение эндоскопического мониторинга. Тем не менее рекомендованный интервал последующего наблюдения в настоящее время не установлен.
Поскольку максимальный повышенный риск развития рака желудка у пациентов с пернициозной анемией наблюдается в течение первого года последующего наблюдения [26, 27], некоторые данные позволяют рекомендовать проведение эндоскопического обследования у всех пациентов на момент постановки диагноза.
С учетом неоднородности описанных когорт и отсутствия более масштабных рандомизированных клинических исследований (РКИ) с более длительным периодом последующего наблюдения, рекомендуется выполнять эндоскопию в рамках последующего наблюдения с интервалом 3–5 лет у пациентов с аутоиммунным гастритом [4].
Динамическое наблюдение
В регионах с умеренным и высоким риском выявление пациентов с предраковыми состояниями желудка и наблюдение за ними позволяют снизить затраты на лечение [4].
Подходы к терапии
Основная цель при лечении пациентов с хроническим атрофическим гастритом или кишечной метаплазией — профилактика прогрессирования процесса до дисплазии и инвазивной карциномы.
Эрадикация H. pylori
Эрадикация H. pylori способствует купированию хронического воспаления и может привести к регрессии атрофического гастрита, снижая риск развития рака желудка у пациентов с неатрофическим и атрофическим гастритом [28].
У пациентов с КМ тяжелой степени эрадикация H. pylori, как правило, не приводит к существенному снижению риска развития рака желудка, как минимум в краткосрочной перспективе, однако обеспечивает снижение воспаления и атрофии, поэтому у таких пациентов следует рассмотреть возможность ее применения [4]. Эрадикация H. pylori рекомендуется всем пациентам с неоплазией желудка после эндоскопической терапии [4].
Однако только проведение эрадикационной терапии не устраняет полностью риск, связанный с раком желудка. Остаточное воспаление по малой кривизне тела желудка после эрадикации H. pylori является фактором риска метахронного рака желудка [29, 30].
Ребамипид — гастропротекторное средство, показал способность улучшать состояние слизистой оболочки желудка, в частности, уменьшать степень инфильтрации мононуклеарными клетками, снижать уровень гастрина в сыворотке крови у пациентов с H. pylori-ассоциированным гастритом.
В 2015 г. были опубликованы два крупных исследования, цель которых — оценить гистологические изменения слизистой оболочки желудка у пациентов, получавших лечение ребамипидом после эрадикации H. pylori.
В исследование, проведенное в Японии в 2015 г. [31], было включено 206 пациентов, перенесших эрадикацию H. pylori. Из них 169 пациентов, добившихся успешной эрадикации, были рандомизированы в две группы: группу ребамипида (n = 82) и группу нелеченых (n = 87). Основные конечные точки были гистопатологическими заключениями согласно обновленной Сиднейской классификации хронического гастрита (1996 г.) в начале изучения и после 1 года. Полученные результаты: хроническое воспаление в области малой кривизны тела желудка было значительно меньше в группе пациентов, принимавших ребамипид, по сравнению с группой нелеченых пациентов.
В другом исследовании [32] с участием 178 пациентов также оценено влияние ребамипида на прогрессирование хронического гастрита. Иммуногистохимическое исследование слизистой оболочки желудка проводили с использованием маркеров метаплазии CDX2 и TFF3.
Выявлены достоверные различия между результатами лечения и контрольными группами по клиническим показателям симптомов (2,62 ± 1,86 против 1,55 ± 1,61, p = 0,0001), площади поражения (0,57 ± 1,05 против 0,16 ± 0,90, p = 0,002) и степени воспаления.
У пролеченных пациентов показатели кишечной метаплазии (p = 0,017 против p = 0,123) и интраэпителиальной неоплазии легкой степени достоверно снижались через 26 недель лечения (p = 0,005 против p = 0,226). Процент CDX2-экспрессирующих клеток — 31,5% (против 15,7%, p = 0,021), процент TFF3-экспрессирующих клеток — 44,9% (против 25,8%, p = 0,012). Полученные результаты позволили авторам сделать вывод, что применение ребамипида эффективно снижает степень воспаления, выраженность кишечной метаплазии и дисплазии легкой степени.
Данные об эффективности ребамипида в снижении степени предраковых изменений были получены в общей сложности при участии 280 пациентов с хроническим гастритом при применении препарата в течение 6–12 месяцев после эрадикации H. pylori.
Ребамипид впервые как цитопротективное средство одобрен для терапевтического применения в Японии в конце XX века. Изначально в экспериментальных работах было продемонстрировано, что механизм действия препарата заключается в индукции синтеза простагландинов Е2 и I2 в слизистой оболочке желудочно-кишечного тракта (ЖКТ), что обусловливает улучшение кровотока, снижение проницаемости слизистой оболочки, повышение секреции желудочной слизи, усиление экспрессии эпидермального фактора роста и его рецепторов в нормальной и поврежденной слизистой оболочке ЖКТ [33].
За последние годы в базе данных PubMed опубликовано около 70 статей, посвященных ребамипиду, более полно изучены его терапевтические эффекты, расширен спектр терапевтического применения.
В работе корейских ученых исследовалась скорость заживления дефекта слизистой оболочки после эндоскопической подслизистой диссекции по поводу аденомы или рака желудка in situ. Частота заживления дефекта в течение 4 нед после операции в группе комбинированной терапии ингибитором протонной помпы + ребамипидом оказалась достоверно выше, чем в группе монотерапии ингибитором протонной помпы (94,9% и 89,9% соответственно; р < 0,0001) [34].
В Китае исследовалось противовоспалительное действие ребамипида (исследование China-STARS), в котором сукральфат выступал в качестве препарата сравнения. В данном исследовании ребамипид превзошел сукральфат по скорости эпителизации эрозий в желудке [35].
В японском исследовании изучалась эффективность ребамипида при заживлении язв желудка после эрадикации H. pylori. Частота заживления язв в группе ребамипида была выше (80%), чем в группе плацебо (66,1%; р = 0,01) [36].
Японское исследование, результаты которого опубликованы в 2011 г., посвящено изучению энтеропротективного потенциала ребамипида. Частота выявления повреждений подвздошной кишки при проведении капсульной эндоскопии была достоверно меньше на 1-й и 4-й неделях лечения в группе принимающих ацетилсалициловую кислоту (АСК) 100 мг + омепразол 20 мг + ребамипид 300 мг, чем в группе терапии АСК 100 мг + омепразол 20 мг + плацебо [37].
В 2013 г. S. Zhang и соавт. [38] провели метаанализ, объединивший 338 публикаций, включая 15 рандомизированных исследований. На основании полученных данных авторы сделали следующие выводы: ребамипид достоверно эффективнее, чем плацебо, для лечения гастродуоденальных повреждений, индуцированных нестероидными противоспалительными препаратами (НПВП); эффективность ребамипида при лечении гастродуоденальных повреждений, индуцированных НПВП, сопоставима с ингибиторами протонной помпы, блокаторами Н2-рецепторов и мизопростолом; ребамипид достоверно эффективнее плацебо для лечения повреждений тонкой кишки, индуцированных НПВП (ОШ 2,7; 95% ДИ 1,02–7,16; р = 0,045).
С 2018 г. препарат включен в схемы эрадикационной терапии H. pylori [39].
Потенциальный антихеликобактерный эффект ребамипида подтвержден в ходе клинических исследований, в которых оценивали эффективность препарата в рамках схем эрадикационной терапии. Недавно проведенный мета-анализ 6 РКИ (611 пациентов) продемонстрировал эффективность ребамипида при включении его в состав эрадикационной терапии: 73,3% против 61,4%. Отношение шансов (ОШ) успешной эрадикации при сочетанном назначении ребамипида составило 1,74 (95% ДИ 1,19–2,53), а достоверных различий в частоте развития побочных эффектов в обеих группах не выявлено (ОШ 0,69; 95% ДИ 0,376–1,300; р = 0,329) [40].
Препарат характеризуется высокой абсорбцией при приеме внутрь, пиковая концентрация в плазме достигается через 2 ч, период полувыведения равен 1 ч, связь с белками около 98%. Повторные приемы препарата не приводят к его кумуляции в организме. Приблизительно 10% лекарственного средства выводятся почками, преимущественно в неизмененном виде. У препарата отсутствует лекарственное взаимодействие, препарат может применяться вне зависимости от приема пищи. Выраженные побочные эффекты при лечении ребамипидом не определяются [38].
Заключение
Рак желудка представляет серьезную медицинскую и социальную проблему как для большинства стран мира, так и для России. Пациенты с хроническим атрофическим гастритом или кишечной метаплазией имеют повышенный риск развития аденокарциномы желудка. Это подчеркивает важность диагностики и выявления групп риска у таких пациентов. Для данной цели предпочтительнее применять эндоскопию высокого разрешения в сочетании с хромоэндоскопией. Виртуальная хромоэндоскопия позволяет выполнять контролируемую биопсию на участках атрофических и метапластических изменений, а также обеспечивает выявление неопластических поражений. Биопсию следует выполнять как минимум на двух топографических участках (антральный отдел желудка и тело желудка). У пациентов с дисплазией при отсутствии эндоскопически определяемых патологических изменений рекомендуется выполнять немедленную повторную оценку с применением эндоскопии высокого разрешения и хромоэндоскопию. У пациентов с эндоскопически определяемыми патологическими изменениями, указывающими на дисплазию легкой или тяжелой степени или карциному, следует провести резекцию данного участка, определить стадию заболевания и начать лечение.
Эрадикация H. pylori способствует купированию проявлений хронического неатрофического гастрита и может привести к частичной регрессии атрофического гастрита, что снижает риск развития рака желудка. Эрадикация H. pylori также рекомендуется пациентам с неоплазией после эндоскопического лечения. В регионах с умеренным и высоким риском выявление пациентов с предраковыми состояниями желудка и наблюдение за ними позволяет снизить затраты на лечение.
Ребамипид обладает выраженным противовоспалительным потенциалом, способствует выведению активных радикалов кислорода и антихеликобактерной активностью, что позволяет использовать препарат как в схемах эрадикационной терапии H. pylori, так и в качестве цитопротективного препарата для профилактики прогрессирования предраковых изменений желудка.
Литература
- Bray F., Ferlay J., Soerjomataram I. et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries // CA Cancer J Clin. 2018; 68: 393–424.
- Areia M., Spaander M. C., Kuipers E. J. et al. Endoscopic screening for gastric cancer: A cost-utility analysis for countries with an intermediate gastric cancer risk // United European Gastroenterol J. 2018; 6: 192–202.
- Состояние онкологической помощи населению России в 2018 году / Под ред. А. Д. Каприна, В. В. Старинского, Г. В. Петровой. М.: МНИОИ им. П. А. Герцена, филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2019. 236 с.
- Pimentel-Nunes P., Libanio D., Marcos-Pinto R., Areia M., Leja M., Esposito G., Garrido M., Kikuste I., Megraud F., Matysiak-Budnik T., Annibale B., Dumonceau J.-M., Barros R., Flejou J.-F., Carneiro F., van Hooft J. E., Kuipers E. J., Dinis-Ribeiro M., Pedro P.-N. et al. Management of epithelial precancerous conditions and lesions in the stomach (MAPS II): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and Sociedade Portuguesa de Endoscopia Digestiva (SPED) guideline update 2019 // Endoscopy. 2019; 51.
- Клинические рекомендации. Рак желудка. Министерство здравоохранения РФ, 2018 г.
- Van der Post R. S., Vogelaar I. P., Carneiro F. et al. Hereditary diffuse gastric cancer: updated clinical guidelines with an emphasis on germline CDH1 mutation carriers // J Med Genet. 2015; 52: 361–374.
- Correa P. Human gastric carcinogenesis: a multistep and multifactorial process — First American Cancer Society Award Lecture on Cancer Epidemiology and Prevention // Cancer Res. 1992; 52: 6735–6740.
- Kapadia C. R. Gastric atrophy, metaplasia and dysplasia: a clinical perspective // J Clin Gastroenterol. 2003; 36: S29–36.
- Carneiro F., Machado J. C., David L. et al. Current thoughts on the histo- pathogenesis of gastric cancer // Eur J Cancer Prev. 2001; 10: 101–102.
- Ihamaki T., Sankkonen M., Siurala M. Long-term observation of subjects with normal mucosa and with superficial gastritis: results of 23–27 years’ follow-up examinations // Scand J Gastroenterol. 1978; 13: 771–775.
- Ormiston M. C., Gear M. W., Codling B. W. Five year follow-up study of gastritis // J Clin Pathol. 1982; 35: 757–760.
- Yue H., Shan L., Bin L. The significance of OLGA and OLGIM staging systems in the risk assessment of gastric cancer: a systematic review and meta-analysis // Gastric Cancer. 2018; 21: 579–587. Epub 19 февраля 2018 г.
- Correa P. Clinical implications of recent developments in gastric cancer pathology and epidemiology // Semin Oncol. 1985; 12: 2–1025.
- Lauwers G., Carneiro F., Graham D. et al. Gastric carcinoma. In: Theise N, ed. WHO Classification of tumours of the digestive system. Lyon: IARC Press; 2010: 48–58.
- Goo J. J., Choi C. W., Kang D. H. et al. Risk factors associated with diagnostic discrepancy of gastric indefinite neoplasia: Who need en bloc resection? // Surg Endosc. 2015; 29: 3761–3767.
- Zhao G., Xue M., Hu Y. et al. How commonly is the diagnosis of gastric low grade dysplasia upgraded following endoscopic resection? A meta-analysis // PLoS One. 2015; 10: e0132699.
- Oliveira C., Pinheiro H., Figueiredo J. et al. Familial gastric cancer: genetic susceptibility, pathology, and implications for management // Lancet Oncol. 2015; 16: e60–e70.
- Yaghoobi M., Bijarchi R., Narod S. A. Family history and the risk of gastric cancer // Br J Cancer. 2010; 102: 237–242.
- Safaee A., Moghimi-Dehkordi B., Fatemi S. R. et al. Family history of cancer and risk of gastric cancer in Iran // Asian Pac J Cancer Prev. 2011; 12: 3117–3120.
- Rokkas T., Sechopoulos P., Pistiolas D. et al. Helicobacter pylori infection and gastric histology in first-degree relatives of gastric cancer patients: a meta-analysis // Eur J Gastroenterol Hepatol. 2010; 22: 1128–1133.
- Marcos-Pinto R., Carneiro F., Dinis-Ribeiro M. et al. First-degree relatives of patients with early-onset gastric carcinoma show even at young ages a high prevalence of advanced OLGA/OLGIM stages and dysplasia // Aliment Pharmacol Ther. 2012; 35: 1451–1459.
- Reddy K. M., Chang J. I., Shi J. M. et al. Risk of gastric cancer among patients with intestinal metaplasia of the stomach in a US integrated health care system // Clin Gastroenterol Hepatol. 2016; 14: 1420–1425.
- Lahner E., Esposito G., Pilozzi E. et al. Occurrence of gastric cancer and carcinoids in atrophic gastritis during prospective long-term follow up // Scand J Gastroenterol. 2015; 50: 856–865.
- Huang Y. K., Yu J. C., Kang W. M. et al. Significance of serum pepsinogens as a biomarker for gastric cancer and atrophic gastritis screening: a systematic review and meta-analysis // PLoS One. 2015; 10: e0142080.
- Kitahara F., Kobayashi K., Sato T. et al. Accuracy of screening for gastric cancer using serum pepsinogen concentrations // Gut. 1999; 44: 693–697.
- Hsing A. W., Hansson L. E., McLaughlin J. K. et al. Pernicious anemia and subsequent cancer. A population-based cohort study // Cancer. 1993; 71: 745–750.
- Brinton L. A., Gridley G., Hrubec Z. et al. Cancer risk following pernicious anaemia // Br J Cancer. 1989; 59: 810–813.
- Mera R. M., Bravo L. E., Camargo M. C. et al. Dynamics of Helicobacter pylori infection as a determinant of progression of gastric precancerous lesions: 16-year follow-up of an eradication trial // Gut. 2018; 67: 1239–1246. Epub 24 июня 2017 г.
- Сиотани A., Уэдо Н., Ииши Х. и др. Реэкспрессия sonic hedgehog и снижение CDX2 после эрадикации Helicobacter pylori до неполной кишечной метаплазии // International Journal of Cancer. 2007, vol. 121, нет. 6, p. 1182–1189. Просмотр в издателе, просмотр в Google Scholar, просмотр в Scopus.
- Сиотани A., Уэдо Н., Ииши Х. и др. Прогностические факторы метахронного рака желудка у пациентов высокого риска после успешной эрадикации Helicobacter pylori. Пищеварение. 2008, т. 78, нет. 2–3, p. 113–119. Просмотр в издателе, просмотр в Google Scholar, просмотр в Scopus.
- Kamada T., Sato M., Tokutomi T. et al. Rebamipide improves chronic inflammation in the lesser curvature of the corpus after Helicobacter pylori eradication: a multicenter study // Biomed Res Int. 2015; 5: 865146–865148.
- Han X., Jiang K., Wang B. et al. Effect of Rebamipide on the Premalignant Progression of Chronic Gastritis: A Randomized Controlled Study // Clin Drug Investig. 2015; 35 (10): 665–673.
- Arakawa T., Kobayashi K., Yoshikawa T. Rebamipide: overview of its mechanisms of action and efficacy in mucosal protection and ulcer healing // Dig Dis Sci. 1998; 43 (9): 5–13.
- Xiong J., Lai S., Zhang P. Rebamipide plus proton pump inhibitor versus proton pump inhibitor alone in the treatment of endoscopic submucosal dissection-induced gastric ulcer: a meta-analysis of randomized controlled trials // Medicine (Baltimore). 2014; 93 (12): 64. DOI: 10.1097/MD.0000000000000064.
- Du Y., Li Z., Zhan X. Anti-inflammatory effects of rebamipide according to Helicobacter pylori status in patients with chronic erosive gastritis: a randomized sucralfate-controlled multicenter trial in China-STARS study // Dig Dis Sci. 2008; 11: 2886–2895. DOI: 10.1007/s10620–007–0180-z.
- Terano A., Arakawa T. Rebamipide, a gastro-protective and anti-inflammatory drug, promotes gastric ulcer healing following eradication therapy for Helicobacter pylori in a Japanese population: a randomized, double-blind, placebo-controlled trial // J Gastroenterol. 2007; 42 (8): 690–693.
- Mizukami K., Murakami K. Aspirin-induced small bowel injuries and the preventive effect of rebamipide // World J Gastroenterol. 2011; 46: 5117–5122. DOI: 10.3748/wjg.v17.i46.5117.
- Zhang S., Qing Q., Bai Y. Rebamipide helps defend against nonsteroidal anti-inflammatory drugs induced gastroenteropathy: a systematic review and meta-analysis // Dig Dis Sci. 2013; 7: 1991–2000. DOI: 10.1007/s10620–013–2606–0.
- Ивашкин В. Т., Маев И. В., Лапина Т. Л., Шептулин А. А., Трухманов А. С., Баранская Е. К., Абдулхаков Р. А., Алексеева О. П., Алексеенко С. А., Дехнич Н. Н., Козлов Р. С., Кляритская И. Л., Корочанская Н. В., Курилович С. А., Осипенко М. Ф., Симаненков В. И., Ткачев А. В., Хлынов И. Б., Цуканов В. В. Клинические рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению инфекции Helicobacter pylori у взрослых // Рос. журн. гастроэнтерол. гепатол. колопроктол. 2018; 28 (1), с. 56–70.
- Nishizawa T., Nishizawa Y., Yahagi N., Kanai T., Takahashi M., Suzuki H. Effect of supplementation with rebamipide for Helicobacter pylori eradication therapy: a systematic review and meta-analysis // J Gastroenterol Hepatol. 2014; 29 (Suppl 4): 20–24. DOI: 10.1111/jgh.12769.
Л. Б. Лазебник*, доктор медицинских наук, профессор
Е. А. Лялюкова**, 1, доктор медицинских наук, профессор
* ФГБОУ ВО МГМСУ им. А. И. Евдокимова Минздрава России, Москва
** ФГБОУ ВО ОмГМУ Минздрава России, Омск
1 Контактная информация: lyalykova@rambler.ru
DOI: 10.26295/OS.2019.75.41.001
Современная стратегия ведения пациента с предраковыми заболеваниями желудка: диагностические подходы и терапевтические возможности/ Л. Б. Лазебник, Е. А. Лялюкова
Для цитирования: Лечащий врач № 8/2019; Номера страниц в выпуске: 7-13
Теги: аденокарцинома желудка, дисплазия желудка, международные рекомендации
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. ВОЗМОЖНЫ ПОБОЧНЫЕ ЭФФЕКТЫ. НЕОБХОДИМА КОНСУЛЬТАЦИЯ СПЕЦИАЛИСТА.Язва и гастрит
Содержание статьи
- Ребагит: действующее вещество
- Ребагит принимать до еды или после еды?
- Ребагит: побочные действия
- Ребагит или Ребамипид: что лучше?
- Ребагит или Де-нол: что лучше?
- Краткое содержание
- Задайте вопрос эксперту по теме статьи
Реалии современной жизни таковы, что с каждым годом в мире увеличивается число пациентов с заболеваниями пищеварительной системы. По данным Минздрава в России в 2015 году на диспансерном учете состояло около 3 миллионов человек с язвой двенадцатиперстной кишки. Но первое место среди болезней ЖКТ занимают хронические гастриты и дуодениты.
Препаратов для лечения болезней пищеварения множество. Одни отпускаются по рецептам, другие можно приобрести без рецептов. Провизор Кристина Хохрина рассказывает о рецептурном препарате Ребагит, который назначают при хронических гастритах и язвенной болезни желудка. Узнаем, какое в нем действующее вещество, как правильно принимать лекарство, есть ли у него побочные эффекты. Сравним с аналогами Де-нол и Ребамипид.
Ребагит: действующее вещество
В Регистре лекарственных средств (РЛС) зарегистрирован препарат Ребагит чешской компании ПРО.МЕД.ЦС. Его выпускают в виде таблеток, покрытых пленочной оболочкой. Каждая таблетка содержит 100 мг активного вещества ребамипида.
Ребамипид оказывает многогранное гастропротекторное действие. При приеме внутрь он:
- повышает содержание простагландинов Е в слизистой желудка и в желудочном соке, которые защищают слизистую желудка от образования язв
- защищает клетки слизистой оболочки от повреждений спиртом, лекарствами, бактериями, кислотами и щелочами
- увеличивает количество защитной слизи на стенках органов ЖКТ
- улучшает кровоснабжение слизистой оболочки
- ускоряет обновление эпителиальных клеток ЖКТ
- оказывает антиоксидантное действие
Ребагит назначают при язве желудка, эрозивном гастрите и обострении хронического гастрита. Также он защищает слизистую оболочку желудка от повреждений при терапии нестероидными противовоспалительными препаратами.
Ребагит принимать до еды или после еды?
Таблетки Ребагита принимают по одной три раза в сутки: утром, в обед и вечером. Запивают небольшим количеством воды.У Ребагита высокая скорость всасывания и его эффективность не зависит от приема пищи. Чтобы избежать ощущения тяжести в желудке, врачи рекомендуют принимать препарат через 30 минут после еды.
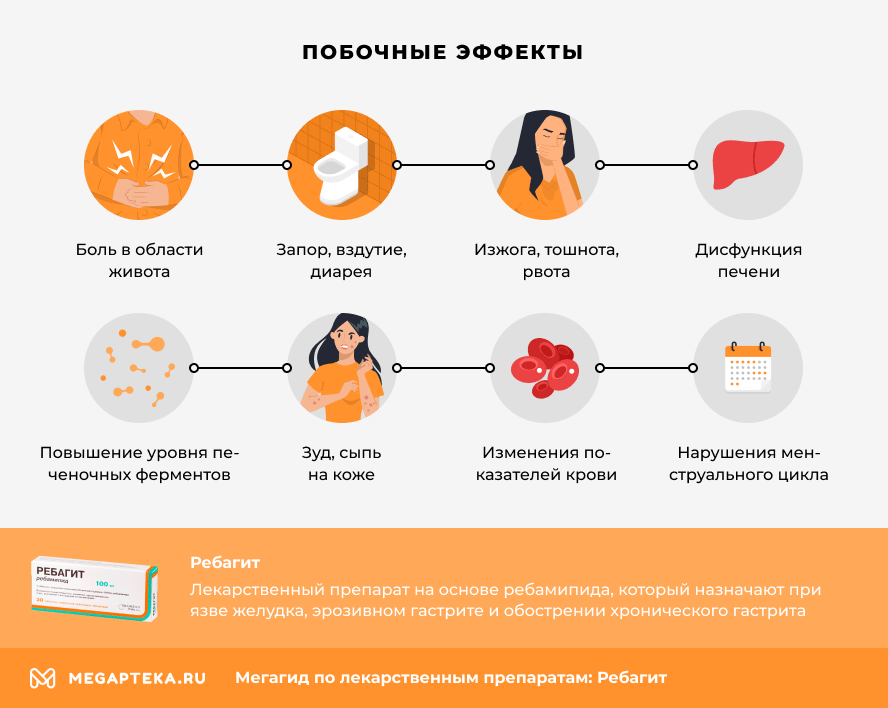
Ребагит: побочные действия
Ребагит с осторожностью назначают пациентам пожилого возраста из-за возможной повышенной чувствительности к лекарству. Прием препарата может вызывать следующие побочные реакции:
- боль в области живота
- запор, вздутие, диарея
- изжога, тошнота, рвота, изменения вкуса
- дисфункция печени
- повышение уровня печеночных ферментов
- изменения показателей крови
- зуд, сыпь на коже
- нарушения менструального цикла
Ребагит или Ребамипид: что лучше?
Препарат Ребамипид производят российские компании Северная звезда, Канонфарма Продакшн, Алиум и Модо Фортуна. Субстанции действующего вещества у всех препаратов, в том числе и Ребагита, произведены в Китае. Форма выпуска, дозировка, показания и противопоказания у аналогов идентичные. Незначительные отличия есть в составе вспомогательных веществ, которые важны для пациентов-аллергиков. В остальном аналоги равноценны и взаимозаменяемы.
Ребагит или Де-нол: что лучше?
В состав Де-Нола входит другое действующее вещество — висмута трикалия дицитрат. Ребагит или Де-Нол отличаются по механизму действия. Но при этом достигают одинаковых эффектов.
У Де-Нола выраженное противоязвенное действие с бактерицидным эффектом в отношении Хеликобактера пилори. При попадании в желудок лекарство образует защитную пленку на пораженной язвами и эрозиями слизистой оболочке. Де-Нол также проявляет высокие противовоспалительные и вяжущие свойства. Как и Ребагит, стимулирует синтез простагландинов Е, увеличивает выработку слизи и снижает активность пепсина.
Де-нол назначают детям с 4 лет, а Ребагит — только с 18. Оба препарата противопоказаны при беременности и лактации. Де-нол нельзя применять при почечной недостаточности.
Делаем выводы: Де-нол лучше для терапии детей после 4 лет и пациентов с болезнями желудка и 12-перстной кишки, связанных с бактерией Хеликобактер пилори.
Краткое содержание
- Действующее вещество Ребагита — ребамипид с комплексным защитным действием слизистых оболочек органов ЖКТ.
- Таблетки Ребагит принимают в любое время. Прием после еды уменьшает ощущение тяжести в желудке.
- Ребагит у некоторых пациентов вызывает побочные эффекты со стороны ЖКТ, кожные аллергические реакции, изменения в составе крови и уровне печеночных ферментов.
- Препараты Ребагит и Ребамипид взаимозаменяемы.
- Де-нол лучше Ребагита при терапии детей и пациентов с болезнями ЖКТ, связанных с бактерией Хеликобактер пилори
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Там же Вы можете поделиться своим опытом с другими читателями Мегасоветов.
Выпускающий редактор
Эксперт-провизор
Поделиться мегасоветом
Понравилась статья? Расскажите маме, папе, бабушке и тете Гале из третьего подъезда