Рекомбинат (RECOMBINAT) инструкция по применению
📜 Инструкция по применению Рекомбинат
💊 Состав препарата Рекомбинат
✅ Применение препарата Рекомбинат
📅 Условия хранения Рекомбинат
⏳ Срок годности Рекомбинат
⚠️ Государственная регистрация данного препарата отменена
Описание лекарственного препарата
Рекомбинат
(RECOMBINAT)
Основано на официально утвержденной инструкции по применению препарата и подготовлено для электронного издания справочника Видаль 2010 года, дата обновления: 2011.02.21
Владелец регистрационного удостоверения:
Код ATX:
B02BD02
(Фактор свертывания крови VIII)
Лекарственные формы
| Рекомбинат |
Лиофилизат д/пригот. р-ра д/в/в введения 250 МЕ: фл. в комплекте с растворителем и системой для введения рег. №: П N015648/01 |
|
|
Лиофилизат д/пригот. р-ра д/в/в введения 500 МЕ: фл. в комплекте с растворителем и системой для введения рег. №: П N015648/01 |
||
|
Лиофилизат д/пригот. р-ра д/в/в введения 1000 МЕ: фл. в комплекте с растворителем и системой для введения рег. №: П N015648/01 |
Форма выпуска, упаковка и состав
препарата Рекомбинат
Лиофилизат для приготовления раствора для в/в введения от белого до почти белого цвета, в виде порошка или рыхлой твердой массы.
Вспомогательные вещества: альбумин человеческий, натрия хлорид, гистидин, макрогол 3350, кальция хлорида дигидрат, хлористоводородная кислота, натрия гидроксид.
Растворитель: вода д/и — 10 мл.
Флаконы (1) в комплекте с растворителем (фл.), шприцем пластиковым, иглой с фильтром, двусторонней иглой, системой д/инф., 2 салфетками, 2 пластырями — пачки картонные.
Лиофилизат для приготовления раствора для в/в введения от белого до почти белого цвета, в виде порошка или рыхлой твердой массы.
Вспомогательные вещества: альбумин человеческий, натрия хлорид, гистидин, макрогол 3350, кальция хлорида дигидрат, хлористоводородная кислота, натрия гидроксид.
Растворитель: вода д/и — 10 мл.
Флаконы (1) в комплекте с растворителем (фл.), шприцем пластиковым, иглой с фильтром, двусторонней иглой, системой д/инф., 2 салфетками, 2 пластырями — пачки картонные.
Лиофилизат для приготовления раствора для в/в введения от белого до почти белого цвета, в виде порошка или рыхлой твердой массы.
Вспомогательные вещества: альбумин человеческий, натрия хлорид, гистидин, макрогол 3350, кальция хлорида дигидрат, хлористоводородная кислота, натрия гидроксид.
Растворитель: вода д/и — 10 мл.
Флаконы (1) в комплекте с растворителем (фл.), шприцем пластиковым, иглой с фильтром, двусторонней иглой, системой д/инф., 2 салфетками, 2 пластырями — пачки картонные.
Фармакологическое действие
Рекомбинат действует подобно эндогенному фактору VIII. Фактор VIII является важнейшим компонентом в процессе свертывания крови. Являясь кофактором для фактора XI, он ускоряет активацию фактора X. Активированный фактор X переводит протромбин в тромбин, который, в свою очередь, переводит фибриноген в фибрин, что приводит к образованию сгустка. Активность фактора VIII значительно снижена у больных с гемофилией А, поэтому они нуждаются в соответствующей заместительной терапии.
В исследованиях по токсичности, проведенных на лабораторных животных, введение доз, превышающих в несколько раз рекомендуемые дозы для человека, не обнаружило токсического воздействия. При проведении исследований на мутагенную активность in vitro не выявлено каких-либо обратимых мутаций, хромосомных аберраций или увеличения числа микроядер в полихроматических эритроцитах костного мозга.
Фармакокинетика
Фармакокинетические исследования показали, что у ранее леченных больных T1/2 Рекомбината составляло 14.6±4.9 ч, что статистически не отличалось от такового плазменного антигемофильного фактора (человеческого), Гемофила М (пАГФ), которые составляли 14.7±5.1 ч. Однако, уровень Рекомбината после инфузий 50 МЕ/кг в плазме составил 123.9±47.7 МЕ/100 мл, что значительно выше, чем уровень Гемофила М 101.7±31.6 МЕ/100мл. Однако расчетный показатель уровня в плазме (т.е. 2% увеличение активности фактора VIII 1 ME антигемофильного фактора/кг веса тела) для Рекомбината (121.2%±48.9%) был сравним с таковым для Гемофила М (123.4%±16.4%).
Показания препарата
Рекомбинат
- лечение и профилактика кровотечений у больных гемофилией А (врожденная недостаточность фактора VIII), в т.ч. при хирургических операциях у больных гемофилией А.
Режим дозирования
Режим дозирования и длительность лечения зависит от степени тяжести расстройства гемостаза, а также клинического состояния больного. Лечение должно проводиться под наблюдением врача-специалиста и регулярным контролем концентрации антигемофильного фактора в плазме больного. Ожидаемый пик увеличения уровня Рекомбинанта выражается в МЕ/100 мл плазмы или % (процент) от нормальной величины, может быть определен умножением на 2 введенной дозы на кг веса тела (МЕ/кг).
Тщательный контроль проводимой терапии особенно необходим в случае проведения оперативных вмешательств или возникновения угрожающих жизни кровотечений. Рекомендуется проводить регулярный мониторинг уровня антигемофильного фактора в плазме больных для контроля достигаемых показателей АГФ. Если не удается достичь расчетного уровня АГФ в плазме или кровотечение не контролируется при введении адекватных доз препарата, то следует заподозрить наличие ингибиторных антител. При проведении лабораторных тестов, наличие ингибиторных антител может быть выявлено и количественно определено в нейтрализованных ME антигемофильного фактора в каждом мл плазмы (единицы Бетезда) или в общем объеме плазмы. Если ингибитор определяется в менее, чем 10 единиц Бетезда на мл, введение дополнительной дозы антигемофильного фактора может нейтрализовать действие ингибитора. Таким образом, введение дополнительной дозы препарата должно улучшать ожидаемый эффект. В такой ситуации необходим тщательный лабораторный контроль уровня антигемофильного фактора. Титр ингибитора более 10 единиц Бетезда на мл может привести к потере контроля над гемостазом при введении антигемофильного фактора или невозможным или трудно управляемым, т.к. требуются высокие дозы препарата.
Рекомендации по режиму дозирования у детей и взрослых приведены в Таблице 1. Дозировка и кратность введения препарата должны всегда соотноситься с клинической эффективностью в каждом конкретном случае. Рекомбинат может применяться в целях профилактики кровотечений (короткий или длительный курс терапии), если лечащий врач считает это необходимым. В таком случае стоит ориентироваться на пик активности антигемофильного фактора у больных с известным временем полужизни фактора VIII. Если необходимо, пик активности должен измеряться в течение 30 мин после введения препарата. Для больных с коротким временем полужизни фактора VIII, может быть необходимо увеличение дозы и/или частоты введения препарата. На каждом флаконе с рекомбинантным антигемофильным фактором (Рекомбинатом) активность антигемофильного фактора выражена в ME на флакон, что обусловлено требованиями и стандартами ВОЗ для концентрата фактора VIII. Исследования показали, что для достижения точных уровней активности, количественное определение должно проводиться с использованием пластиковых трубочек и пипеток, поскольку субстрат содержит нормальные уровни фактора Виллебранда.
Способ применения
Препарат должен вводиться в/в после приготовления. Рекомендуется проводить инфузию препарата не позже 3 ч с момента приготовления. После приготовления раствор не может храниться в холодильнике. Введение препарата следует осуществлять со скоростью до 10 мл/мин. Следует контролировать пульс больного до и во время введения Рекомбината. При возникновении значительной тахикардии, следует снизить скорость введения или временно прекратить введение препарата, что обычно приводит к быстрому купированию симптомов.
Таблица 1. Схемы введения
Приготовление раствора
- Довести температуру лиофилизированного порошка и растворителя (вода для инъекций) до комнатной температуры (15-25°С).
- Удалить защитные колпачки с флаконов.
- Произвести дезинфекцию поверхности пробок раствором антисептика.
- Удалить защитный колпачок с одной стороны двусторонней иглы, поставляемой в наборе, и проткнуть пробку флакона с растворителем. Затем удалить второй защитный колпачок с иглы, перевернуть флакон с растворителем таким образом, чтобы он находился над флаконом с порошком. Проткнуть пробку флакона с порошком свободным концом иглы. Растворитель под действием вакуума перетечет во флакон с порошком.
- Разъединить флаконы, удалив иглу сначала из флакона с растворителем, а затем из флакона с Рекомбинантом. Легкое помешивание ускорит процесс растворения. Необходимо убедиться в полном растворении порошка.
- После приготовления раствора Рекомбината, препарат не подвергать хранению в холодильнике. Препарат следует использовать в течение 3-х ч, при температуре, не превышающей 15-25°С
Введение раствора
Рекомендуется введение раствора не позже 3-х ч с момента его приготовления. Полученный раствор нельзя хранить в холодильнике. До введения следует визуально оценить раствор на предмет нерастворенных частиц или изменения окраски. Раствор должен быть от бесцветного до слабожелтоватого цвета.
- Присоедините иглу-фильтр к шприцу и наберите в него воздух.
- Введите иглу во флакон с рекомбинантным антигемофильным фактором.
- Введите воздух из шприца во флакон, затем наберите раствор в шприц.
- Удалите иглу из флакона и отсоедините от шприца. Введите в/в. Скорость введения не должна превышать 10 мл/мин. Следует контролировать пульс больного во время введения. При возникновении значительной тахикардии, следует снизить скорость введения или временно прекратить введение препарата, что обычно приводит к быстрому купированию симптомов.
- Иглу-фильтр следует использовать только однократно.
Побочное действие
Как и при применении других содержащих белок препаратов, при применении Рекомбината могут возникать побочные эффекты.
Следующие побочные эффекты возможны при введении препарата: тошнота, чувство жара, легкая усталость, сыпь, гематома, потливость, зуд, тремор, лихорадка, боль в ногах, похолодание конечностей, сухость в горле, воспалительные заболевания уха и снижение слуха.
Редко отмечались побочные эффекты аллергического характера (крапивница, сыпь, диспноэ, кашель, боль в груди, снижение АД и анафилактическое состояние). Следует предупредить больного о возможных признаках аллергических реакций и при их возникновении прекратить применение препарата. Особую осторожность следует соблюдать у больных с известной аллергией на компоненты препарата.
Выработка нейтрализующих антител, ингибиторов фактора VIII, является распространенным осложнением при лечении больных гемофилией А. Эти антитела являются одной из фракций иммуноглобулинов G. Активность нейтрализующих антител выражается в единицах Бетезда на мл плазмы. Риск развития подобного осложнения коррелирует с введением антигемофильного фактора VIII. этот риск является наибольшим в течение первых 20 дней введения препарата. В исследованиях среди больных гемофилией А с высоким риском выработки ингибирующих антител (ранее не леченные больные) уровень антител к Рекомбинату полученного из плазмы антигемофильного фактора. Больные, получающие лечение рекомбинантным антигемофильным фактором, должны тщательно контролироваться на предмет образования ингибирующих антител при помощи специальных лабораторных тестов.
Противопоказания к применению
- аллергия на белки крупного рогатого скота, мышей или хомячков;
- повышенная чувствительность к какому-либо компоненту препарата.
С осторожностью: при высоком риске возникновения тромбоза, тромбоэмболии, инфаркта миокарда, ДВС-синдрома, при беременности и в период лактации.
Применение при беременности и кормлении грудью
Исследования влияния Рекомбината на репродуктивность лабораторных животных не проводились. Неизвестно, может ли Рекомбинат оказывать какое-либо воздействие на плод. Поэтому применение препарата женщинам при беременности возможно только при невозможности какой-либо другой терапии.
Принимать с осторожностью в период лактации.
Применение у детей
Рекомбинат можно применять у детей любого возраста, включая новорожденных (соответствующие исследования по безопасности и эффективности проведены как у ранее леченных, так и ранее нелеченных детей).
Особые указания
В некоторых случаях при введении рекомбинантного антигемофильного фактора возникали выраженные аллергические реакции. Поэтому следует соблюдать осторожность при применении препарата больными, обладающими гиперчувствительностью к белкам крупнорогатого скота, мышей и хомяков.
Аллергические реакции тяжелой степени являются противопоказанием к введению Рекомбината. При возникновении анафилактической реакции, следует немедленно прекратить введение препарата и начать проводить общепринятые противошоковые мероприятия. Если после введения необходимых доз препарата, уровни антигемофильного фактора не достигают рассчитанных значений, следует исследовать образцы крови на присутствие ингибиторов антигемофильного фактора.
Рекомбинат можно применять у детей любого возраста, включая новорожденных (соответствующие исследования по безопасности и эффективности проведены как у ранее леченных так и ранее нелеченных детей).
Поскольку препарат содержит только рекомбинантный VIII фактор он не предназначен для лечения больных болезнью Виллебранда.
Влияние на способность к управлению транспортными средствами и механизмами
Применение данного препарата не влияет на способность управлять автомобилем или какими-либо другими механизмами.
Передозировка
Симптомы передозировки препарата не выявлены.
Лекарственное взаимодействие
Каких-либо реакций лекарственного взаимодействия не выявлено.
Рекомбинат не следует смешивать с другими медицинскими препаратами.
Условия хранения препарата Рекомбинат
Список Б. Препарат следует хранить в недоступном для детей месте при температуре от 2° до 8°С. Не замораживать.
В пределах указанного срока годности в течение 6 месяцев может храниться при температуре 15-25°С.
Срок годности препарата Рекомбинат
Условия реализации
Препарат отпускается по рецепту.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Лиофилизат для приготовления раствора для внутривенного введения 250 МЕ, 500 МЕ, 1000 МЕ в комплекте с растворителем – вода для инъекций
активное вещество — октоког альфа (антигемофильный фактор рекомбинантный) 250 МЕ, 500 МЕ, 1000 МЕ,
вспомогательные вещества: альбумин (человеческий), натрия хлорид, гистидин, макрогол 3350, кальция хлорид дигидрат, кислота хлористоводородная, натрия гидроксид.
Растворитель — вода для инъекций.
Порошок или рыхлая твердая масса (лиофилизат) от почти белого до бледно-желтого цвета.
Препараты, влияющие на кроветворение и кровь. Гемостатики. Витамин К и другие гемостатики. Факторы свертывания крови VIII.
Код АТХ B02BD02
Фармакокинетика
Не выявлено статистически значимых различий между периодами полувыведения Рекомбината, 14.6±4.9 часа, и Гемофила М, плазматического Антигемофильного Фактора (человеческого), 14.7±5.1 часа. Фактический уровень показателя восстановления Рекомбината после инфузии в дозе 50 МЕ/кг составил 123.9±47.7 МЕ/100 мл и значительно превысил фактический показатель восстановления Гемофила М, который был равен 101.7±31.6 МЕ/100мл. Расчетный уровень фактического и ожидаемого показателей восстановления (т.е. увеличение активности Фактора VIII на 2% при введении 1 МЕ антигемофильного фактора/кг веса тела) для Рекомбината (121.2±48.9%) был сопоставим с таковым для Гемофила М (123.4±16.4%).
Фармакодинамика
Рекомбинат действует подобно эндогенному Фактору VIII, который является важнейшим компонентом в процессе свертывания крови. Являясь кофактором для активированного Фактора IX, он ускоряет активацию Фактора X. Активированный Фактора X переводит протромбин в тромбин, который, переводит фибриноген в фибрин, что приводит к образованию сгустка. Гемофилия А является сцепленным с полом наследственным нарушением свертывания крови вследствие снижения уровня фактора VIII: C. У больных гемофилией А наблюдается повышенная частота спонтанных, а также связанных с травмами или хирургическими вмешательствами кровотечений в суставы, мышцы или внутренние органы. При соответствующей заместительной терапии у больных уровень фактора VIII может быть скорректирован до необходимого уровня, предотвращая эпизоды повышенной кровоточивости.
— лечение и профилактика кровотечений у больных гемофилией А (врожденная недостаточность Фактора VIII), в том числе при проведении хирургических операций.
Препарат не содержит фактор фон Виллебранда и поэтому не применяется для лечения болезни фон Виллебранда.
Способ введения
Режим дозирования и длительность лечения зависят от степени тяжести нарушения гемостатической функции, локализации и длительности кровотечения, а также клинического состояния больного. Лечение должно проводиться под наблюдением врача-специалиста и с регулярным лабораторным контролем концентрации антигемофильного фактора в плазме больного. Ожидаемый in vivo пик увеличения уровня Рекомбината выражается в МЕ/100 мл плазмы или в процентах от нормальной величины и может быть определен умножением введенной дозы на кг массы тела (МЕ/кг) на два.
Пример метода расчета:
Ожидаемый % увеличения Фактора VIII =
количество введенных единиц х 2%/МЕ/кг
Масса тела (кг)
Пример расчета для взрослого больного весом 70 кг:
1750 МЕ х 2%/МЕ/кг = ~ 50%
70 кг
Или
Требуемая доза (МЕ) = Масса тела (кг) х необходимый % увеличения Фактора VIII
2%/МЕ/кг
Пример расчета для ребенка весом 40 кг:
40 кг х 70% = 1400 МЕ
2% МЕ/кг
Тщательный контроль проводимой терапии особенно необходим в случае проведения оперативных вмешательств или при возникновении угрожающих жизни кровотечений. Хотя дозировки могут рассчитываться по приведенным выше формулам, рекомендуется проводить регулярный мониторинг уровня антигемофильного фактора (АГФ) в плазме больных для контроля полученных показателей АГФ. Если не удается достичь требуемого уровня АГФ в плазме или, кровотечение не контролируется при введении расчетных доз препарата, должно быть заподозрено наличие ингибитора. Наличие ингибитора может быть выявлено соответствующими лабораторными тестами и определяется количеством Международных Единиц (МЕ) Антигемофильного Фактора, нейтрализованных в каждом мл плазмы (единицы Бетезда) или в общем определенном объеме плазмы. Если титр ингибитора менее 10 единиц Бетезда /мл, введение дополнительной дозы Антигемофильного Фактора может нейтрализовать его действие. Введение дополнительной дозы препарата должно улучшить ожидаемый ответ. В данной ситуации необходим тщательный лабораторный контроль уровня антигемофильного фактора в крови. Титр ингибитора более 10 единиц Бетезда /мл может привести к тому, что контроль над гемостазом при введении Антигемофильного Фактора будет невозможным или трудно достижимым, т.к. для нейтрализации ингибитора потребуются очень высокие дозы препарата. Рекомендации по режиму дозирования у детей, включая новорожденных, и взрослых приведены в Таблице 1. Дозировка и кратность введения препарата должны всегда соотноситься с клинической эффективностью в каждом конкретном случае. Рекомбинат также может применяться в целях профилактики кровотечений (короткий или длительный курс терапии), если лечащий врач считает это необходимым. В таком случае следует ориентироваться на пик активности АГФ у больных с известным временем полувыведения Фактора VIII. В случае необходимости, пик активности должен измеряться в течение получаса после введения препарата. Для больных с коротким временем полувыведения Фактора VIII может потребоваться увеличение дозы и/или частоты введения препарата. На каждом флаконе с Рекомбинантным Антигемофильным Фактором (Рекомбинатом) активность Антигемофильного Фактора указана в МЕ/флакон, что обусловлено требованиями и стандартами ВОЗ для концентратов Фактора VIII.
Приготовление и введение раствора
Препарат вводится внутривенно после восстановления прилагаемым растворителем (вода для инъекций). Должен использоваться стерильный одноразовый пластиковый шприц, поставляемый с препаратом. Не использовать препарат, если была нарушена стерильность упаковки. При разведении необходимо соблюдение соответствующей асептической техники.
|
Использование системы Баксжект II |
Использование игольной системы |
|
Приготовление раствора |
|
|
1. Довести температуру лиофилизированного порошка Рекомбинат и воды для инъекций (растворитель) до 15 — 25°С.
2. Удалить защитные колпачки с флаконов с порошком и растворителем.
3. Протереть пробки спиртовой салфеткой. Установить флаконы на плоскую горизонтальную поверхность.
4. Вскрыть упаковку системы Баксжект II путем удаления бумажной мембраны, не дотрагиваясь до внутреннего содержимого упаковки (Рис. А). Не вынимать устройство из упаковки |
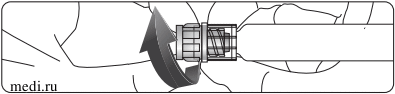
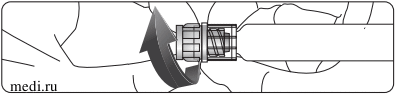
5. Перевернуть упаковку и ввести прозрачный пластиковый заостренный конец в пробку флакона с растворителем. Взявшись за края упаковки, потянуть ее вверх и снять с системы Баксжект II (Рис. Б). Не снимать голубой колпачок с устройства Баксжект II.
6. Присоединив Баксжект II к флакону с растворителем, перевернуть систему таким образом, чтобы флакон с растворителем находился сверху устройства. Ввести белый пластиковый заостренный конец в пробку флакона с лиофилизованным порошком Рекомбинат. За счет вакуума растворитель перетечет во флакон с препаратом. (Рис. В).
|
7. Легким помешиванием растворить лиофилизат. Необходимо убедиться в полном растворении лиофилизата, в противном случае действующее вещество не пройдет через фильтр устройства. Препарат растворяется быстро (обычно менее чем за 1 минуту). |
1. Довести температуру лиофилизированного порошка и растворителя (вода для инъекций) до комнатной температуры (15 — 25°С).
2. Удалить защитные колпачки с флаконов.
3. Произвести дезинфекцию поверхности пробок с помощью прилагаемых в комплекте спиртовых салфеток, поместить флаконы на плоскую горизонтальную поверхность.
4. Удалить защитный колпачок с одной стороны двусторонней иглы, поставляемой в наборе, и проткнуть пробку флакона с растворителем.
5. Удалить второй защитный колпачок с двусторонней иглы, перевернуть флакон с растворителем таким образом, чтобы он находился над флаконом с лиофилизатом, затем проткнуть пробку флакона с лиофилизатом свободным концом иглы. Растворитель под действием вакуума перетечет во флакон с порошком.
6. Разъединить флаконы, удалив иглу сначала из флакона с растворителем, затем из флакона с Рекомбинатом. Легким помешиванием растворить лиофилизат. Необходимо убедиться в полном растворении лиофилизата, в противном случае нерастворенные частицы будут задержаны фильтр-иглой.
После приготовления раствора Рекомбината препарат не хранить в холодильнике. Препарат следует использовать в течение трех часов после разведения. |
Введение раствора
|
До введения приготовленный раствор следует визуально оценить на предмет нерастворенных частиц или изменения окраски. Раствор должен быть бесцветным или слабо опалесцирующим. Не использовать мутный раствор или раствор, содержащий осадок.
1. Снять голубой колпачок с Баксжект II. НЕ ВТЯГИВАТЬ ВОЗДУХ В ШПРИЦ. Соединить шприц с Баксжект II (Рис. Г). |
2. Перевернуть систему, флакон с препаратом должен находиться сверху. Набрать препарат в шприц, медленно оттянув поршень (Рис. Д).
|
3. Отсоединить шприц.
4. Присоединить к шприцу систему для введения. Вводить внутривенно. Скорость введения препарата не должна превышать 10 мл/мин. Следует контролировать пульс пациента до и во время введения препарата. При возникновении значительной тахикардии, следует снизить скорость введения или временно прекратить введение препарата, что обычно приводит к быстрому купированию симптомов. |
До введения приготовленный раствор следует визуально оценить на предмет нерастворенных частиц или изменения окраски. Раствор должен быть бесцветным или слабо опалесцирующим. Не использовать мутный раствор или если образовался осадок.
1. Присоедините иглу-фильтр к одноразовому шприцу и наберите в него воздух.
2. Введите иглу во флакон с приготовленным раствором Рекомбината.
3. Введите воздух из шприца во флакон, затем наберите раствор в шприц.
4. Удалите фильтр-иглу и присоедините систему для введения к шприцу. Вводить внутривенно. Скорость введения не должна превышать 10 мл/минуту. Следует контролировать пульс больного до и во время введения. При возникновении значительной тахикардии, следует снизить скорость введения или временно прекратить введение препарата, что обычно приводит к быстрому купированию симптомов.
5. Иглу-фильтр следует использовать только однократно. |
Препарат должен вводиться внутривенно после восстановления растворителем, который прилагается в комплекте с препаратом (вода для инъекций). Рекомендуется использовать препарат не позднее 3 часов с момента приготовления. После приготовления раствор не следует хранить в холодильнике. Введение препарата следует осуществлять со скоростью до 10 мл/мин. До и во время введения Рекомбината необходимо контролировать частоту пульса больного. При возникновении значительной тахикардии следует снизить скорость введения или временно прекратить введение препарата, что обычно приводит к быстрому купированию симптомов. Для разведения и введения следует использовать только прилагаемые в комплекте наборы, так как возможна адсорбция Фактора свертывания VIII на внутренней поверхности других наборов для разведения и введения.
Таблица 1. Схемы введения
|
Степень кровоизлияний |
Обязательная постинфузионная активность пика АГФ в крови (% от нормального или МЕ/дл плазмы) * |
Частота введения |
|
|
Тяжесть кровотечения |
|||
|
Начальные признаки гемартроза или кровоизлияния в мышцы или кровотечения в полости рта |
20-40% |
Начально внутривенные введения каждые 12-24 часа в течение 1-3 дней до полного купирования эпизода кровотечения, о чем свидетельствует отсутствие боли, или до полного выздоровления |
|
|
Гемартрозы, кровоизлияния в мышцы средней степени тяжести или гематомы |
30-60% |
Повторные внутривенные введения каждые 12-24 часа. Не менее 3 дней до полного купирования болевого синдрома и восстановления двигательной активности |
|
|
Угрожающие жизни кровотечения, такие как кровотечения из горла, кровотечения в брюшную полость, внутричерепные кровоизлияния |
60-100% |
Повторные внутривенные введения каждые 8-24 часа до полного прекращения кровотечения |
|
|
Тип операции (хирургические вмешательства) |
|||
|
Малые хирургические вмешательства, включая экстракции зубов |
60-80% |
Однократное внутривенное введение препарата в сочетании с пероральной антифибринолитической терапией в течение 1 часа обычно бывает эффективным в 70% случаев. Затем каждые 24 часа, как минимум, 1 день, до полного выздоровления |
|
|
Большие хирургические вмешательства |
80-100% (пред- и послеоперационном периоде) |
Повторные внутривенные введения каждые 8-24 часа в зависимости от клинического состояния пациента |
|
*Это представляет пик активности АГФ у пациентов с ожидаемым средним периодом полураспада для фактора VIII. В случае необходимости, пик активности следует измерять в течение получаса после введения. Для пациентов с относительно коротким периодом полужизни фактора VIII может потребоваться увеличение дозы и / или частоты введения.
* Каждый флакон Рекомбината маркирован данными по активности АГФ, выражающиеся содержанием международных единиц (МЕ) во флаконе. Количество АГФ выражается в Международных Единицах (МЕ) активности, установленных относительно международного стандарта ВОЗ для препаратов фактора VIII: C концентрат. Эксперименты показали, что, с целью достижения определения высокой точности уровней активности, анализ на определение активности АГФ должен проводиться с использованием пластиковой лабораторной посуды (пробирки, пипетки), а также субстрата, содержащего нормальные уровни фактора фон Виллебранда.
Для длительной профилактики кровотечений у пациентов с тяжелой гемофилией А, используются обычные дозы от 20 до 40 МЕ фактора VIII на кг массы тела с интервалом от 2 до 3 дней. В некоторых случаях, особенно у молодых пациентов, могут быть необходимы более короткие интервалы между введениями или использование более высоких доз препарата.
Пациенты должны контролироваться на развитие ингибиторов фактора VIII в плазме. Если ожидаемые уровни активности фактора VIII в плазме не достигаются, или если кровотечение не контролируется соответствующей дозой, должен быть выполнен анализ на наличие ингибитора к фактору VIII. У пациентов с высокими уровнями ингибитора фактора VIII терапия может быть неэффективной и должны быть рассмотрены другие варианты лечения. Лечение таких больных должно проводиться врачами, имеющими опыт в уходе за пациентами с гемофилией.
Приведенная ниже таблица включает информацию по побочным действиям на препарат полученных путем спонтанных сообщений и в ходе клинических исследований. Частота нежелательных реакций оценивалась, исходя из следующих критериев: очень частые (≥1/10), частые (≥1/100; <1/10), нечастые (≥1/1000; <1/100), редкие (≥1/10000; <1/1000) и очень редкие (<1/10000), неизвестно (не могут быть оценены из имеющейся информации).
|
Стандарт MedDRA или системно-органный класс |
Предпочтительный термин MedDRA |
Частота |
||
|
Инфекции и инвазии |
Инфекция уха |
Нечасто |
||
|
Нарушения со стороны крови и лимфатической системы |
Ингибирование фактора VIII 1 |
Часто |
||
|
Нарушения со стороны иммунной системы |
Анафилактический шок |
Неизвестно |
||
|
Гиперчувствительность2 |
||||
|
Нарушение со стороны нервной системы |
Головокружение |
Неизвестно |
||
|
Тремор |
||||
|
Обморок |
Неизвестно |
|||
|
Головная боль Парестезия |
||||
|
Расстройство сердечной деятельности |
Цианоз |
Неизвестно |
||
|
Тахикардия |
||||
|
Нарушение деятельности сердечно-сосудистой системы |
Носовое кровотечение |
Неизвестно |
||
|
Приливы |
||||
|
Гематома |
||||
|
Гипотония |
||||
|
Бледность |
||||
|
Похолодание конечностей |
||||
|
Нарушения со стороны органов дыхания, грудной клетки и средостения |
Фаринголарингеальная боль |
Нечасто |
||
|
Одышка |
Неизвестно |
|||
|
Кашель |
||||
|
Дискомфорт в груди |
||||
|
Свистящее дыхание |
||||
|
Нарушения со стороны желудочно-кишечного тракта |
Тошнота |
Нечасто |
||
|
Рвота |
Неизвестно |
|||
|
Боль в животе |
||||
|
Нарушения со стороны кожи и подкожных тканей |
Гипергидроз |
|||
|
Зуд |
||||
|
Кожная сыпь |
||||
|
Макуло-папулезная сыпь |
||||
|
Неизвестно |
|||
|
Нарушения со стороны скелетной мускулатуры и соединительной ткани |
Боль в конечностях |
Нечасто |
||
|
Озноб |
Часто |
||
|
Усталость |
Нечасто |
|||
|
Лихорадка |
Нечасто |
|||
|
Лабораторные и инструментальные данные |
Анормальные тесты акустической стимуляции |
Нечасто |
1 В клиническом испытании PTP (PTP = ранее леченные пациенты), ни одного из 71 субъектов антитела к Фактору VIII не развились заново, но у 22 из 72 оцениваемых пациентов на протокол исследования PUP (PUP = ранее нелеченые пациенты), получавших Рекомбинат развились антитела к Фактору VIII и вышеуказанная частота была основана на данных PUP. Из 22 пациентов, 10 имели высокий титр (> 5 единиц Бетезда) и у 12 титр был низким (<5 единиц Бетезда).
2 Ранними признаками реакции гиперчувствительности являются крапивница, одышка, кашель, боль в груди, свистящее дыхание, анафилаксия, сыпь, гипотония, зуд, озноб, гиперемия, гипертермия, цианоз, тахикардия, рвота, обмороки, головная боль. Следует использовать препарат с осторожностью у пациентов с известной аллергической реакцией на составляющие препарата (см. раздел «Особые указания»).
Выработка нейтрализующих антител, ингибиторов к Фактору VIII, является распространенным осложнением при лечении больных гемофилией А. Эти антитела являются одной из фракций иммуноглобулинов G и их действие направлено на снижение прокоагулянтной активности фактора VIII. Активность нейтрализующих антител определяется в единицах Бетезда /мл плазмы.
Риск развития ингибиторов коррелирует с воздействием Антигемофильного Фактора VIII, этот риск является самым высоким в течение первых 20 дней экспозиции. По данным исследований у больных с тяжелой гемофилией А с высоким риском выработки ингибирующих антител, т.е. у ранее не леченных пациентов, уровень антител к Рекомбинату составил 31%, который находится в пределах, установленных для плазматических Антигемофильных Факторов. У пациентов, получающих Рекомбинат, следует тщательно следить за развитием ингибиторных антител с помощью клинических наблюдений и лабораторных испытаний.
— гиперчувствительность к какому-либо компоненту препарата
— аллергия на белок крупного рогатого скота, мышей или хомячков
Каких-либо реакций взаимодействия с другими лекарственными средствами не выявлено.
Рекомбинат не следует вводить одновременно с другими медицинскими препаратами.
Отмечено развитие тяжелых аллергических реакций на Рекомбинат. Больной должен быть осведомлен о ранних признаках возможных аллергических реакций, в том числе крапивнице, генерализованной крапивнице, стеснения в грудной клетке, одышке, гипотонии и анафилаксии, и о необходимости немедленно прекратить введение препарата при их возникновении. При возникновении анафилактической реакции следует немедленно прекратить введение препарата и начать проводить общепринятые противошоковые мероприятия.
Если уровни антигемофильного фактора в плазме не достигли ожидаемого уровня или, если кровотечение не контролируется после адекватной дозировки, должны быть выполнены соответствующие лабораторные тесты на наличие ингибиторов.
Выработка нейтрализующих антител, ингибиторов к Фактору VIII, является распространенным осложнением при лечении больных гемофилией А. Эти антитела являются одной из фракций иммуноглобулинов G и их действие направлено на снижение прокоагулянтной активности фактора VIII. Активность нейтрализующих антител определяется в единицах Бетезда /мл плазмы. Риск развития подобного осложнения связан с введением Антигемофильного Фактора VIII и является наиболее высоким в течение первых 20 дней введения препарата, также на развитие осложнения влияют другие генетические и экологические факторы. Редко, ингибиторы могут развиваться после первых 100 дней экспозиции. Случаи рецидива ингибиторов (низкий титр) наблюдались после переключения с одного препарата рекомбинантного фактора VIII на другой у ранее леченых пациентов с более чем 100 дней экспозиции, имеющих историю развития ингибитора.
Среди больных гемофилией А с высоким риском выработки ингибирующих антител, т.е. предварительно нелеченых пациентов, уровень антител к Рекомбинату составил 31%, то есть находится в пределах, установленных для плазматических Антигемофильных Факторов. Пациенты, получающие лечение препаратом Рекомбинат, должны находиться под постоянным клиническим наблюдением с регулярным лабораторным мониторингом уровня ингибиторных антител.
В интересах пациентов, рекомендуется, по возможности, каждый раз, при введении Рекомбината регистрировать название и номер партии продукта.
Рекомбинат содержит 1,5 ммоль натрия на дозу. Это следует принимать во внимание пациентам, находящимся на гипосолевой диете.
Рекомбинат можно применять у детей, включая новорожденных.
Препарат не содержит фактор Виллебранда и не показан для лечения болезни Виллебранда.
Беременность и период лактации
Неизвестно, оказывает ли Рекомбинат какое-либо воздействие на плод. Гемофилия А редко диагностируется у женщин, в связи с чем опыт использования фактора VIII во время беременности и грудного вскармливания не доступен. Препараты фактора VIII следует использовать во время беременности и кормления грудью, только в случае четких предписаний.
Особенности влияния лекарственного средства на способность управлять автомобилем или другими потенциально опасными механизмами
Следует соблюдать осторожность при управлении автомобилем или другими потенциально опасными механизмами.
Симптомы передозировки препарата не выявлены.
1 флакон по 250 МЕ, 500 МЕ или 1000 МЕ лиофилизата в комплекте с 1 флаконом растворителя — по 10 мл воды для инъекций и набором для разведения и введения препарата — система Баксжект II (один одноразовый пластиковый шприц, одна мини инфузионная система, два пластыря, две дезинфицирующие салфетки), или альтернативно системе Баксжект II, одна двусторонняя игла и одна фильтр-игла для игольного разведения, один шприц одноразовый пластиковый, одна система инфузионная, два пластыря, две дезинфицирующие салфетки) вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в картонную коробку.
Хранить при температуре от +2°С до +8°С. Не замораживать. В пределах указанного срока годности препарат можно хранить при комнатной температуре (до 25 °С) в течение 6 месяцев. Защищать от попадания света.
Не хранить в холодильнике после разведения.
Беречь от детей.
3 года
Препарат должен быть использован в течение 3 часов после разведения.
Не использовать по истечении срока годности, указанного на упаковке.
Баксалта Инк. США, США
Упаковщик
Баксалта Бельгия Мануфактуринг СА, Бельгия
Владелец регистрационного удостоверения
Баксалта Иновейшнз ГмбХ, Австрия
МНН: Октоког альфа (рекомбинантный антигемофильный фактор)
Производитель: Бакстер Хелскеа Корпорейшн
Анатомо-терапевтическо-химическая классификация: Coagulation factor VIII
Номер регистрации в РК:
№ РК-ЛС-5№013331
Информация о регистрации в РК:
26.07.2019 — бессрочно
Информация о реестрах и регистрах
Информация по ценам и ограничения
Предельная цена закупа в РК:
62 644.87 KZT
- Скачать инструкцию медикамента
Торговое название
Рекомбинат
Международное непатентованное название
Октоког альфа
Лекарственная форма
Лиофилизат для приготовления раствора для внутривенного введения 250 МЕ, 500 МЕ, 1000 МЕ в комплекте с растворителем – вода для инъекций
Состав
активное вещество — октоког альфа (антигемофильный фактор рекомбинантный) 250 МЕ, 500 МЕ, 1000 МЕ,
вспомогательные вещества: альбумин (человеческий), натрия хлорид, гистидин, макрогол 3350, кальция хлорид дигидрат, кислота хлористоводородная, натрия гидроксид.
Растворитель — вода для инъекций.
Описание
Порошок или рыхлая твердая масса (лиофилизат) от почти белого до бледно-желтого цвета.
Фармакотерапевтическая группа
Препараты, влияющие на кроветворение и кровь. Гемостатики. Витамин К и другие гемостатики. Факторы свертывания крови VIII.
Код АТХ B02BD02
Фармакологические свойства
Фармакокинетика
Не выявлено статически значимых различий между периодами полувыведения Рекомбината, 14.64.9 часа, и Гемофила М, плазматического Антигемофильного Фактора (человеческого), 14.75.1 часа. Фактический уровень показателя восстановления Рекомбината после инфузии в дозе 50 МЕ/кг составил 123.947.7 МЕ/100 мл и значительно превысил фактический показатель восстановления Гемофила М, который был равен 101.731.6 МЕ/100мл. Расчетный уровень фактического и ожидаемого показателей восстановления (т.е. увеличение активности Фактора VIII на 2% при введении 1 МЕ антигемофильного фактора/кг веса тела) для Рекомбината (121.248.9%) был сопоставим с таковым для Гемофила М (123.416.4%).
Фармакодинамика
Рекомбинат действует подобно эндогенному Фактору VIII, который является важнейшим компонентом в процессе свертывания крови. Являясь кофактором для Фактора XI, он ускоряет активацию Фактора X. Активированный Фактор X переводит протромбин в тромбин, который, переводит фибриноген в фибрин, что приводит к образованию сгустка. Гемофилия А – передающееся по мужской линии наследственное заболевание, которое заключается в пониженном уровне Фактора VIII:C (коагулирующий компонент Фактора VIII) в крови. У больных гемофилией А наблюдается повышенная частота спонтанных, а также связанных с травмами или хирургическими вмешательствами кровотечений в суставы, мышцы или внутренние органы. При соответствующей заместительной терапии у больных уровень фактора VIII может быть скорректирован до необходимого уровня, предотвращая эпизоды повышенной кровоточивости.
Показания к применению
— лечение и профилактика кровотечений у больных гемофилией А (врожденная недостаточность Фактора VIII), в том числе при проведении хирургических операций.
Способ применения и дозы
Способ введения
Режим дозирования и длительность лечения зависят от степени тяжести нарушения гемостатической функции, локализации и длительности кровотечения, а также клинического состояния больного. Лечение должно проводиться под наблюдением врача-специалиста и с регулярным лабораторным контролем концентрации антигемофильного фактора в плазме больного. Ожидаемый пик увеличения уровня Рекомбината выражается в МЕ/100 мл плазмы или в процентах от нормальной величины и может быть определен умножением введенной дозы на кг массы тела (МЕ/кг) на два.
Пример метода расчета:
Ожидаемый % увеличения Фактора VIII =
количество введенных единиц х 2%/МЕ/кг
Масса тела (кг)
Пример расчета для взрослого больного весом 70 кг:
1750 МЕ х 2%/МЕ/кг = 50%
70 кг
Или
Требуемая доза (МЕ) = вес тела (кг) х необходимый % увеличения Фактора VIII
2%/МЕ/кг
Пример расчета для ребенка весом 40 кг:
40 кг х 70% = 1400 МЕ
2% МЕ/кг
Тщательный контроль проводимой терапии особенно необходим в случае проведения оперативных вмешательств или при возникновении угрожающих жизни кровотечений. Хотя дозировки могут рассчитываться по приведенным выше формулам, рекомендуется проводить регулярный мониторинг уровня антигемофильного фактора в плазме больных для контроля полученных показателей АГФ. Если не удается достичь требуемого уровня АГФ в плазме или, кровотечение не контролируется при введении расчетных доз препарата, должно быть заподозрено наличие ингибитора. Наличие ингибитора может быть выявлено соответствующими лабораторными тестами и определяется количеством Международных Единиц (МЕ) Антигемофильного Фактора, нейтрализованных в каждом мл плазмы (единицы Бетезда) или в общем определенном объеме плазмы. Если титр ингибитора менее 10 единиц Бетезда /мл, введение дополнительной дозы Антигемофильного Фактора может нейтрализовать его действие. Введение дополнительной дозы препарата должно улучшить ожидаемый ответ. В данной ситуации необходим тщательный лабораторный контроль уровня антигемофильного фактора в крови. Титр ингибитора более 10 единиц Бетезда /мл может привести к тому, что контроль над гемостазом при введении Антигемофильного Фактора будет невозможным или трудно достижимым, т.к. для нейтрализации ингибитора потребуются очень высокие дозы препарата. Рекомендации по режиму дозирования у детей, включая новорожденных, и взрослых приведены в Таблице 1. Дозировка и кратность введения препарата должны всегда соотноситься с клинической эффективностью в каждом конкретном случае. Рекомбинат также может применяться в целях профилактики кровотечений (короткий или длительный курс терапии), если лечащий врач считает это необходимым. В таком случае следует ориентироваться на пик активности АГФ у больных с известным временем полувыведения Фактора VIII. В случае необходимости, пик активности должен измеряться в течение получаса после введения препарата. Для больных с коротким временем полувыведения Фактора VIII может потребоваться увеличение дозы и/или частоты введения препарата. На каждом флаконе с Рекомбинантным Антигемофильным Фактором (Рекомбинатом) активность Антигемофильного Фактора указана в МЕ/флакон, что обусловлено требованиями и стандартами ВОЗ для концентратов Фактора VIII.
Приготовление и введение раствора
Препарат вводится внутривенно после восстановления прилагаемым растворителем (вода для инъекций). Должен использоваться стерильный одноразовый пластиковый шприц, поставляемый с препаратом. Не использовать препарат, если была нарушена стерильность упаковки. При разведении необходимо соблюдение соответствующей асептической техники.
|
Использование системы Баксжект II |
Использование игольной системы |
|
Приготовление раствора |
|
|
1. Довести температуру лиофилизированного порошка Рекомбинат и воды для инъекций (растворитель) до 15 — 25С. 2. Удалить защитные колпачки с флаконов с порошком и растворителем. 3. Протереть пробки спиртовой салфеткой. Установить флаконы на плоскую горизонтальную поверхность. 4. Вскрыть упаковку системы Баксжект II путем удаления бумажной мембраны, не дотрагиваясь до внутреннего содержимого упаковки (Рис. А). Не вынимать устройство из упаковки. Рис. А 5. Перевернуть упаковку и ввести прозрачный пластиковый заостренный конец в пробку флакона с растворителем. Взявшись за края упаковки, потянуть ее вверх и снять с системы Баксжект II (Рис. Б). Не снимать голубой колпачок с устройства Баксжект II. Рис. Б 6. Присоединив Баксжект II к флакону с растворителем, перевернуть систему таким образом, чтобы флакон с растворителем находился сверху устройства. Ввести белый пластиковый заостренный конец в пробку флакона с лиофилизованным порошком Рекомбинат. За счет вакуума растворитель перетечет во флакон с препаратом. (Рис. В). Рис. В 7. Легким помешиванием растворить лиофилизат. Необходимо убедиться в полном растворении лиофилизата, в противном случае действующее вещество не пройдет через фильтр устройства. Препарат растворяется быстро (обычно менее чем за 1 минуту). |
1. Довести температуру лиофилизированного порошка и растворителя (вода для инъекций) до комнатной температуры (15 — 25С). 2. Удалить защитные колпачки с флаконов. 3. Произвести дезинфекцию поверхности пробок с помощью прилагаемых в комплекте спиртовых салфеток, поместить флаконы на плоскую горизонтальную поверхность. 4. Удалить защитный колпачок с одной стороны двусторонней иглы, поставляемой в наборе, и проткнуть пробку флакона с растворителем. 5. Удалить второй защитный колпачок с двусторонней иглы, перевернуть флакон с растворителем таким образом, чтобы он находился над флаконом с лиофилизатом, затем проткнуть пробку флакона с лиофилизатом свободным концом иглы. Растворитель под действием вакуума перетечет во флакон с порошком. 6. Разъединить флаконы, удалив иглу сначала из флакона с растворителем, затем из флакона с Рекомбинатом. Легким помешиванием растворить лиофилизат. Необходимо убедиться в полном растворении лиофилизата, в противном случае нерастворенные частицы будут задержаны фильтр-иглой. После приготовления раствора Рекомбината препарат не хранить в холодильнике. Препарат следует использовать в течение трех часов после разведения. |
| Введение раствора | |
|
До введения приготовленный раствор следует визуально оценить на предмет нерастворенных частиц или изменения окраски. Раствор должен быть бесцветным или слабо опалесцирующим. Не использовать мутный раствор или раствор, содержащий осадок. 1. Снять голубой колпачок с Баксжект II. НЕ ВТЯГИВАТЬ ВОЗДУХ В ШПРИЦ. Соединить шприц с Баксжект II (Рис. Г). Рис.Г 2. Перевернуть систему, флакон с препаратом должен находиться сверху. Набрать препарат в шприц, медленно оттянув поршень (Рис. Д). Рис.Д 3. Отсоединить шприц. 4. Присоединить к шприцу систему для введения. Вводить внутривенно. Скорость введения препарата не должна превышать 10 мл/мин. Следует контролировать пульс пациента до и во время введения препарата. При возникновении значительной тахикардии, следует снизить скорость введения или временно прекратить введение препарата, что обычно приводит к быстрому купированию симптомов. |
До введения приготовленный раствор следует визуально оценить на предмет нерастворенных частиц или изменения окраски. Раствор должен быть бесцветным или слабо опалесцирующим. Не использовать мутный раствор или если образовался осадок. 1. Присоедините иглу-фильтр к одноразовому шприцу и наберите в него воздух. 2. Введите иглу во флакон с приготовленным раствором Рекомбината. 3. Введите воздух из шприца во флакон, затем наберите раствор в шприц. 4. Удалите фильтр-иглу и присоедините систему для введения к шприцу. Вводить внутривенно. Скорость введения не должна превышать 10 мл/минуту. Следует контролировать пульс больного до и во время введения. При возникновении значительной тахикардии, следует снизить скорость введения или временно прекратить введение препарата, что обычно приводит к быстрому купированию симптомов. 5. Иглу-фильтр следует использовать только однократно. |
Способ применения
Препарат должен вводиться внутривенно после восстановления растворителем, который прилагается в комплекте с препаратом (вода для инъекций). Рекомендуется использовать препарат не позднее 3 часов с момента приготовления. После приготовления раствор не следует хранить в холодильнике. Введение препарата следует осуществлять со скоростью до 10 мл/мин. До и во время введения Рекомбината необходимо контролировать частоту пульса больного. При возникновении значительной тахикардии следует снизить скорость введения или временно прекратить введение препарата, что обычно приводит к быстрому купированию симптомов. Для разведения и введения следует использовать только прилагаемые в комплекте наборы, так как возможна адсорбция Фактора свертывания VIII на внутренней поверхности других наборов для разведения и введения.
Таблица 1. Схемы введения
|
Необходимый уровень VIII Фактора (% от нормального или МЕ/100мл плазмы) |
Частота введения (часы) |
|
|
Тяжесть кровотечения |
||
|
Начальные признаки гемартроза или кровоизлияния в мышцы или кровотечения в полости рта |
20-40 |
Повторные внутривенные введения каждые 12-24 часа в течение 1-3 дней до полного купирования эпизода кровотечения, о чем свидетельствует отсутствие боли, или до полного выздоровления |
|
Гемартрозы, кровоизлияния в мышцы средней степени тяжести или гематомы |
30-60 |
Повторные внутривенные введения каждые 12-24 часа. Не менее 3 дней до полного купирования болевого синдрома и восстановления двигательной активности |
|
Угрожающие жизни кровотечения, такие как кровотечения из горла, кровотечения в брюшную полость, внутричерепные кровоизлияния |
60-100 |
Повторные внутривенные введения каждые 8-24 часа до полного прекращения кровотечения |
|
Тип операции (хирургические вмешательства) |
||
|
Малые хирургические вмешательства, включая экстракции зубов |
60-80 |
Однократное внутривенное введение препарата в сочетании с пероральной антифибринолитической терапией в течение 1 часа обычно бывает эффективным в 70% случаев. Затем каждые 24 часа, как минимум, 1 день, до полного выздоровления |
|
Большие хирургические вмешательства |
80-100 |
Повторные внутривенные введения каждые 8-24 часа в зависимости от клинического состояния пациента |
Побочные действия
Нечасто
— тошнота, воспаление среднего уха, снижение слуха, головокружение, тремор, кровотечение из носа, гиперемия, гематома в месте введения, артериальная гипотензия, бледность кожных покровов, похолодание конечностей, боль в глотке и гортани, фарингит потливость, боль в конечностях, усталость, лихорадка
— кожные реакции гиперчувствительности: зуд, кожные высыпания, макулопапулезная сыпь
Часто
— озноб
— образование антител, нейтрализующих фактор VIII (ингибирование фактора VIII у ранее нелеченых пациентов или лечение которых было минимальным)
— образование ингибиторов к фактору VIII у ранее леченных больных
В отдельных случаях
— крапивница, анафилактические реакции, ангионевротический отек, шелушение кожи, эритема
— одышка, кашель, чувство сдавления в груди, затрудненное дыхание со свистом, бронхо-легочная обструкция, рвота, боль в животе, недомогание, потеря сознания, обморок, головная боль, парестезия, цианоз, тахикардия
Противопоказания
— гиперчувствительность к какому-либо компоненту препарата
— аллергия на белок крупного рогатого скота, мышей или хомячков
Лекарственные взаимодействия
Каких-либо реакций взаимодействия с другими лекарственными средствами не выявлено.
Рекомбинат не следует вводить одновременно с другими медицинскими препаратами.
Особые указания
Больной должен быть осведомлен о признаках возможных аллергических реакций и при их возникновении, немедленно прекратить введение препарата и обратиться к врачу. Особую осторожность следует соблюдать больным с известной аллергией на компоненты препарата. Выработка нейтрализующих антител, ингибиторов к Фактору VIII, является распространенным осложнением при лечении больных гемофилией А. Эти антитела являются одной из фракций иммуноглобулинов G и их действие направлено на снижение прокоагулянтной активности фактора VIII. Активность нейтрализующих антител определяется в единицах Бетезда /мл плазмы. Риск развития подобного осложнения связан с введением Антигемофильного Фактора VIII и является наиболее высоким в течение первых 20 дней введения препарата.
Среди больных гемофилией А с высоким риском выработки ингибирующих антител, т.е. предварительно нелеченых пациентов, уровень антител к Рекомбинату составил 31%, то есть находится в пределах, установленных для плазматических Антигемофильных Факторов. Пациенты, получающие лечение препаратом Рекомбинат, должны находиться под постоянным клиническим наблюдением с регулярным мониторингом уровня ингибиторных антител.
При возникновении анафилактической реакции следует немедленно прекратить введение препарата и начать проводить общепринятые противошоковые мероприятия. Если после введения необходимых доз препарата уровень антигемофильного фактора не достигает требуемых значений, необходимо исследовать образцы крови на наличие ингибиторов к Антигемофильному Фактору.
Рекомбинат можно применять у детей, включая новорожденных.
Препарат не содержит фактор Виллебранда и не показан для лечения болезни Виллебранда.
Беременность и период лактации
Неизвестно, оказывает ли Рекомбинат какое-либо воздействие на плод. Применение препарата при беременности и в период лактации возможно в случаях, когда ожидаемая польза терапии для матери превышает потенциальный риск для ребенка.
Особенности влияния лекарственного средства на способность управлять автомобилем или другими потенциально опасными механизмами
Следует соблюдать осторожность при управлении автомобилем или другими потенциально опасными механизмами.
Передозировка
Симптомы передозировки препарата не выявлены.
Форма выпуска и упаковка
1 флакон по 250 МЕ, 500 МЕ или 1000 МЕ лиофилизата в комплекте с 1 флаконом растворителя — по 10 мл воды для инъекций и набором для разведения и введения препарата — система Баксжект II (один одноразовый пластиковый шприц, одна мини инфузионная система, два пластыря, две дезинфицирующие салфетки), или альтернативно системе Баксжект II, одна двусторонняя игла и одна фильтр-игла для игольного разведения, один шприц одноразовый пластиковый, одна система инфузионная, два пластыря, две дезинфицирующие салфетки) вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в картонную коробку.
Условия хранения
Хранить при температуре от +2С до +8С. Не замораживать. В пределах указанного срока годности препарат можно хранить при комнатной температуре (до 25 С) в течение 6 месяцев. Защищать от попадания света.
Не хранить в холодильнике после разведения.
Беречь от детей.
Срок хранения
3 года
Препарат должен быть использован в течение 3 часов после разведения.
Не использовать по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
По рецепту
Производитель
Бакстер Хелскеа Корпорейшн, США
Упаковщик
Бакстер СА, Бельгия
Владелец регистрационного удостоверения
Бакстер СА, Бельгия
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукции (товара)
Филиал «Бакстер Си Ай Эс Би.Ви.» в Республике Казахстан
050012, г. Алматы, пр. Аль-Фараби, комплекс «Нурлы-Тау», Блок 4А,
дом № 7, оф. 68
тел (7 727) 3115277, 3110603, 3115251
факс (7 727) 3110646
| 432248991477976716_ru.doc | 812.5 кб |
| 894796211477977861_kz.doc | 851.5 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники

04.05.2022
Описание препарата Редуксин® Форте (таблетки, покрытые пленочной оболочкой, 850 мг+15 мг) основано на официальной инструкции, утверждено компанией-производителем в 2022 году
Дата согласования: 04.05.2022
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
- Отзывы
Действующее вещество
ATX
Фармакологическая группа
Состав
| Таблетки, покрытые пленочной оболочкой | 1 табл. |
| действующие вещества: | |
| метформина гидрохлорид | 850,0/850,0 мг |
| сибутрамина гидрохлорида моногидрат | 10,0/15,0 мг |
| вспомогательные вещества: МКЦ; кроскармеллоза натрия; повидон К25; магния стеарат | |
| вспомогательные вещества пленочной оболочки (для дозировки 850+10 мг): готовая система для покрытия Опадрай II 85F30656 голубой (поливиниловый спирт, макрогол, титана диоксид, тальк, краситель бриллиантовый голубой с алюминиевым лаком, краситель индигокармин с алюминиевым лаком, краситель железа оксид желтый) | |
| вспомогательные вещества пленочной оболочки (для дозировки 850+15 мг): готовая система для покрытия Опадрай II 85F48105 белый (поливиниловый спирт, макрогол, тальк, титана диоксид) |
Описание лекарственной формы
Дозировка 850+10 мг: таблетки овальные двояковыпуклые с разделительной риской с одной стороны, покрытые пленочной оболочкой голубого цвета.
Дозировка 850+15 мг: таблетки овальные двояковыпуклые с разделительной риской с одной стороны, покрытые пленочной оболочкой белого цвета.
На поперечном разрезе — ядро почти белого цвета.
Фармакологическое действие
Фармакологическое действие
—
анорексигенное, гипогликемическое.
Фармакодинамика
Метформин. Пероральный гипогликемический препарат из группы бигуанидов, снижает гипергликемию, не приводя к развитию гипогликемии. В отличие от производных сульфонилмочевины не стимулирует секрецию инсулина и не вызывает гипогликемического эффекта у здоровых лиц. Повышает чувствительность периферических рецепторов к инсулину и утилизацию глюкозы клетками. Тормозит глюконеогенез в печени. Задерживает всасывание углеводов в кишечнике и стимулирует выработку ГПП-1 (физиологический регулятор аппетита). Метформин стимулирует синтез гликогена, воздействуя на гликогенсинтазу. Увеличивает транспортную емкость всех типов мембранных переносчиков глюкозы. Кроме того, оказывает благоприятный эффект на метаболизм липидов: снижает содержание общего Хс, ЛПНП и триглицеридов. На фоне приема метформина масса тела пациента либо остается стабильной, либо умеренно снижается.
Сибутрамин. Является пролекарством и проявляет свое действие in vivo за счет метаболитов (первичных и вторичных аминов), ингибирующих обратный захват моноаминов (серотонина, норадреналина и дофамина). Увеличение содержания в синапсах нейротрансмиттеров повышает активность центральных 5НТ-серотониновых и адренергических рецепторов, что способствует увеличению чувства насыщения и снижению потребности в пище, а также увеличению термопродукции (внутренний расход энергии). Опосредованно активируя β3-адренорецепторы, сибутрамин воздействует на бурую жировую ткань. Снижение массы тела при приеме сибутрамина сопровождается увеличением концентрации в сыворотке крови ЛПВП и понижением количества триглицеридов, общего Хс, ЛПНП и мочевой кислоты. Сибутрамин и его метаболиты не влияют на высвобождение моноаминов, не ингибируют МАО; не обладают сродством к большому числу нейромедиаторных рецепторов, включая серотониновые (5-НТ1, 5-HT1А, 5-НТ1В, 5-НТ2С), адренергические (β1, β2, β3, α1, α2), дофаминовые (D1, D2), мускариновые, гистаминовые (H1), бензодиазепиновые и глутаматные NMDA-рецепторы.
Одновременное применение метформина и сибутрамина повышает эффективность терапии у пациентов с ожирением. Посредством регуляции аппетита, снижения чувства голода, повышения расхода энергии и регуляции липидного и углеводного обменов Редуксин® Форте уменьшает массу тела человека и восстанавливает метаболический баланс.
Клиническая эффективность и безопасность (результаты клинических исследований)
В клиническом исследовании в группе препарата Редуксин® Форте доля пациентов, достигших клинически значимого снижения веса ≥5% за 3 мес терапии (доля ранних ответов на терапию), превышала 90%. За 6 мес терапии 91,67% пациентов в группе Редуксин® Форте достигли снижения массы тела на 10% и более. Снижение массы тела сопровождалось клинически значимым уменьшением окружности талии и улучшением липидного профиля, что доказывает эффективность препарата в отношении снижения риска развития осложнений и отвечает основным целям терапии ожирения.
В ходе исследования не наблюдалось негативного влияния препарата Редуксин® Форте на показатели ССС при его применении у пациентов с ожирением.
Фармакокинетика
Метформин
Всасывание
После приема препарата внутрь метформин достаточно полно абсорбируется из ЖКТ. При одновременном приеме пищи абсорбция метформина снижается и задерживается. Абсолютная биодоступность составляет 50–60%. Cmax в плазме составляет приблизительно 2 мкг/мл или 15 мкмоль и достигается через 2,5 ч.
Распределение
Метформин быстро распределяется в тканях организма. Практически не связывается с белками плазмы.
Метаболизм
Подвергается метаболизму в незначительной степени.
Выведение
Выводится почками. Клиренс метформина у здоровых людей составляет 400 мл/мин (в 4 раза выше, чем Cl креатинина), что свидетельствует об активной канальцевой секреции.
T1/2 составляет приблизительно 6,5 ч.
Фармакокинетика в особых клинических случаях
У пациентов с почечной недостаточностью T1/2 возрастает, появляется риск кумуляции метформина в организме.
Сибутрамин
Всасывание
После приема внутрь быстро всасывается из ЖКТ не менее чем на 77%. При первичном прохождении через печень подвергается биотрансформации под влиянием изофермента CYP3A4 с образованием двух активных метаболитов (монодесметилсибутрамин (M1) и дидесметилсибутрамин (М2). После приема разовой дозы 15 мг Cmax монодесметилсибутрамина (M1) в крови составляет 4 нг/мл (3,2–4,8 нг/мл), дидесметилсибутрамина (М2) — 6,4 нг/мл (5,6–7,2 нг/мл). Cmax достигается через 1,2 ч (сибутрамин), 3–4 ч (активные метаболиты). Одновременный прием пищи понижает Cmax метаболитов на 30% и увеличивает время ее достижения на 3 ч, не изменяя AUC.
Распределение
Быстро распределяется в тканях. Связь с белками составляет 97% (сибутрамин) и 94% (M1 и М2). Css активных метаболитов в крови достигается в течение 4 сут после начала лечения и примерно в 2 раза превышает концентрацию в плазме крови после приема разовой дозы.
Метаболизм и выведение
Активные метаболиты подвергаются гидроксилированию и конъюгации с образованием неактивных метаболитов, которые экскретируются преимущественно почками. T1/2 сибутрамина — 1,1 ч, M1 — 14 ч, М2 — 16 ч.
Фармакокинетика в особых клинических случаях
Пол. Имеющиеся в настоящее время ограниченные данные не указывают на существование клинически значимых различий в фармакокинетике у мужчин и женщин.
Пожилой возраст. Фармакокинетика у пожилых здоровых лиц (средний возраст — 70 лет) аналогична таковой у молодых.
Почечная недостаточность. Почечная недостаточность не оказывает влияния на AUC активных метаболитов M1 и М2, кроме метаболита М2 у пациентов с терминальной стадией почечной недостаточности, находящихся на диализе.
Печеночная недостаточность. У пациентов с печеночной недостаточностью средней степени тяжести после однократного приема сибутрамина AUC активных метаболитов Ml и М2 на 24% выше, чем у здоровых лиц.
Показания
Препарат Редуксин® Форте показан для коррекции массы тела и улучшения липидного и углеводного обмена у пациентов: с ИМТ >30 кг/м2 (алиментарное ожирение); ИМТ ≥27 кг/м2 в сочетании с сахарным диабетом типа 2 и дислипидемией; ИМТ ≥30 кг/м2 с предиабетом и дополнительными факторами риска развития сахарного диабета типа 2, у которых изменения образа жизни не позволили достичь адекватного гликемического контроля.
Противопоказания
повышенная чувствительность к компонентам препарата;
диабетический кетоацидоз, диабетическая прекома, диабетическая кома;
нарушение функции почек (Cl креатинина менее 45 мл/мин);
нарушение функции печени;
острые состояния, при которых имеется риск развития нарушения функции почек: дегидратация (при диарее, рвоте), тяжелые инфекционные заболевания, шок;
сердечно-сосудистые заболевания (в анамнезе и в настоящее время): ишемическая болезнь сердца (инфаркт миокарда, стенокардия), хроническая сердечная недостаточность в стадии декомпенсации, окклюзионные заболевания периферических артерий, тахикардия, аритмия, цереброваскулярные заболевания (инсульт, транзиторные нарушения мозгового кровообращения);
неконтролируемая артериальная гипертензия (АД выше 145/90 мм рт. ст.) (см. также «Особые указания»);
клинически выраженные проявления острых и хронических заболеваний, которые могут привести к развитию тканевой гипоксии (в т.ч. дыхательная недостаточность, сердечная недостаточность, острый инфаркт миокарда);
хронический алкоголизм, острое отравление этанолом;
тиреотоксикоз;
доброкачественная гиперплазия предстательной железы;
феохромоцитома;
закрытоугольная глаукома;
обширные хирургические операции и травмы (когда показано проведение инсулинотерапии);
лактоацидоз (в т.ч. в анамнезе);
установленная фармакологическая или наркотическая зависимость;
период менее 48 ч до и в течение 48 ч после проведения радиоизотопных или рентгенологических исследований с введением йодосодержащего контрастного средства;
соблюдение гипокалорийной диеты (менее 1000 ккал/сут);
наличие органических причин ожирения (например, гипотиреоз);
серьезные нарушения питания (нервная анорексия или нервная булимия);
психические заболевания;
синдром Жиля де ла Туретта (генерализованные тики);
одновременный прием ингибиторов МАО (например, фентермина, фенфлурамина, дексфенфлурамина, этиламфетамина, эфедрина) или их применение в течение 2 нед до приема сибутрамина и 2 нед после окончания его приема, других препаратов, действующих на ЦНС, ингибирующих обратный захват серотонина (например, антидепрессантов, нейролептиков), снотворных препаратов, содержащих триптофан, а также других препаратов центрального действия для снижения массы тела или лечения психических расстройств;
беременность;
период грудного вскармливания;
возраст до 18 и старше 65 лет.
С осторожностью: аритмия в анамнезе; хроническая недостаточность кровообращения; заболевания коронарных артерий (в т.ч. в анамнезе), кроме ишемической болезни сердца (инфаркт миокарта, стенокардия); глаукома, кроме закрытоугольной глаукомы; холелитиаз; артериальная гипертензия (контролируемая и в анамнезе); неврологические нарушения, включая задержку умственного развития и судороги (в т.ч. в анамнезе); эпилепсия; нарушение функции почек (Cl креатинина 45–59 мл/мин); моторные и вербальные тики в анамнезе; склонность к кровотечению; нарушение свертываемости крови; применение препаратов, влияющих на гемостаз или функцию тромбоцитов; возраст старше 60 лет для лиц, выполняющих тяжелую физическую работу, что связано с повышенным риском развития у них лактоацидоза.
Применение при беременности и кормлении грудью
Поскольку до настоящего времени не имеется достаточно убедительного количества исследований в отношении безопасности воздействия сибутрамина на плод, данный препарат противопоказан в период беременности. Женщины, находящиеся в репродуктивном возрасте, во время приема препарата Редуксин® Форте должны пользоваться контрацептивными средствами.
Противопоказано применение препарата Редуксин® Форте во время грудного вскармливания.
Способ применения и дозы
Внутрь, 1 раз в сутки.
Дозу устанавливают индивидуально в зависимости от переносимости и клинической эффективности.
Рекомендуется начальная доза (850+10) мг/сут.
Препарат следует принимать утром, не разжевывая и запивая достаточным количеством жидкости (стакан воды). Препарат можно как принимать натощак, так и сочетать с приемом пищи. Увеличение дозы до (850+15) мг возможно, если в течение месяца не достигнуто снижение массы тела на 2 кг и более, но не ранее чем через 4 нед от начала лечения.
Лечение препаратом Редуксин® Форте не должно продолжаться более 3 мес у пациентов, которым в течение 3 мес лечения не удается достигнуть 5% уровня снижения массы тела от исходного уровня при приеме препарата в максимальной дозе.
У пациентов с ожирением без дополнительных нарушений углеводного обмена рекомендован прием препарата Редуксин® Форте в течение 6 месяцев для выработки правильных привычек питания и удержания достигнутого результата по снижению массы тела. Лечение препаратом Редуксин® Форте не следует продолжать, если при дальнейшей терапии после достигнутого снижения массы тела, пациент вновь прибавляет в массе тела 3 кг и более.
Рекомендуется длительный прием препарата для снижения массы тела на 5–10% и удержания результата, что позволяет уменьшить риски для здоровья, а также улучшить течение заболеваний, ассоциированных с ожирением.
Лечение препаратом Редуксин® Форте должно осуществляться в комплексе с диетой и физическими упражнениями под контролем врача, имеющего практический опыт лечения ожирения.
Длительность непрерывного лечения не должна превышать 1 года.
Побочные действия
Определение частоты побочных эффектов: очень часто (≥1/10); часто (от ≥1/100 до <1/10); нечасто (от ≥1/1000 до <1/100); редко (от ≥1/10000 до <1/1000); очень редко (<1/10000). Побочное действие представлено в порядке снижения значимости.
Метформин
Со стороны обмена веществ и питания: очень редко — лактоацидоз; при длительном применении возможно снижение всасывания витамина В12. Снижение концентрации витамина В12 необходимо принимать во внимание у пациентов с мегалобластной анемией.
Со стороны нервной системы: часто — нарушение вкуса.
Со стороны ЖКТ: очень часто — тошнота, рвота, диарея, боль в животе, отсутствие аппетита. Наиболее часто эти симптомы возникают в начальный период лечения и в большинстве случаев спонтанно проходят. Медленное увеличение дозы может улучшить желудочно-кишечную переносимость.
Со стороны печени и желчевыводящих путей: очень редко — нарушение функции печени, гепатит; после отмены метформина эти нежелательные явления полностью исчезают.
Со стороны кожи и подкожной клетчатки: очень редко — кожные реакции, такие как эритема, зуд, сыпь.
Сибутрамин
Чаще всего побочные эффекты возникают в начале лечения (в первые 4 нед). Их выраженность и частота с течением времени ослабевают. Побочные эффекты имеют в целом нетяжелый и обратимый характер.
Со стороны нервной системы: очень часто — сухость во рту и бессонница; часто — головная боль, головокружение, беспокойство, парестезия, а также изменение вкуса.
Со стороны сердца: часто — тахикардия, ощущение сердцебиения.
Со стороны сосудов: повышение АД, вазодилатация. Наблюдается умеренный подъем АД в покое на 1–3 мм рт. ст. и умеренное увеличение пульса на 3–7 уд./мин. В отдельных случаях не исключается более выраженное повышение АД и увеличение ЧСС. Клинически значимые изменения АД и пульса регистрируются преимущественно в начале лечения (в первые 4–8 нед).
Со стороны ЖКТ: очень часто — потеря аппетита и запор; часто — тошнота и обострение геморроя. При склонности к запорам в первые дни необходим контроль за эвакуаторной функцией кишечника. При возникновении запора прием прекращают и принимают слабительное.
Со стороны кожи и подкожных тканей: часто — повышенное потоотделение.
В единичных случаях при лечении сибутрамином описаны следующие нежелательные клинически значимые явления: дисменорея, отеки, гриппоподобный синдром, зуд кожи, боль в спине, боль в животе, парадоксальное повышение аппетита, жажда, ринит, депрессия, сонливость, эмоциональная лабильность, тревожность, раздражительность, нервозность, острый интерстициальный нефрит, кровотечения, пурпура Шенлейна-Геноха (кровоизлияния в кожу), судороги, тромбоцитопения, транзиторное повышение активности печеночных ферментов в крови.
Применение препарата Редуксин® Форте у пациентов с повышенным АД: см. «Противопоказания» и «Особые указания». В ходе постмаркетинговых исследований сибутрамина были описаны дополнительные побочные реакции, перечисленные ниже по системам органов.
Со стороны иммунной системы: реакции гиперчувствительности (от умеренных высыпаний на коже и крапивницы до ангионевротического отека (отека Квинке) и анафилаксии).
Нарушения психики: психоз, состояния суицидально направленного мышления, суицид и мания. При возникновении подобных состояний препарат необходимо отменить.
Со стороны нервной системы: судороги, кратковременные нарушения памяти.
Со стороны органа зрения: затуманивание зрения (пелена перед глазами).
Со стороны сердца: мерцательная аритмия.
Со стороны ЖКТ: диарея, рвота.
Со стороны кожи и подкожной клетчатки: алопеция.
Со стороны почек и мочевыводящих путей: задержка мочи.
Со стороны половых органов и молочной железы: нарушения эякуляции/оргазма, импотенция, нарушение менструального цикла, маточные кровотечения.
Взаимодействие
Метформин
Противопоказанные комбинации
Йодсодержащие рентгеноконтрастные средства. На фоне функциональной почечной недостаточности у больных сахарным диабетом радиологическое исследование с применением йодсодержащих рентгеноконтрастных средств может вызывать развитие лактоацидоза. Лечение метформином необходимо отменить в зависимости от функции почек за 48 ч до или на время рентгенологического исследования с применением йодсодержащих рентгеноконтрастных средств и не возобновлять ранее 48 ч после исследования при условии, что в ходе обследования почечная функция была признана нормальной.
Нерекомендуемые комбинации
Алкоголь. При острой алкогольной интоксикации увеличивается риск развития лактоацидоза, особенно в случаях:
— недостаточного питания, соблюдения низкокалорийной диеты;
— печеночной недостаточности. Во время приема препарата следует избегать приема алкоголя и ЛС, содержащих этанол.
Комбинации, требующие осторожности
Даназол. Не рекомендуется одновременный прием даназола во избежание гипергликемического действия последнего. При необходимости лечения даназолом и после прекращения приема последнего требуется коррекция дозы метформина под контролем концентрации глюкозы в крови.
Хлорпромазин. При приеме в больших дозах (100 мг в день) повышает концентрацию глюкозы в крови, снижая высвобождение инсулина. При лечении нейролептиками и после прекращения приема последних требуется коррекция дозы препарата под контролем концентрации глюкозы в крови.
ГКС системного и местного действия. Снижают толерантность к глюкозе, повышают концентрацию глюкозы в крови, иногда вызывая кетоз. При лечении ГКС и после прекращения приема последних требуется коррекция дозы метформина под контролем концентрации глюкозы в крови.
Диуретики. Одновременный прием петлевых диуретиков может привести к развитию лактоацидоза из-за возможной функциональной почечной недостаточности. Не следует назначать метформин, если Cl креатинина ниже 60 мл/мин. Назначаемые в виде инъекций β2-адреномиметики повышают концентрацию глюкозы в крови вследствие стимуляции β2-адренорецепторов. В этом случае необходим контроль концентрации глюкозы в крови. При необходимости рекомендуется назначение инсулина. При одновременном применении вышеперечисленных ЛС может потребоваться более частый контроль концентрации глюкозы в крови, особенно в начале лечения. При необходимости доза метформина может быть скорректирована в процессе лечения и после его прекращения.
Ингибиторы АПФ и другие гипотензивные ЛС. Могут снижать концентрацию глюкозы в крови. При необходимости следует скорректировать дозу метформина. Гипогликемическое действие метформина могут снижать фенотиазины, глюкагон, эстрогены, пероральные контрацептивы, фенитоин, симпатомиметики, никотиновая кислота, изониазид, БМКК, левотироксин натрия. Одновременное применение с циметидином снижает скорость выведения метформина, что может приводить к развитию лактоацидоза. У здоровых добровольцев при одновременном применении метформина и пропранолола, а также при применении метформина и ибупрофена не наблюдалось изменения их фармакокинетических показателей.
Метформин может снижать действие антикоагулянтов непрямого действия.
Субстраты транспортера органических катионов 1 и 2 (ОСТ1 и ОСТ2). Метформин является субстратом органических катионов ОСТ1 и ОСТ2. При совместном применении с метформином:
— ингибиторы ОСТ1 (такие как верапамил) могут снизить гипогликемическое действие метформина;
— индукторы ОСТ1 (такие как рифампицин) могут увеличить всасывание метформина в ЖКТ и усилить его гипогликемическое действие;
— ингибиторы ОСТ2 (такие как циметидин, долутегравир, ранолазин, триметоприм, вандетаниб, изавуконазол) могут снизить выведение метформина почками и привести к увеличению его концентрации в плазме крови.
Ингибиторы ОСТ1 и ОСТ2 (такие как кризотиниб, олапарид) могут снизить гипогликемическое действие метформина.
При одновременном применении метформина с производными сульфонилмочевины, инсулином, акарбозой, салицилатами возможно развитие гипогликемии.
Нифедипин повышает абсорбцию и Cmax метформина.
Катионные ЛС (амилорид, дигоксин, морфин, прокаинамид, хинидин, хинин, ранитидин, триамтерен, триметоприм и ванкомицин), секретирующиеся в почечных канальцах, конкурируют с метформином за канальцевые транспортные системы и могут приводить к увеличению его Cmax.
Сибутрамин
Ингибиторы микросомального окисления, в т.ч. ингибиторы изофермента CYP3A4 (в т.ч. кетоконазол, эритромицин, циклоспорин) повышают в плазме крови концентрации метаболитов сибутрамина с увеличением ЧСС и клинически несущественным увеличением интервала QT.
Рифампицин, антибиотики из группы макролидов, фенитоин, карбамазепин, фенобарбитал и дексаметазон могут ускорять метаболизм сибутрамина. Одновременное применение нескольких препаратов, повышающих содержание серотонина в плазме крови, может привести к развитию серьезного взаимодействия. Так называемый серотониновый синдром может развиться в редких случаях при одновременном применении сибутрамина с СИОЗС (препаратами для лечения депрессии), некоторыми препаратами для лечения мигрени (суматриптан, дигидроэрготамин), сильнодействующими анальгетиками (пентазоцин, петидин, фентанил) или противокашлевыми препаратами (декстрометорфан).
Сибутрамин не влияет на действие пероральных контрацептивных средств.
При одновременном приеме сибутрамина и алкоголя не было отмечено усиления негативного действия алкоголя. Однако алкоголь абсолютно не сочетается с рекомендуемыми при приеме сибутрамина диетическими мероприятиями.
При одновременном применении с сибутрамином других препаратов, влияющих на гемостаз или функцию тромбоцитов, увеличивается риск развития кровотечений.
Лекарственное взаимодействие при одновременном применении сибутрамина с препаратами, повышающими АД и ЧСС, в настоящее время недостаточно полно изучено. Эта группа препаратов включает в т.ч. деконгестанты, противокашлевые, противопростудные и противоаллергические препараты, в состав которых входят эфедрин или псевдоэфедрин. Поэтому в случаях одновременного приема этих препаратов с сибутрамином следует соблюдать осторожность.
Совместное применение сибутрамина с препаратами для снижения массы тела, действующими на ЦНС, или препаратами для лечения психических расстройств противопоказано.
Передозировка
Метформин
Симптомы: при применении метформина в дозе 85 г (в 42,5 раза превышающей максимальную суточную дозу) не наблюдалось гипогликемии, однако отмечалось развитие лактоацидоза. Значительная передозировка или сопряженные факторы риска могут привести к развитию лактоацидоза.
Лечение: в случае появления признаков лактоацидоза лечение препаратом необходимо немедленно прекратить, пациента срочно госпитализировать и, определив концентрацию лактата, уточнить диагноз. Наиболее эффективным мероприятием по выведению из организма лактата и метформина является гемодиализ. Проводят также симптоматическое лечение.
Сибутрамин
Симптомы: имеются крайне ограниченные данные по поводу передозировки сибутрамина. Наиболее часто встречающиеся неблагоприятные реакции, связанные с передозировкой: тахикардия, повышение АД, головная боль, головокружение. Следует известить своего лечащего врача в случае предполагаемой передозировки.
Лечение: какого-либо специального лечения и специфических антидотов не существует. Необходимо выполнять общие мероприятия: обеспечить свободное дыхание, наблюдать за состоянием ССС, а также при необходимости осуществить поддерживающую симптоматическую терапию. Своевременное применение активированного угля, а также промывание желудка может уменьшить поступление сибутрамина в организм. Пациентам с повышенным АД и тахикардией можно назначить β-адреноблокаторы. Эффективность форсированного диуреза или гемодиализа не установлена. При передозировке следует немедленно отменить прием препарата Редуксин® Форте.
Особые указания
Лактоацидоз. Лактоацидоз является редким, но серьезным (высокая смертность при отсутствии неотложного лечения) осложнением, которое может возникнуть из-за кумуляции метформина. Случаи лактоацидоза при приеме метформина возникали в основном у больных сахарным диабетом с выраженной почечной недостаточностью. Следует учитывать и другие сопряженные факторы риска, такие как декомпенсированный сахарный диабет, кетоз, продолжительное голодание, алкоголизм, печеночная недостаточность и любое состояние, связанное с выраженной гипоксией. Это может помочь снизить частоту случаев возникновения лактоацидоза. Следует учитывать риск развития лактоацидоза при появлении неспецифических признаков, таких как мышечные судороги, сопровождающиеся диспептическими симптомами, болью в животе и выраженной астенией. Лактоацидоз характеризуется ацидотической одышкой, болью в животе и гипотермией с последующей комой. Диагностическими лабораторными показателями являются снижение pH крови (менее 7,25), содержание лактата в плазме крови свыше 5 ммоль/л, повышенные анионный промежуток и отношение лактат/пируват. При подозрении на метаболический ацидоз необходимо прекратить прием препарата и немедленно обратиться к врачу.
Хирургические операции. Применение препарата Редуксин® Форте должно быть прекращено за 48 ч до проведения плановых хирургических операций и может быть продолжено не ранее чем через 48 ч после при условии, что в ходе обследования почечная функция была признана нормальной.
Функция почек. Поскольку метформин выводится почками, перед началом приема препарата Редуксин® Форте и регулярно в последующем необходимо определять Cl креатинина: не реже 1 раза в год у пациентов с нормальной функцией почек и 2–4 раза в год у пациентов пожилого возраста, а также у пациентов с Cl креатинина на нижней границе нормы. Следует проявлять особую осторожность при возможном нарушении функции почек у пациентов пожилого возраста, при одновременном применении гипотензивных препаратов, диуретиков или НПВП.
Пациентам рекомендуется продолжать соблюдать диету с равномерным потреблением углеводов в течение дня. Пациентам с избыточной массой тела рекомендуется продолжать соблюдать гипокалорийную диету (но не менее 1000 ккал/сут). Рекомендуется регулярно проводить стандартные лабораторные анализы для контроля сахарного диабета.
Рекомендуется проявлять осторожность при применении препарата Редуксин® Форте в комбинации с инсулином или другими гипогликемическими средствами (в т.ч. производными сульфонилмочевины, репаглинидом).
Лечение препаратом Редуксин® Форте должно осуществляться в рамках комплексной терапии по снижению массы тела под контролем врача, имеющего практический опыт лечения ожирения. Комплексная терапия включает в себя как изменение диеты и образа жизни, так и увеличение физической активности. Важным компонентом терапии является создание предпосылок к стойкому изменению пищевого поведения и образа жизни, которые необходимы для сохранения достигнутого снижения массы тела и после отмены медикаментозной терапии. Пациентам необходимо в рамках терапии препаратом Редуксин® Форте изменить свой жизненный уклад и привычки таким образом, чтобы после завершения лечения обеспечить сохранение достигнутого уменьшения массы тела. Пациенты должны четко представлять себе, что несоблюдение этих требований приведет к повторному увеличению массы тела и повторным обращениям к лечащему врачу.
У пациентов, принимающих препарат Редуксин® Форте, необходимо измерять АД и ЧСС. В первые 3 мес лечения эти параметры следует контролировать каждые 2 нед, а затем ежемесячно. Если во время двух визитов подряд выявляется увеличение ЧСС в покое ≥10 уд./мин или сАД/дАД ≥ 10 мм рт. ст., необходимо прекратить лечение. У пациентов с артериальной гипертензией, у которых на фоне гипотензивной терапии АД выше 145/90 мм рт. ст., этот контроль должен проводиться особенно тщательно и при необходимости через более короткие интервалы. У пациентов, у которых АД дважды при повторном измерении превышало 145/90 мм рт. ст., лечение препаратом Редуксин® Форте должно быть приостановлено (см. «Побочные действия», Со стороны сердца, Со стороны сосудов).
У пациентов с синдромом апноэ во сне необходимо особенно тщательно контролировать АД. Особого внимания требует одновременное назначение препаратов, увеличивающих интервал QT. К этим препаратам относятся блокаторы H1-гистаминовых рецепторов (астемизол, терфенадин); антиаритмические препараты, увеличивающие интервал QT (амиодарон, хинидин, флекаинид, мексилетин, пропафенон, соталол); стимулятор моторики ЖКТ цизаприд; пимозид, сертиндол и трициклические антидепрессанты. Это касается и состояний, которые способны приводить к увеличению интервала QT, таких как гипокалиемия и гипомагниемия (см. «Взаимодействие»).
Интервал между приемом ингибиторов МАО (в т.ч. фуразолидона, прокарбазина, селегилина) и препарата Редуксин® Форте должен составлять не менее 2 нед.
Хотя не установлена связь между приемом сибутрамина и развитием первичной легочной гипертензии, однако учитывая общеизвестный риск препаратов данной группы, при регулярном медицинском контроле необходимо особое внимание обращать на такие симптомы, как прогрессирующее диспноэ (нарушение дыхания), боль в грудной клетке и отеки ног. При пропуске дозы препарата Редуксин® Форте не следует принимать в следующий прием двойную дозу препарата, рекомендовано продолжать дальнейший прием препарата по предписанной схеме.
При совместном приеме сибутрамина и СИОЗС существует повышенный риск развития кровотечений. У пациентов, предрасположенных к кровотечениям, а также принимающих препараты, влияющие на гемостаз или функцию тромбоцитов, сибутрамин следует применять с осторожностью.
Хотя клинические данные о привыкании к сибутрамину отсутствуют, следует выяснить, не было ли в анамнезе пациента случаев лекарственной зависимости, и обратить внимание на возможные признаки злоупотребления лекарственными препаратами.
Влияние на способность управлять транспортными средствами и механизмами. Прием препарата Редуксин® Форте может ограничить способность к управлению транспортными средствами и механизмами. В период применения препарата Редуксин® Форте необходимо соблюдать осторожность при управлении транспортными средствами и занятии другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Форма выпуска
Таблетки, покрытые пленочной оболочкой, 850+10 мг; 850+15 мг. По 5, 7, 10 или 15 табл. в контурной ячейковой упаковке из пленки ПВХ и фольги алюминиевой печатной лакированной.
По 10, 15, 30, 60, 75, 100, 120 или 180 табл. в банке из ПЭТ для ЛС, укупоренной навинчиваемой крышкой с контролем первого вскрытия из ПЭНД. Свободное пространство в банке заполняют ватой медицинской гигроскопической.
Одну банку или 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 контурных ячейковых упаковок вместе с инструкцией по применению помещают в картонную упаковку (пачку).
Производитель
АО «Биохимик», Россия.
Юридический адрес/адрес места производства. Россия, 430030, Республика Мордовия, г. Саранск, ул. Васенко, 15А.
Тел.: (8342) 38-03-68.
E-mail: biohimic@biohimic.ru, www.biohimik.ru
Наименование, адрес и телефон уполномоченной организации для контактов (направление претензий и рекламаций). ООО «ПРОМОМЕД РУС». Россия, 129090, Москва, пр-т Мира, 13, стр. 1.
Тел.: (800) 777-86-04 (бесплатно), (495) 640-25-28.
E-mail: reception@promo-med.ru
Условия отпуска из аптек
По рецепту.
Условия хранения
В защищенном от света месте, при температуре не выше 25 °C.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Флексотрон Форте — инструкция по применению
Синонимы, аналоги
Статьи
Наименование медицинского изделия
Имплантат вязкоэластичный стерильный для внутрисуставных инъекций ФЛЕКСОТРОН® Форте (FLEXOTRON® Forte), на основе гиалуроната натрия, 10 мг/мл, 3 мл.
Имплантат представляет собой бесцветный, прозрачный, вязкий и стерильный гель (гидрогель). Имплантат не включает в себя лекарственные средства, производные клеток и тканей человека, ткани животных. Не имеет радиационных и электромагнитных свойств.
Состав:
| Ингредиент | Содержание |
| гиалуронат натрия (C14H2DNNaO11)n | 1% |
| Солевой раствор фосфатного буфера: | |
| Na2HPO4*12H2O | 0,06% |
| NaH2PO4*2H2O | 0,0048% |
| Хлорид натрия | 0,89% |
| Вода для инъекций | сколько требуется до 100% (3 мл) |
Технические характеристики:
Описание
Имплантат для замещения синовиальной жидкости ФЛЕКСОТРОН® Форте поставляется в стеклянном шприце и содержит гиалуроновую кислоту. Продукт представляет собой бесцветный, прозрачный, вязкоупругий и стерильный раствор. Гиалуроновая кислота (молекулярная масса 650000-1200000 Да) является продуктом бактериальной ферментации. Изделие предназначено только для одноразового применения.
Гиалуроновая кислота является естественным полисахаридом, который входит в состав всех тканей организма, при этом в особенно большой концентрации гиалуроновая кислота содержится в коже, подкожных тканях, а также в соединительной ткани, такой как синовиальная жидкость. Гиалуроновая кислота принадлежит к небольшой группе веществ, одинаковых для всех живых организмов, поэтому она обладает высокой биосовместимостью. В 1 мл продукта содержится 10 мг гиалуроната натрия, растворенного в физиологическом растворе. Не подлежит техническому обслуживанию.
Комплект поставки
Одна единица продукции включает:
Стерильность
Изделие проходит финишную стерилизацию автоклавированием в соответствии с EN 556-1. Валидация данного процесса осуществляется в соответствии со стандартами ISO 11138-3 и ISO 17665-1 для подтверждения стерильности.
Назначение
Вязкоэластичное протезирование синовиальной жидкости у пациентов с дегенеративно-дистрофическими и посттравматическими поражениями суставов, а также у лиц, имеющих повышенные нагрузки на поврежденные суставы.
Показания к применению
Способ применения
Инъекции выполняются медицинскими специалистами в асептических условиях. Перед введением имплантата содержимое шприца должно быть визуально оценено на прозрачность и однородность. Помутнение, кристаллизация, появление окраски и/или инородных включений может свидетельствовать о нарушении правил транспортировки и хранения изделия. При появлении вышеуказанных признаков введение средства для замещения синовиальной жидкости запрещено.
Имплантат вводится внутрисуставно в асептических условиях процедурных и манипуляционных кабинетов.
Перед проведением инъекции необходимо удалить покрывающую мембрану и извлечь наполненный шприц с имплантатом из блистера.
Вручную прикрепить адаптер для пальцев к упору цилиндра шприца.
Придерживая люэровский наконечник, аккуратно открутить колпачок наконечника шприца (как показано ниже). Избегать чрезмерных нагрузок на шприц при фиксации иглы для предотвращения деформации механизма Луер-Лок.
Продолжая крепко удерживать люэровский наконечник, прикрутить стерильную иглу рекомендуемым размером 21G или 23G (не входят в комплект поставки) к защелке шприца до тех пор, пока она не будет закреплена. Длина иглы выбираться врачом в соответствии с конституцией человека и толщиной подкожной клетчатки в месте пункции. Перед инъекцией выпустить из шприца пузырьки воздуха в случае их наличия.
Вводить медленно. Пациент должен избегать любых физических нагрузок или весовых нагрузок в течение 48 часов после внутрисуставной инъекции.
На курс лечения рекомендуется 3-5 шприцев. Для лечения остеоартрита / остеоартроза (OA) суставов у взрослых проводят 1 инъекцию в неделю. Количество и частота инъекций могут изменяться в зависимости от тяжести симптоматики.
Ожидаемая эффективность и принцип работы
Молекула гиалуроновой кислоты имеет спиральную длинноцепочечную структуру, которая позволяет удерживать или поглощать молекулы воды. Внутрисуставное обогащение синовиальной жидкости инъекциями гиалуроната натрия способствует улучшению или восстановлению вязкоупругих свойств естественной синовиальной жидкости. Гиалуронат натрия отвечает за вязкоупругие свойства синовиальной жидкости, таким образом вязкоэластичное протезирование позволяет компенсировать недостаточность гиалуроновой кислоты в синовиальной жидкости или снижение её вязкости, смягчить внешние нагрузки на сустав, обеспечивает смазывание, восстановление упругости и вязкости, амортизацию, увлажнение и обволакивание суставных поверхностей, покрывая смазывающим защитным слоем хрящ и рецепторы синовии. Это помогает увеличить объём движений и обеспечивает механическую защиту тканей полости сустава, что в свою очередь может улучшать течение остеоратроза / остеоартрита и других дегенеративно-дистрофических и посттравматических патологий суставов.
Ожидаемая продолжительность эффекта составляет 6 месяцев после проведения курса лечения.
Противопоказания
Меры предосторожности
По причине того, что септический артрит является серьезным побочным эффектом, необходимо соблюдать все стандартные меры предосторожности для хирургических вмешательств.
При получении аспирационной жидкости перед проведением вязкоэластичного протезирования следует провести соответствующие исследования для исключения бактериальной этиологии артрита.
Изделие предназначено для внутрисуставного введения. Необходимо избегать внутрисосудистого или внутритканевого введения изделия.
Изделие следует использовать до истечения срока годности, указанного на упаковке.
Применять с осторожностью у пациентов с аллергией, а также у пациентов с заболеваниями печени.
В первые дни после инъекции может быть рекомендован пероральный прием анальгетиков или противовоспалительных лекарственных средств.
Применение изделия совместно с четвертичными соединениями аммония запрещено.
Только для одноразового использования. Повторная стерилизация и применение изделия запрещены по причине наличия риска возникновения инфекции, перекрестной инфекции и (или) дефекта изделия. Не использовать шприц из открытой и/или поврежденной стерильной упаковки. Не использовать шприц с открытым или поврежденным колпачком стерильного шприца. При нарушении стерильности или подозрении о нарушении стерильности имплантата изделие должно быть утилизировано.
Пожилые пациенты
Применять с осторожностью ввиду общего снижения функциональной активности органов и систем организма.
Беременность и лактация
Применять в случае, если преимущество лечения превышает риск развития нежелательных явлений. Во время лечения кормление грудью следует прекратить.
Дети
Безопасность применения продукта у детей изучена недостаточно, поэтому применять с осторожностью.
Возможные побочные эффекты
Применение внутрисуставных форм гиалуроновой кислоты при дегенеративно-дистрофических и посттравматических поражениях суставов является хорошо изученным методом с установленным профилем безопасности, применяющимся на протяжении нескольких десятилетий.
К основным побочным эффектам относятся боль, отек и скованность в суставе после инъекции.
В крайне редких случаях возможно проявление местных воспалительных симптомов (повышение температуры, покраснение и отечность, увеличение содержания экссудата в полости сустава). После внутрисуставной инъекции могут возникать такие обратимые местные реакции, как кратковременное ограничение подвижности, чувство дискомфорта или тяжести в суставе. Проявление данных симптомов можно уменьшить прикладыванием льда к месту инъекции в течение 5-10 минут.
Имеются сообщения о единичных случаях аллергических реакций (например, зуд, сыпь, крапивница) и анафилактических реакций, септического артрита, внутритканевых кровоизлияниях или кровоизлияниях в полость сустава, тендинитах, флебитах, парестезиях, головокружениях, головных болях, мышечных спазмах, чувстве жара, общем недомогании, периферических отеков при внутрисуставном введении растворов гиалуроновой кислоты.
При появлении местных или общих симптомов следует проконсультироваться с врачом.
Извлечение имплантата
В случае выраженных проявлений может быть рекомендовано удаление имплантата из полости сустава, в том числе с применением лаважа согласно действующим клиническим рекомендациям. Запрещаются повторные инъекции имплантатов синовиальной жидкости в сустав до купирования симптомов острого воспаления!
Хранение и транспортировка
Хранить и транспортировать при температуре от 2 °C до 30 °C, в оригинальной упаковке. Беречь от воздействия прямых солнечных лучей. Не замораживать.
Срок годности:
3 года.
Защита окружающей среды и утилизация
Содержание шприца не является токсичным или огнеопасным. Изделия при использовании, транспортировке и хранении не оказывают негативного воздействия на окружающую среду.
Неиспользованные шприцы могут быть утилизированы в качестве бытовых отходов. Стекло следует утилизировать с осторожностью.
Неиспользованное содержимое шприца до или после истечения срока годности может быть утилизировано в качестве бытовых отходов (слить с большим количеством воды).
Уничтожение использованных медицинских изделий осуществляется в соответствии с природоохранными требованиями национальных, местных и ведомственных руководящих положений о безопасном уничтожении и утилизации.
В соответствии с санитарно-эпидемиологическими правилами и нормативами СанПиН 2.1.7.2790-10 использованные медицинские изделия (шприцы с имплантатами) относятся к медицинским отходам класса Б (эпидемиологически опасные отходы).
Расшифровка символов на упаковке
Гарантийные обязательства
Гарантийный срок соответствует сроку годности изделия. Срок годности медицинского изделия составляет 3 года.
Производитель гарантирует качество изделий и соответствие заявленным техническим спецификациям в течение всего срока годности при соблюдении условий эксплуатации, транспортирования и хранения. Производитель или его уполномоченный представитель предоставляет информацию и рекомендации в отношении рисков, а также предписания, методы и технические приемы для применения изделия.
Компания-производитель снимает с себя всю ответственность и отказывается от гарантийных обязательств в связи с травмами пациента или ущербом, который может иметь место в результате:
1. Выбранного способа применения и технического приема введения имплантата при несоблюдении установленных рекомендаций.
2. Неподходящего назначения, выбора использования для конкретного пациента.
3. Использования изделия после истечения указанного срока годности или при нарушениях правил хранения и транспортировки.
Производитель
«СайВижн Байотек Инк.», Тайвань. (SciVision Biotech Inc., 9, South 6th Rd., K.E.P.Z., Kaohsiung 806, Taiwan, R.O.C.)
Уполномоченный представитель производителя в России
Общество с ограниченной ответственностью «МКНТ Импорт» (ООО «МКНТ Импорт»), 119071, город Москва, улица Орджоникидзе, дом 12, стр. 2, Российская Федерация
Уполномоченный представитель производителя в России наделен правами обеспечения процессов прослеживаемости продукции и послерегистрационного мониторинга безопасности медицинского изделия в целях выявления и предотвращения побочных действий, не указанных в инструкции по применению, нежелательных реакций при применении медицинского изделия, особенностей взаимодействия медицинских изделий между собой, фактов и обстоятельств, создающих угрозу жизни и здоровью граждан и медицинских работников. Для выполнения данных функций ООО «МКНТ Импорт», действуя в качестве уполномоченного представителя, или/и его доверенные лица наделены правом собирать послерегистрационные данные, доводить до субъектов обращения информацию по безопасности, вовлекаться в мероприятия по выполнению корректирующих и превентивных действий, а также заключать соответствующие соглашения по обмену данными в отношении этой продукции, если это не противоречит законодательству Российской Федерации и Евразийского Экономического Союза.
Уполномоченный представитель производителя и организация, отвечающая за пострегистрационное наблюдение за безопасностью и принимающая претензии от потребителей на территории Республики Казахстан: ТОО «ТопМед», Республика Казахстан, 050067, Алматы, Бостандыкский район, Садоводческое товарищество Природа, дом 49.
Изделие соответствует требованиям следующих национальных стандартов производителя ISO 13485:2016; ISO 14630:2012; IEC 62366-1:2015; EN ISO 14971:2012; ISO 14602:2010; ISO 14155:2011; USP; Ph. Eur.; ISO 10993-1:2018; ISO 10993-3:2014; ISO 10993-5:2009; ISO 10993-6:2016; ISO 10993-10:2010; ISO 10993-11:2017; ISO 10993-12:2012; ISO 10993-18:2005; ASTM F1980-16:2016; EN 556-1:2001; ISO 11138-1:2017; ISO 11138-3:2017; ISO 11737-1:2018; ISO 11737-2:2009; ISO 17665-1:2006; ISO 14644-1:2015; ISO 14644-2:2015; ISO 13408-1:2008; ISO 11607-1:2019; ISO 11607-2:2019; ISO 80369-7:2016; ISO 15223-1:2016; BS EN 1041:2008+A1:2013
Регистрационное удостоверение № РЗН 2022/17365 от 27.05.2022 г.
Медициналық бұйымның атауы
Буынішілік инъекцияларға арналған, натрий гиалуронаты негізіндегі стерильді, тұтқыр созылғыш ФЛЕКСОТРОН® Форте (FLEXOTRON® Forte) имплантаты, 10 мг/мл, 3 мл.
Имплантат түссіз, мөлдір, тұтқыр жане стерильді гель (гидрогель) болып табылады. Имплантаттың құрамында дәрілік заттар, адам жасушалары мен тіндерінің туындылары, жануарлар тіндері жоқ. Радиациялық жане электромагниттік қасиеттері жоқ.
Құрамы:
| Ингредиент | Құрамы |
| Натрий гиалуронаты (C14H2DNNaO11)n | 1% |
| Фосфатты буфердің тұзды ерітіндісі: | |
| Na2HPO4*12H2O | 0,06% |
| NaH2PO4*2H2O | 0,0048% |
| Натрий хлориді | 0,89% |
| Инъекцияға арналған су | 100% (3 мл) дейін қажетінше |
Техникалық сипаттамалары:*
Сипаттамасы
Синовиальді сұйықтықты алмастыруға арналған ФЛЕКСОТРОН® Форте имплантаты шыны шприцте жеткізіледі жане құрамында гиалурон қышқылы бар. Өнім түссіз, мөлдір, тұтқыр серпімді жане стерильді ерітінді болып табылады. Гиалурон қышылы (молекулалық салмағы 650000-1200000 Да) микроорганизмдерден экстракцияланады. Өнім тек бір рет қолдануға арналған.
Гиалурон қышқылы организмнің барлық тіндерінің құрамына кіретін табиғи полисахарид болып табылады, сонымен қатар, асіресе, көп концентрациясында гиалурон қышқылы теріде, теріасты тіндерінде, сондай-ақ, синовиальді сұйықтық сияқты данекер тінде болады. Гиалурон қышқылы барлық тірі организмдер үшін бірдей заттардың шағын тобына жатады, сондықтан оның биоүйлесімділігі жоғары. 1 мл өнімнің құрамында физиологиялық ерітіндіде ерітілген 10 мг натрий гиалуронаты болады.
Техникалық қызмет көрсетілмейді.
Жеткізілім жиынтығы
Өнімнің бір бірлігі келесілерден құралған:
Стерильділігі
Бұйым EN 556-1ге сайкес автоклавтау арқылы ақырғы рет стерилизацилаудан өтеді. Бұл үдерісті валидациялау стерильділігін растау үшін ISO 11138-3 жане ISO 17665-1 стандарттарына сәйкес жүзеге асырылады.
Тағайындалуы
Буындардың дегенерациялық-дистрофиялық жане жарақаттан кейінгі зақымданулары бар пациенттерде, сондай-ақ, зақымданған буындарына көп күш түсетін адамдарда синовиальді сұйықтықты тұтқыр созылғыш протездеу үшін
Қолданылуы
Қолдану тәсілі
Инъекцияларды дарігер-мамандар асептикалық жағдайларда жүргізеді.
Имплантатты енгізер алдында шприцтің ішіндегісінің мөлдірлігі мен біртектілігі көзбен қарап бағалануы тиіс. Бұлыңғырлануы, кристалдануы, түсінің өзгеруі жане/немесе бөгде қосылыстардың пайда болуы бұйымды тасымалдау жане сақтау шарттарының бұзылғанын білдіруі мүмкін. Жоғарыда аталған белгілер пайда болған жағдайда, имплантатты енгізуге тыйым салынады.
Имплантат емшара жане манипуляция кабинеттерінде асептикалық жағдайларда буын ішіне енгізіледі.
Инъекция жүргізер алдында жауып тұрған жарғақшасын алып тастау жане имплантат толтырылған шприцті блистерден шығарып алыңыз.
Саусаққа арналған адаптерді шприц цилиндрінің түбіне қолмен бекемдеңіз.
Люэр ұштығынан ұстап тұрып, шприц ұштығының қалпақшасын абайлап бұрап ағытып алыңыз (төменде көрсетілгендей). Луер-Лок механизмінің деформациялануына жол бермеу үшін, инені бекемдеген кезде шприцке шамадан тыс күш салмаңыз.
Люэр ұштығын мықтап ұстап тұрып, ұсынылған 21G немесе 23G өлшемдегі (жеткізілім жиынтығына кірмейді) стерильді инені шприцтің ілмегіне бекемделгенге дейін бұрап кіргізіңіз. Иненің ұзындығын дарігер адамның конституциясына жане пункция орнындағы теріасты шелінің қалыңдығына сайкес таңдайды. Шприцте ауа көпіршіктері болса, инъекция алдында оларды шығарып жіберу керек.
Баяу енгізу керек. Пациент кез келген буынішілік инъекциядан кейінгі 48 сағат ішінде дене жүктемелерінен немесе салмақ жүктемелерінен сақтануы тиіс.
Бір емдеу курсына 3-5 шприц ұсынылады. Ересектерде буындардың остеоартритін / остеоартрозын (OA) емдеу үшін аптасына 1 инъекциясын жүргізеді. Инъекциялардың саны мен жиілігі симптоматиканың ауырлығына байланысты өзгеріп отыруы мүмкін.
Күтілетін тиімділігі және жұмыс істеу принципі
Гиалурон қышқылының молекуласы спиральді ұзын тізбекті құрылымыға ие, ол су молекулаларын ұстап тұруға немесе сіңіруге мүмкіндік береді. Буынішілік синовиальді сұйықтықтың натрий гиалуронаты инъекцияларымен байытылуы табиғи синовиальді сұйықтықтың тұтқыр серпімді қасиеттерінің жақсаруына немесе қалпына келуіне ықпал етеді. Натрий гиалуронаты синовиальді сұйықтықтың тұтқыр серпімді қасиеттерінне жауап береді, сол арқылы тұтқыр созылғыш протездеу синовиальді сұйықтықтағы гиалурон қышқылы жеткіліксіздігінің жане оның тұтқырлығы төмендеуінің орнын толтыруға, буынға түсетін сыртқы жүктемелерді жеңілдетуге мүмкіндік береді, шеміршек пен синовия рецепторларын майлағыш қорғағыш қабатпен жаба отырып, буын беткейлерінің майлануын, серпімділігі мен тұтқырлығының қалпына келуін, амортизациясын, ылғалдануы мен жабылуын қамтамасыз етеді. Бұл қимыл-қозғалыс көлемін арттыруға көмектеседі жане буын қуысы тіндерінің механикалық қорғанысын қамтамасыз етеді, ол өз кезегінде остеоратроз / остеоартрит және буындардың басқа дегенерациялық-дистрофиялық жане жарақаттан кейінгі патологияларының ағымын жақсартуы мүмкін.
Әсерінің күтілетін ұзақтығы емдеу курсын жүргізгеннен кейін 6 айды құрайды.
Қолдануға болмайтын жағдайлар
Сақтық шаралары
Сепсистік артрит ауыр жағымсыз эсер болып табылатындығы себепті, хирургиялық араласымдарға арналған барлық стандартты сақтық шараларын сақтау қажет.
Аспирациялық сұйықтық алу кезінде тұтқыр созылғыш протездеуді енгізер алдында артриттің бактериялық этиологиясы бар-жоқтығын анықтау үшін сэйкесінше зерттеулер жүргізу керек.
Бұйым буын ішіне енгізуге арналған. Бұйымды тамыр ішіне немесе тін ішіне енгізбеу қажет.
Бұйымды қаптамасында көрсетілген жарамдылық мерзімі өткенге дейін пайдалану керек.
Аллергиясы бар пациенттерде, сондай-ақ, бауыр ауруары бар пациенттерде сақтықпен қолдану керек.
Инъекциядан кейінгі алғашқы күндері анальгетиктерді немесе қабынуға қарсы дэрілік заттарды пероральді қабылдау пайдалы болуы мүмкін. Бұйымды төртіншілік аммоний қосылыстарымен бірге қолдануға тыйым салынады.
Тек бір рет пайдалануға арналған. Инфекцияның, айқаспалы инфекцияның жане (немесе) бұйым ақауының туындау қаупінің болуы себепті, бұйымды қайта стерилизациялауға жэне қолдануға тыйым салынады. Стерильді қаптамасы ашылған жане/немесе бүлінген шприцті пайдалануға болмайды. Стерильді шприцтің қалпақшасы ашылып қалған немесе бүлінген шприцті пайдалануға болмайды. Имплантаттың стерильділігі бұзылған немесе стерильділігі бұзылғандығына күдік болған жағдайда, бұйым утилизациялануы тиіс
Егде жастағы пациенттер
Организм ағзалары мен жүйелерінің функционалдық белсенділігінің жалпы төмендейтіндігіне байланысты, сақтықпен қолдану керек.
Жүктілік және лактация
Егер емдеудің артықшылығы жағымсыз құбылыстардың даму қаупінен асып түсетін болса ғана қолдану керек. Емдеу кезінде бала емізуді тоқтату керек.
Балалар
Өнімнің балаларда қолданылуының қауіпсіздігі жеткіліксіз зерттелген, сондықтан сақтықпен қолдану керек.
Болуы мүмкін жағымсыз әсерлері
Буындардың дегенерациялық-дистрофиялық жане жарақаттан кейінгі зақымданулары кезінде гиалурон қышқылының буынішілік түрерін қолдану қауіпсіздік бейіні анықталған, бірнеше онжылдықтар бойы қолданып келе жатқан, жақсы зерттелген адіс болып табылады.
Негізгі жағымсыз асерлеріне инъекциядан кейін буынның ауыруы, ісінуі жане құрысуы жатады.
Аса сирек жағдайларда жергілікті уақытша қабыну симптомдары (температура жоғарылауы, қызару жане ісіну, буын қуысындағы экссудат мөлшерінің артуы) көрініс беруі мүмкін. Буынішілік инъекциядан кейін қимыл-қозғалыстың қысқа мерзімді шектелуі, буындағы жайсыздық немесе ауырлық сезімі, гематомалар сияқты қайтымды жергілікті реакциялар туындауы мүмкін. Ондай симптомдардың көрініс беруін инъекция орнына 5-10 минут бойы мұз басу арқылы азайтуға болады.
Гиалурон қышқылы ерітінділерін буын ішіне енгізген кездегі аллергиялық реакциялар (мысалы, қышыну, бөртпе, есекжем) мен анафилаксиялық реакциялардың бірен-саран жағдайлары, сепсистік артрит, тінішілік қан кетулер немесе буын қуысына қан құйылулар, тендениттер, флебиттер, парестезиялар, бас айналуы, бас ауыруы, бұлшықеттердің түйілулері, ысыну сезімі, жалпы дімкастану, шеткері ісінулер туралы хабарламалар бар.
Жергілікті немесе жалпы симптомдар пайда болған жағдайда, дарігермен кеңесу керек.
Имплантатты шығарып алу
Айқын көріністер болған жағдайда, имплантатты буын куысынан алып тастау, соның ішінде, қолданыстағы клиникалық ұсынымдарға сайкес лаважды қолданып алып тастау ұсынылуы мүмкін. Жедел қабыну симптомдары басылғанға дейін имплантаттарды буынға синовиальді сұйықтыққа қайта инъекциялауға тыйым салынады!
Сақтау және тасымалдау
2 °С-ден 30 °С-ге дейінгі температурада түпнұсқалық қаптамасында сақтау жане тасымалдау керек. Тікелей түсетін күн саулесінің асерінен қорғау керек. Мұздатып қатыруға болмайды.
Жарамдылық мерзімі:
3 жыл.
Қоршаған ортаны қорғау және утилизациялау.
Шприцтің ішіндегісі уытты немесе өртке қауіпті емес. Бұйымдар пайдалану, тасымалдау жане сақтау кезінде қоршаған ортаға теріс асер етпейді.
Пайдаланылмаған шприцтерді тұрмыстық қалдықтар ретінде утилизациялауға болады. Шыныларды сақтықпен утилизациялау керек. Пайдаланылмаған шприцтің ішіндегісін жарамдылық мерзімі өткенге дейін немесе өткеннен кейін тұрмыстық қалдықтар ретінде утилизациялауға (мол сумен ағызып жіберуге) болады.
Пайдаланылған медициналық бұйымдарды жою қауіпсіз жою жане утилизациялау туралы Ұлттық, жергілікті жэне ведомстволық басшылық ережелердің табиғат қорғау талаптарына сайкес жүзеге асырылады.
Санитарлық-эпидемиологиялық ережелер мен СанЕмН 2.1.7.2790-10 нормативтеріне сэйкес пайдаланылған медициналық бұйымдар (имплантанттары бар шприцтер) Б класының медициналық қалдықтарына (эпидемиологиялық қауіпті қалдықтар) жатады.
Қаптамасындағы символдардың түсіндірмесі
Кепілдік міндеттемелері
Кепілдік мерзімі бұйымның жарамдылық мерзіміне сайкес келеді. Медициналық бұйымның жарамдылық мерзімі 3 жылды құрайды.
Өндіруші бұйымдардың сапасына жэне пайдалану, тасымалдау жане сақтау шарттары сақталған жағдайда барлық жарамдылық мерзімі бойына, малімденген техникалық сипаттамаларына сайкес келетіндігіне кепілдік береді. Өндіруші немесе оның уакілетті өкілі бұйымды қолдану үшін қауіптеріне, сондай-ақ, кеңестер, адістері мен техникалық тасілдеріне қатысты ақпарат жане нұсқау береді.
Өндіруші компания келесілердің:
1. Таңдалған қолдану тасілінің жане имплантты енгізудің бекітілген ұсынымдары сақталмаған техникалық адісінің.
2. Үйлесімсіз тағайындалуының, пайдалану үшін нақты бір пациенттің таңдалуының.
3. Бұйымды жарамдылық мерзімі өткеннен кейін немесе сақтау жане тасымалдау ережелерін бұза отырып пайдаланудың натижесінде орын алуы мүмкін пациенттің жарақаттануына немесе зиян шегуіне жауап бермейді жане сонымен байланысты кепілдік міндеттемелерінен бас тартады.
Өндіруші
«СайВижн Байотек Инк.», Тайвань. (SciVision Biotech Inc., 9, South 6th Rd., K.E.P.Z., Kaohsiung 806, Taiwan, R.O.C.)
Өндірушінің Ресейдегі уәкілетті өкілі
«МКНТ Импорт» жауапкершілігі шектеуі қоғамы («МКНТ Импорт» ЖШҚ) 119071, Маскеу қаласы, Орджоникидзе көшесі, 12 үй, 2 құр., Ресей Федерациясы
Өндірушінің Ресейдегі уакілетті өкіліне медициналық бұйымды қолдану кезінде қолдану жөніндегі нұсқаулықта көрсетілмеген жағымсыз асерлерін, медициналық бұйымдардың өзара арекеттесулерінің ерекшеліктерін, азаматтар мен медицина қызметкерлерінің өмірі мен денсаулығына қауіп төндіретін фактілер мен жағдайларды анықтау жане алдын алу мақсаттарында, өнімнің қадағалану үдерістерін жане медициналық бұйымның тіркеуден кейінгі қауіпсіздігін мониторингілеуді қамтамасыз ету құқықтары берілген. Аталған функцияларды атқару үшін, уакілетті өкіл ретінде арекет ететін «МКНТ Импорт» ЖШК, жане/немесе оның сенімді тұлғаларына тіркеуден кейінгі деректерді жинақтап, қауіпсіздігі жөніндегі ақпараттар айналымы саласындағы субъектілерге хабарлау, түзетушілік жане превентивтік арекеттерді атқару шараларына қатысу, сондай-ақ, егер бұл Ресей Федерациясы мен Еуразиялық Экономикалық Одақтың заңдарына қайшы келмесе, осы өнімге қатысты деректер алмасу үшін тиісінше келісімдер жасасу құқығы берілген.
Бұйым өндірушінің келесі ұлттық стандарттарының талаптарына сайкес келеді ISO 13485:2016; ISO 14630:2012; IEC 62366-1:2015; EN ISO 14971:2012; ISO 14602:2010; ISO 14155:2011; USP; Ph. Eur.; ISO 10993-1:2018; ISO 10993-3:2014; ISO 10993-5:2009; ISO 10993-6:2016; ISO 10993-10:2010; ISO 10993-11:2017; ISO 10993-12:2012; ISO 10993-18:2005; ASTM F1980-16:2016; EN 556-1:2001; ISO 11138-1:2017; ISO 11138-3:2017; ISO 11737-1:2018; ISO 11737-2:2009; ISO 17665-1:2006; ISO 14644-1:2015; ISO 14644-2:2015; ISO 13408-1:2008; ISO 11607-1:2019; ISO 11607-2:2019; ISO 80369-7:2016; ISO 15223-1:2016; BS EN 1041:2008+A1:2013
Қазақтан Республикасы аумағында қолайсыз оқиғаларды (инциденттерді) мониторингілеу жөніндегі уәкілетті өкілдің байланыс деректері:
«ТопМед» жШс, Қазақстан Республикасы, 050067, Алматы, Бостандық ауданы, Природа бау-бақша серіктестігі 49 үй.
Осыған сәйкес медициналық мақсаттағы бұйым өндірілген нормативтік құжаттың атауы (белгіленуі):
Техникалық файл 24.07.2020
Купить Флексотрон Форте в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)