4
Ульяновская
государственная сельскохозяйственная
академия
Кафедра
микробиологии, вирусологии, эпизоотологии
и ветеринарно-санитарной экспертизы
Д.А.
Васильев С.Н. Золотухин Е.А. Корнеев
РУКОВОДСТВО
К ПРАКТИЧЕСКИМ ЗАНЯТИЯМ ПО МИКРОБИОЛОГИИ
(
малый практикум)
Ульяновск
2003
УДК
619:616.9
Руководство
к практическим занятиям по микробиологии.
Второе издание
расширенное и дополненное.
Предназначено
студентам факультетов: ветеринарной
медицины и биотехнологии
Составители:
Дмитрий Аркадьевич
Васильев –
доктор биологических
наук, профессор,
Сергей Николаевич
Золотухин –
кандидат
ветеринарных наук, доцент,
Евгений Анатольевич
Корнеев –
ассистент кафедры.
Издается
по решению методической комиссии
факультета ветеринарной медицины УГСХА,
протокол № 11 от 16.04.1997 г.
Рецензент: кандидат
ветеринарных наук, доцент курса
эпизоотологии
Козин А.И.
©
Д.А.
Васильев С.Н. Золотухин Е. А. Корнеев
2003 г.
Предисловие ко второму изданию.
Необходимость
создания руководства к практическим
занятиям по микробиологии возникла
примерно 6 лет назад и была обусловлена
проявлением специализаций на факультетах
ветеринарной медицины и биотехнологии.
Поэтому в 1998 году нашими силами (Д.А.
Васильев, С.Н. Золотухин)
был создан и издан практикум
справочник по общей и частной микробиологии
для студентов по специализации врач –
бактериолог общим объёмом в 22 печатных
листа. Однако студенты учащиеся по
специализация – технолог-переработчик
и на специальности – биотехнология
изучали курс общей микробиологии по
старым практикумам, не всегда совпадающим
с учебными программами. Это вызывало
некоторые неудобства в проведении
практических занятий, создавало
дополнительные методические трудности.
Преподавание
микробиологии в нашем вузе на двух
факультетах — ветеринарном и зооинженерном,
опирается на опыт московской школы
микробиологов. В середине пятидесятых
годов, аспирант профессора Колякова
Я.Е (являвшийся несколько десятилетий
заведующим кафедрой микробиологии МВА,
и автором учебников микробиологии, по
которым четверть века учились студенты
ветеринарных факультетов) – доцент и
руководитель курса микробиологи А.П.
Васильев приехал в Ульяновск и создал
солидную теоретическую и практическую
базу курса микробиологии в УГСХА. Он
подготовил преемника в лице своего
аспиранта, а в последующем профессора,
доктора ветеринарных наук В.Я. Ганюшкина,
аспирант которого, а ныне доцент, С.Н.
Золотухин, является в настоящее время
руководителем курса микробиологии.
Учитывая полувековой опыт преподавания
микробиологии коллективом кафедры,
представляющим одну научно-педагогическую
школу, было решено создать так называемый
малый практикум по микробиологии. Это
практически базовый практикум, первый
этап знакомства с миром микроорганизмов.
В дальнейшем студенты, изучающие
микробиологию по специальности
ветеринарный врач, продолжают изучать
микробиологию по существующему
лабораторному практикуму…., студенты
по специализации врач – бактериолог
изучают микробиологию по выше упомянутому
большому лабораторному практикуму,
студенты по специализации
технолог–переработчик, изучают
микробиологию по созданному на нашей
кафедре лабораторному практикуму по
микробиологии мяса и молока. Этим же
практикумом пользуются студенты,
изучающие специализацию врач–
ветсанэксперт. При составления руководства
авторы исходили из принятого на кафедре
метода проведения практических занятий.
В основе которого лежит принцип
самостоятельной работы студентов. Это
позволяет преподавателю не излагать
весь рассматриваемый материал, а лишь
проверить подготовленность группы к
занятиям и осветить наиболее сложные
вопросы предстоящей работы.
Все замечания и
предложения, которые могут возникнуть
при чтении руководства и работы с ним
авторы примут с благодарностью.
Дополнительную информацию можно получить
на нашем сайте в Интернете –
www.Miсrobiology.by.ru
Д.А.
Васильев
ЗАНЯТИЕ 1. Бактериологическая лаборатория,
ее задачи. Техника безопасности в
лаборатории. Устройство микроскопа.
Особенности микроскопии в микробиологической
практике (иммерсионная система). Формы
микроорганизмов.
Цель занятия.
Усвоить правила работы в бактериологической
лаборатории. Ознакомиться с техникой
безопасности и личной профилактикой.
Освоить работу с микроскопом и особенности
иммерсионной системы. Изучить формы
бактерий.
Материалы и
оборудование. Микроскопы, окрашенные
микроскопические препараты с различными
формами микроорганизмов, плакаты.
Методические
указания. После краткого объяснения
преподавателя о порядке проведения
работы в лаборатории, необходимости
соблюдения техники безопасности студенты
знакомятся с устройством светового
микроскопа, осваивают технику микроскопии
готовых препаратов, изучают морфологию
микроорганизмов на препаратах и
зарисовывают их в тетради.
Бактериологическая
лаборатория— это учреждение ветеринарной
службы, деятельность которой направлена
на ликвидацию заразных болезней
животных, а также охрану населения от
болезней общих для животных и человека.
По масштабу работы ветеринарные
лаборатории бывают: районные, межрайонные
(зональные), областные (краевые) и
республиканские. Основная задача
бактериологических лабораторий —
диагностика болезней сельскохозяйственных
животных (включая птиц), пушных зверей,
рыб, пчел, а также проведение экспертизы
пищевых продуктов и кормов, санитарной
оценки воды, воздуха и почвы.
Лабораторию
размещают в отдельном здании, вдали от
проезжих дорог. В ней предусматривают
приемное отделение, бактериологический,
вирусологический, биохимический,
серологический и патологоанатомический
отделы; выделяют специальные помещения
для стерилизации посуды и питательных
сред, для мытья посуды. Для выполнения
работы в асептических условиях оборудуют
специальные изолированные помещения
— боксы. Лабораторных животных размещают
в виварии. Кроме того, имеются комнаты
для специалистов, обслуживающего
персонала, кабинет заведующего, помещения
для библиотеки, склада, весовой, раздевалки
и др.
Учебная
микробиологическая лаборатория
предназначена для овладения студентами
методами выделения и изучения различных
микроорганизмов. В ней проводятся
лабораторные занятия, предусмотренные
программой, а также научно-исследовательская
работа.
Правила работы,
техника безопасности и личная профилактика
в лаборатории.
-
В помещение входить
только в халате и белой шапочке (косынке). -
В лабораторию
нельзя вносить посторонние вещи,
продукты. -
В помещении
лаборатории категорически запрещается
есть. -
Перед началом
работы обязательно проверяют наличие
и исправность приборов, посуды, горелок
и др. О замеченных недостатках,
неисправностях сообщают преподавателю
или лаборанту. -
Нельзя зажигать
одну горелку от другой. -
Не касаться
металлическими и другими предметами
проводов и контактных частей электросети.
Не включать без ведома преподавателя
или лаборанта любую электроаппаратуру. -
Материал,
используемый для учебных занятий,
должен рассматриваться как особо
опасный. -
При распаковке
материала, присланного для исследования,
необходимо соблюдать осторожность —
банки с материалом снаружи обтирают
ватой, смоченной дез. раствором и ставят
только на подносы или кюветы. -
При исследовании
поступившего материала и работе с
бактериологическими культурами
придерживаются правил исключающих
возможность инфицирования работника. -
Вскрытие трупов
лабораторных животных производят в
специальной одежде, на соответственно
оборудованном столе с помощью необходимых
инструментов, используя для этих целей
кювету, залитую воском (или парафином).
Инструменты после вскрытия помещают
в стакан с дезраствором или обжигают
на пламени горелки, на стол класть
запрещается. -
При работе с жидким
инфицированным материалом используют
резиновые баллоны, соединенные с
пипеткой. -
Жидкости, содержащие
патогенных микробов, переливают над
сосудом с дезраствором. -
Если патологический
материал попал случайно на стол, его
немедленно удаляют тампоном, смоченным
дезинфицирующим раствором. При попадании
зараженного материала на кожу,
конъюнктиву, слизистую ротовой полости
принимают экстренные меры к обеззараживанию. -
По окончании
работы использованные культуры
микроорганизмов, инструменты и
поверхность стола обеззараживают. В
конце занятия бактериальные культуры
и другой материал студенты сдают
преподавателю, а рабочее место приводят
в порядок. Перед уходом из лаборатории
необходимо, вымыть руки и обработать
их спиртом.
Уборка
лабораторного помещения. Помещение
лаборатории ежедневно до работы убирают
влажным способом. Пыль с поверхностей
протирают увлажнённой тряпкой смоченной
дезинфицирующим раствором. После
окончания работы стены, покрытые
метлахскими плитками или окрашенные
масляной краской, моют горячей водой с
мылом или стиральным порошком. Полы
моют 3-5% раствором дезинфектанта. Потолки,
карнизы, верхняя часть стен, окрашенные
клеевой краской, не реже одного раза в
неделю очищают от пыли пылесосом.
Подготовка бокса
к работе.Ежедневно перед началом
работы полы протирают дезинфицирующим
веществом (2%- 5% раствором хлорамина);
воздух обеззараживают бактерицидными
лампами, установленными на высоте 2-2.5
м от поверхности пола, из расчета одна
лампа БУВ-ЗО (1,5—2,5 Вт) на 1м3помещения. При указанных условиях бокс
облучают 2ч. Перед началом работы лампы
выключают. Для того чтобы предотвратить
заражение бокса, образцы материалов,
подлежащие исследованию, вносят в бокс
после предварительного тщательного
протирания их 3% раствором формалина.
Работа в боксе проводится стерильных
халатах, защитных масках и тапочках,
специально предназначенных для бокса.
Воздух в боксе следует регулярно, не
менее 2 раз в неделю, проверять на
бактериальную контаминацию. Чашки с
мясопептонным агаром и средой Сабуро
оставляют открытыми на 15 мин. Посев на
мясопептонном агаре выдерживают в
термостате 48 ч при 37°С, чашки со средой
Сабуро — 96 ч при 22°С. Допустимым ростом
считается 5 колоний на чашках. Количество
колоний больше 5 при 15-минутной экспозиции
является показателем высокой контаминации
воздуха бокса. В этих случаях помещение
бокса нуждается в дополнительной, более
тщательной обработке. Не менее одного
раза в неделю помещение бокса моют
горячей водой с мылом, дезинфицирующими
средствами и протирают досуха.
Уборка рабочего
места.По окончании работы берут
пинцетом кусок ваты, смачивают его в 5%
растворе хлорамина или формалина и
протирают им поверхность стола на
рабочем месте.
Устройство
светового микроскопа и работа с ним.
Микроскоп — сложный
оптический прибор, используемый для
изучения морфологии и тинкториальных
свойств микроорганизмов. Принципиально
все микроскопы устроены одинаково и
состоят из механической части и оптической
системы.
Механическую
часть составляют: основание микроскопа,
тубусодержатель, тубус, система винтов
для передвижения, предметный столик и
револьвер. Оптическую часть составляют
— окуляр, объективы и осветительный
аппарат (рис. 1).
Работа с
иммерсионной системой. Объективы
малого увеличения (3,5,8,9)
применяют главным образом для
предварительного осмотра препарата,
объективы среднего увеличения (20,40) — для изучения
крупных клеток микроорганизмов (например,
грибов); эти объективы называются сухими,
поскольку при микроскопии между
фронтальной линзой и препаратом
находиться воздух. При этом благодаря
различию показателей преломления
воздуха (n=1) и стекла
(n=1,52) часть лучей, освещающих
препарат, рассеивается и не попадает в
объектив.
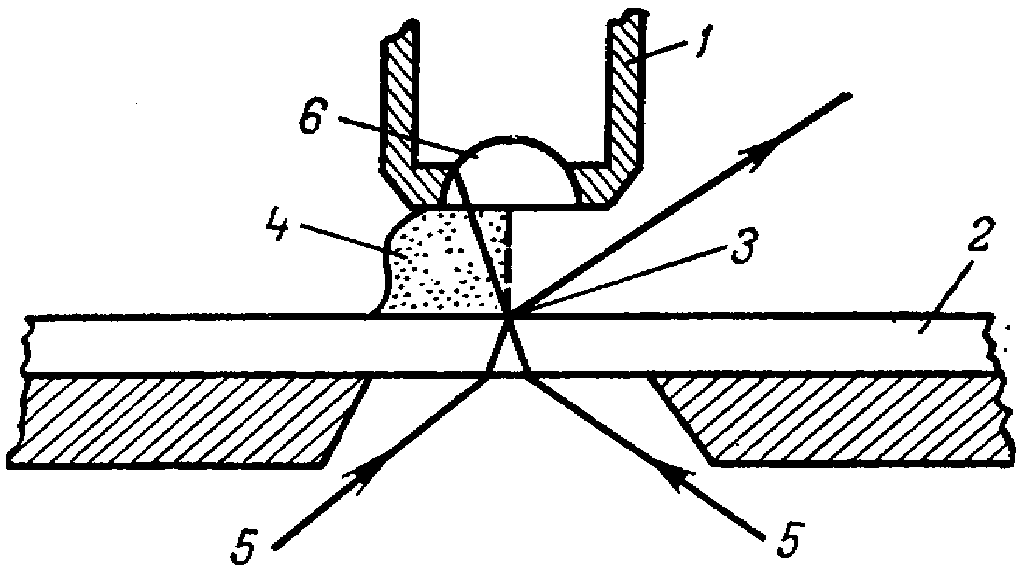
Рис.1.Микроскоп
МБР-1. 1‑основание;
2‑предметный столик; 3‑винты для
перемещения предметного столика;
4‑клеммы; 5‑конденсор; 6‑кронштейн
конденсора; 7‑винт, укрепляющий
конденсор; 8‑рукоятка перемещения
конденсора; 9‑рукоятка ирисовой
диафрагмы конденсора; 10‑зеркало;
11‑тубусодержатель; 12‑рукоятка
макрометрического винта; 13‑рукоятка
микрометрического винта; 14‑револьвер;
15‑объектив; 16‑наклонный тубус;
17‑винт для крепления тубуса; 18‑окуляр.
Объективы
больших увеличений (85,
90)
носят название иммерсионных. При работе
с ними необходима максимальная
освещенность препарата; устранение
рассеивания, неизбежного при работе с
сухими объективами, в данном случае
достигается путем использования
иммерсионных жидкостей, у которых
показатель преломления близок к
показателю преломления стекла (рис.2).
Рис.
2. Схема лучей в иммерсионной системе.
1
‑ объектив микроскопа; 2 ‑ предметное
стекло; 3 ‑ объект исследования; 4 ‑
иммерсионное масло; 5 ‑ лучи света;
6 ‑ фронтальная линза объектива.
Вначале под малым
увеличением микроскопа наводят свет
и определяют на препарате участок
микроскопирования. Затем на выбранное
место наносят каплю иммерсии и осторожно
(под контролем глаз с боку) погружают в
нее фронтальную линзу иммерсионного
объектива (90).
Иммерсионные объективы имеют короткое
фокусное расстояние (до 2,3 мм) поэтому
наводить на резкость следует путем
поднимания объектива, а не опускания
его, так как при небольшом рабочем
расстоянии можно раздавить препарат и
повредить фронтальную линзу. После
грубой наводки, которую проводят с
помощью макрометрического винта, руки
переводят на микрометрический винт и
осуществляют точную фокусировку. По
окончании работы объектив поднимают,
убирают препарат, а с фронтальной линзы
кусочком фильтровальной бумаги убирают
иммерсию.
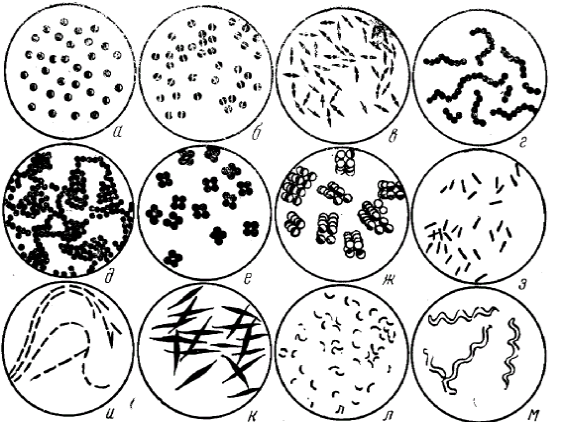
Морфология
бактерий.По форме бактерий подразделяют
на три основные группы: шаровидные
(кокки), цилиндрические (палочки) и
извитые (рис. 3).
Для различных
видов кокковхарактерно
своеобразное расположение клеток,
обусловленное способом деления.
Микрококки —
беспорядочно расположенные кокки, в
диаметре не превышают 0,5 мкм.
Диплококки —
кокки, располагающиеся попарно, делятся
в одной плоскости.
Стрептококки— деление их происходит в одной плоскости
и образующиеся клетки не разъединяются,
располагаясь цепочками, различной
длины.
Тетракокки—
сочетание шаровидных микробов по четыре,
деление у которых происходит в двух
взаимно перпендикулярных плоскостях.
Стафилококки— делятся в различных плоскостях без
особой закономерности, образуя
беспорядочное скопление клеток, иногда
напоминающее грозди винограда.
Сарциныпо
форме напоминают пакеты или тюки.
Образуются в результате деления в трёх
взаимно перпендикулярных плоскостях.
Палочковидныемикроорганизмы подразделяются на
бактерии, бациллы и клостридии.
Бактерии-цилиндрической формы, не образуют спор.
Бациллы —спорообразующие палочки по типу дыхания
аэробы, т.е. для своего развития нуждаются
в свободном молекулярном кислороде
воздуха.
Клостридии —
спорообразующие палочки, по типу дыхания
анаэробы (не использующие кислород
воздуха), диаметр их споры превышает
ширину микробной клетки.
Извитыебактерии разделяются на вибрионы,
спириллы и спирохеты.
Рис.
3. Основные формы бактерий:
а
– микрококки; б, в – диплококки; г –
стрептококки; д ‑ стафилококки;
е – тетракокки; ж – сарцины; з, и, к ‑
палочки; л – вибрионы; м – спириллы
Вибрионыимеют форму запятой, летящей чайки,
поворот вокруг оси не превышает четверти
оборота.
Спириллы—
характеризуются небольшим числом
крупных завитков (не более пяти).
Передвигаются с помощью жгутиков.
Спирохеты—
имеют штопорообразную форму с большим
количеством завитков. На конце тела
пучком расположены жгутики.
ОТ АВТОРОВ
Предлагаемое учебное пособие построено в соответствии с действующей программой и позволяет осуществить все основные работы, рекомендуемые ею. Авторы предлагают и некоторые работы, выходящие за пределы программы, которые могут быть использованы на практикуме или при проведении исследований по курсовым и выпускным работам студентов. Перед каждой работой помещен перечень необходимого оборудования и материалов для проведения данной работы.
Почти все предлагаемые работы проверены нами неоднократно практически при проведении занятий со студентами Ленинградского педагогического института им. А. И. Герцена. В описание многих работ внесены некоторые изменения по сравнению с методиками, изложенными в других практических руководствах. В пособии даны рецепты приготовления тех питательных сред, бактериологических красок и других реактивов, которые используются при проведении рекомендуемых работ. Способы приготовления и стерилизации наиболее употребляемых сред приведены в общей части. Способы приготовления сред, имеющих элективный характер, используемых для выращивания только определенных групп микроорганизмов, даны в конкретных работах.
Некоторые работы по почвенным микроорганизмам, описание которых дано в практикуме, могут быть использованы при проведении летних занятий по курсу физиологии растений. Логическая связь между этими работами по микробиологии и вопросами физиологии растений легко устанавливается.
Авторы будут признательны за замечания, которые возникнут в процессе использования данного практикума.
1. ОБЩАЯ ЧАСТЬ
Правила работы при выполнении микробиологического практикума
В педагогических институтах не разрешается работать с патогенными микроорганизмами в живом состоянии. Знакомство студентов с этой группой микробов осуществляется путем де-монстрации готовых фиксированных препаратов, полученных из специальных медицинских лабораторий. Тем не менее следует иметь в виду, что при посеве сапрофитных микроорганизмов из окружающей среды случайно может быть высеяна и патогенная форма. Сама работа с сапрофитными формами в ряде случаев требует абсолютной стерильности для получения надежных результатов опыта. В связи с этим многие правила работы в микробиологическом практикуме пединститутов являются общими с любой бактериологической лабораторией.
Для микробиологического практикума отводят специальные помещения:
1) лабораторную комнату для занятий только по микробиологии;
2) стерилизационную, где установлен автоклав и другие стерилизационные аппараты;
3) моечную;
4) препараторскую, приспособленную для хранения сред, культур и подготовки к занятиям. В ней ставят холодильник для хранения сред и культур.
Для проведения работ, требующих абсолютной стерильности (например, для пересева чистых коллекционных культур), в одном из помещений устраивают застекленный бокс, в котором устанавливают бактерицидную лампу (БУФ-15, БУФ-30) на высоте около 2 м от пола.
Лабораторная комната должна выходить окнами на север, а естественное освещение ее должно быть не менее 110 лк. Стены комнаты окрашивают в светлые тона на всю высоту масляной краской, чтобы их можно было мыть. Полы покрывают линолеумом. Лабораторные столы имеют подводку электроэнергии к каждому рабочему месту, и если в институте имеется газ, то на каждом рабочем месте устанавливают газовую горелку, заменяющую спиртовку. Поверхность столов покрывают пластиком или линолеумом, что облегчает их дезинфекцию.
За студентом в лаборатории закрепляют постоянное место и оборудование.
На рабочем месте не должно быть ничего лишнего. Оборудование, которое требуется почти на каждом занятии, устанавливают на длительное время, что значительно облегчает работу лаборанта при подготовке к занятиям. Таким оборудованием являются микроскоп, покрытый полиэтиленовым чехлом, осветитель, набор наиболее ходовых красителей, бактериологические петли и иглы, шпатели, градуированные и неградуированные (пастеровские) пипетки, предметные стекла обычные и с углублениями, покровные стекла, стеклянный мостик в ванночке для окраски препаратов, промывала с водой, дезинфицирующая жидкость, вата, фланелевая тряпочка, карандаш по стеклу, иммерсионное масло, песочные часы, фильтровальная бумага, спиртовка, спички.
Наличие и исправность оборудования проверяются лаборантом перед каждым занятием, и к нему добавляется то, что требуется для проведения данной темы.
Работать в лаборатории следует в халате и шапочке или косынке. В лаборатории не разрешается есть, курить, много ходить и делать порывистые движения.
Использованные в работе предметы помещают в сосуды с дезинфицирующей жидкостью (1%-ный раствор хлорамина, 3%-ный раствор фенола). Металлические предметы (иглы, петли, пинцеты) после каждого соприкосновения с культурами прожигают в пламени спиртовки или газовой горелки.
Предметы и одежду, на которые случайно попала капля ис-следуемого материала, немедленно обрабатывают дезинфицирующим раствором. После окончания работы руки протирают дезинфицирующим раствором и моют с мылом.
Периодически все помещения лаборатории убирают с применением дезинфицирующих средств, а бокс подвергают такой обработке ежедневно перед занятиями и после уборки в нем включают бактерицидную лампу на 30 мин.
Обработка лабораторной посуды
Посуда, используемая в микробиологическом практикуме, должна быть абсолютно чистой, а в ряде случаев и стерильной. Загрязненную посуду обрабатывают хромовой смесью (на 150 мл концентрированной серной кислоты добавляют 25 г измельченного бихромата калия и оставляют на сутки для растворения), которая является сильным окислителем и хорошо очищает стекло от органических остатков. После 30-40 мин пребывания в хромовой смеси посуду промывают проточной водой.
Новую лабораторную посуду кипятят в мыльной воде 15 мин, затем ополаскивают холодной водой. Если посуда после этого оказывается недостаточно чистой, ее кипятят еще 10-15 мин в 1%-ном растворе соляной кислоты, а затем снова ополаскивают, водой.
Градуированные пипетки, используемые в практикуме, как и в количественном химическом анализе, должны быть абсолютно обезжиренными. На стенках (плохо обезжиренных пипеток остаются капли воды, и это служит источникам погрешностей при отмеривании (жидкостей.
(При обработке пипеток не следует втягивать в них ртом хромовую смесь и другие моющие средства. Это делают при помощи резинового баллончика, надеваемого на пипетку.
Предметные стекла, сохранившие жир на поверхности, совершенно непригодны для работы, так как капля воды, нанесенная на такое стекло, не растекается равномерно, а распадается на ряд мелких капель.
При приготовлении мазков недостаточно вымытые стекла очень (мешают работе. Стекла погружают на 2 ч в хромовую смесь, после чего хорошо промывают проточной водой. Затем их кипятят 30 мин в 5%-<ном растворе соды, снова промывают водой и пинцетом переносят в смесь Никифорова (смесь равных объемов спирта-ректификата и эфира), в которой их хранят. Стекла из смеси Никифорова вынимают при помощи пинцета. Моют стекла в резиновых перчатках, чтобы избежать занесения жира с рук.
Любую вымытую посуду не вытирают, а сушат при комнатной температуре или, если ее используют в ближайшее время, в сушильном шкафу при температуре 100-105°С. Чистую посуду следует хранить закрытой ватными пробками в местах, защищенных от попадания пыли.
Рецепты приготовления питательных сред
Приготовление мясо-пептонного бульона (МПБ)
На жидкой среде МПБ может развиваться большинство гете-ротрофных микроорганизмов. Для приготовления бульона используют говяжье мясо, полностью очищенное от костей, сухожилий и жира. К 1 л водопроводной воды добавляют 500 г мяса, пропущенного через мясорубку, и оставляют настаиваться на холоду <в течение суток. Настой процеживают сквозь марлю, отжимают мясо и ставят в холодную водяную баню. Доводят воду в бане до кипения и выдерживают настой в кипящей воде ‘/г *o Затем настой фильтруют через тряпочку из хлопчатобумажной ткани.
К бульону добавляют 5 г поваренной соли и 10 г лептона. Затем осаждают растворимые белки, для этого бульон выдерживают в автоклаве при 1 атм в течение 20 мин.
Для более полного осаждения белков и полной прозрачности бульона перед помещением его в автоклав вливают в бульон взбитый белок одного куриного яйца с равным количеством воды. После осаждения белков бульон фильтруют через бумажный (лучше складчатый) фильтр и проверяют его pH индикаторной бумажкой.
Обычно бульон имеет слабокислую реакцию и поэтому непригоден для выращивания бактерий. Поэтому его нейтрализуют до слабощелочной реакции, добавляя 10%-ный -раствор бикарбоната натрия. После этого бульон помещают в колбу, закрывают ее ватной пробкой с бумажным колпачком и стерилизуют при 1 атм в течение 20 мин.
В ряде случаев и после осаждения бульон не бывает абсолютно (прозрачным. Тогда оса1ж|дение коллоидных частиц проводят повторно после нейтрализации, проводя описанные выше процедуры.
Готовый бульон должен быть абсолютно прозрачным, янтарно-желтого цвета.
Приготовление бульона описанным способом — процесс дли-тельный и трудоемкий, который можно значительно упростить, имея в распоряжении бульонные кубики. В этом случае достаточно растворить 2 бульонных кубика в 1 л воды при кипячении. Затем бульон фильтруют через ватный фильтр и стерилизуют указанным способом. В бульон не добавляют поваренной соли, но проверяют pH среды. Опыт показывает, что более концентрированный будьон делать не следует, так как рост культур на нем происходит хуже.
Приготовление мясо-пептонного агара (МПА)
МПА представляет собой универсальную твердую среду, которая плавится только при температуре около 100°С и позволяет работать практически в любых температурных условиях. Исходной средой для приготовления МПА является М1ПБ, приготовленный описанным выше способам.
К готовому бульону добавляют 2% агара и нагревают в автоклаве с открытым вентилем и незавинченной крышкой до полного растворения агара. Горячую среду нейтрализуют 10%-ным раствором соды до слабощелочной реакции.
Осаждение коллоидных частиц проводят способом, указанным при приготовлении МПБ, фильтруют через складчатый фильтр в’горячем виде прямо в открытом автоклаве (агар затвердевает при температуре около 40°Q. Профильтрованный МПА стерилизуют при 1 атм в течение 20 мин в колбе с ватной пробкой и бумажным колпачком.
Примечание. Фильтрование МПА — длительная процедура, требующая поддержания высокой температуры фильтруемой среды.
Приготовление мясо-пептонной желатины (МПЖ)
МПЖ-твердая питательная среда-плавится при температуре около 25°С и поэтому непригодна для выращивания ряда микроорганизмов, развивающихся при более высокой температуре. Однако использование этой среды необходимо при работе с определением вида бактерий (работа 21), так как разжижение или неразжижение желатины микробами является одним из ди-агностических признаков при определении.
Исходной средой для приготовления МПЖ также является мясо-пептонный бульон, в который добавляют от 12 до 25% мелко нарезанной желатины. Количество желатины устанавливается эмпирически в зависимости от температуры, при которой приходится работать. Среда должна застывать при комнатной температуре. Чем выше температура, тем больше требуется желатины.
Желатину растворяют в бульоне при температуре не выше 100°С, среду нейтрализуют до слабощелочной реакции и проводят осаждение с применением белка куриного яйца в автоклаве с открытым вентилем при температуре 100°С. После этого среду, фильтруют в колбу, в которой ее хранят, или разливают по пробиркам и стерилизуют методом тиндализации (с. 12).
Нагревание сред с желатиной выше 100°С не допускается, так как в этом случае желатина меняет свойства и не застывает при охлаждении.
Приготовление молока как питательной среды
Молоко содержит все питательные вещества, необходимые гетеротрофным организмам. В данном практикуме молоко используют как среду при определении вида бактерий (работа 21). Свертывание или несвертывание -молока микроорганизмом (образование или отсутствие образования кислоты) является одним из диагностических признаков при определении его вида.
Для приготовления среды используют снятое молоко, которое разливают в пробирки примерно по 10 мл, затем закрывают их ватными пробками и стерилизуют методом тиндализации.
Стерилизация молока при более высокой температуре приводит к карамелизации молочного сахара. Внешне это выражается в изменении цвета молока (топленое молоко). Для определения образования микроорганизмами кислоты в молоко перед стерилизацией можно добавить небольшое ^количество 5%-ной настойки лакмуса. Тогда образование кислоты будет определяться не только свертыванием молока, но и покраснением среды.
Приготовление картофельной среды
Картофельные среды, содержащие необходимые питательные вещества, широко используют для выращивания гетеротрофных микроорганизмов.
В данном практикуме ломтики картофеля используют при работе с определением вида (работа 21). Характер роста некоторых бактерий является одним из диагностических признаков при определении вида.
Для приготовления среды выбирают хорошие, неповрежденные клубни картофеля, из которых вырезают плоские ломтики в том случае, если выращивание будет проводиться в чашках Петри. Если выращивание предполагается в пробирках, то из клубня пробочным сверлом вырезают цилиндрические куски, которые рассекают потом на 2 клина. Клин помещают в пробирку так, чтобы косая поверхность была обращена кверху.
Для нейтрализации кислой среды клеточного сока поверхность кусков картофеля натирают мелом, затем помещают в чашки Петри (или /пробирки). Дно чашки Петри выстилают фильтровальной бумагой, а на дно пробирки кладут кусочек ваты для впитывания -воды, образующейся при варке.
Если среда рассчитана на длительное хранение в пробирках, то под вату наливают немного воды, так как при хранении картофель подсыхает. Стерилизацию проводят при 1 атм в течение 30 мин.
Примечания. 1. Со стерилизацией нельзя медлить, так как картофель быстро темнеет и будет непригоден для работы. Нагревание разрушает ферменты, и потемнения не происходит.
2. Режим стерилизации следует строго выдерживать. При не-достаточной стерилизации стойкие споры, находящиеся постоянно на картофеле, сохранятся и дадут рост.
Приготовление пивного сусла
Неохмеленное пивное сусло, полученное с пивоваренного завода, используют для культивирования многих микроорганизмов. Оно является прекрасной средой для молочнокислых бактерий и дрожжей. При отсутствии готового сусла пользуются солодовой средой, которую готовят нижеследующим способом.
Зерновки ячменя проращивают до наклевывания, затем высушивают их при температуре 60-70°С и мелют на’ кофейной мельнице.
Нагревают 1 л «воды до 50°С и при перемешивании всыпают в нее 250 г молотого солода. Оставляют в воде без нагревания на 30 мин, затем воду нагревают и поддерживают ее температуру 55-58°С. Время от времени из жидкости берут пробы на крахмал (иодная проба). Когда иодная проба покажет полное осахаривание крахмала, сусло фильтруют и затем стерилизуют при % атм в течение 30 мин (также стерилизуют готовое сусло).
Следует иметь в виду, что для культивирования дрожжей ис-пользуют сусло с содержанием сахара 6-8%, а для молочнокислых бактерий -8-12%. Поэтому в сусле нужно определить содержание сахара.
Приготовление голодного агара
В автоклаве с открытым вентилем растворяют агар в водопроводной воде. Агара берут 2% по отношению к объему веды. После полного растворения агар осветляют и фильтруют в горячем воде. Среду стерилизуют при 1 атм в течение 20 мин.
Скачать бесплатно Лебеденко И.Ю., Еричева В.В., Маркова Б.П. — Руководство к практическим занятиям по ортопедической стоматологии. Для студентов 4 курса. djv
Название: Руководство к практическим занятиям по ортопедической стоматологии. Для студентов 4 курса.
Автор: Лебеденко И.Ю., Еричева В.В., Маркова Б.П.
Год издания: 2007
Размер: 9.75 МБ
Формат: djv
Язык: Русский
Данное руководство к практическим занятиям по ортопедической стоматологии в редакции И.Ю. Лебеденко предназначено для студентов 4 курса. В руководстве содержится 2 основных раздела, которые приводят ортопедическое лечение пациентов с представленными здесь ортопедическими заболеваниями, которым уделяется основное внимание на 4 курсе профильного факультета — полное отсутствие зубов в клинической практике ортопеда-стоматолога и болезни пародонта в ортопедическом стоматологическом аспекте.

Также рекомендуем скачать
Название: Ортопедическая стоматология. 5-е издание
Автор: Щербаков А.С., Гаврилов Е.И., Трезубов В.Н., Жулев Е.Н.
Год издания: 1998
Размер: 5.55 МБ
Формат: pdf
Язык: Русский
Описание: Практическое руководство «Ортопедическая стоматология» под ред., Щербакова А.С., и соавт., рассматривает вопросы пропедевтики в ортопедии (обследование пациента, физиология и анатомия зубочелюстной си… Скачать книгу бесплатно
Название: Окклюзионные шины
Автор: Хватова В.А., Чикунов С.О.
Год издания: 2010
Размер: 9.83 МБ
Формат: pdf
Язык: Русский
Описание: Практическое руководство «Окклюзионные шины» под ред., Хватовой В.А., и соавт., рассматривает вопросы применения данного вида шин в ортопедической стоматологической практике. Изложены виды и характери… Скачать книгу бесплатно
Название: Применение термопластических материалов в стоматологии
Автор: Трегубов И.Д., Михайленко Л.В., Болдырева Р.И., Маглакелидзе В.В., Трегубов С.И.
Год издания: 2007
Размер: 14.16 МБ
Формат: pdf
Язык: Русский
Описание: «Применение термопластических материалов в стоматологии» под ред., Трегубова И.Д., и соавт., рассматривает использование термопластических материалов в ортопедической стоматологии. Описаны химические … Скачать книгу бесплатно
Название: Зуботехническое дело в стоматологии
Автор: Смирнов Б.А., Щербаков А.С.
Год издания: 2002
Размер: 8.03 МБ
Формат: djvu
Язык: Русский
Описание: Практическое руководство «Зуботехническое дело в стоматологии» под ред.. Смирнова Б.А., и соавт., рассматривает анатомо-физиологические особенности жевательного аппарата. Описана его биомеханика. Изло… Скачать книгу бесплатно
Название: Вантовые зубные протезы
Автор: Ряховский А.Н.
Год издания: 2003
Размер: 33.23 МБ
Формат: djvu
Язык: Русский
Описание: «Вантовые зубные протезы» под ред., Ряховского А.Н., рассматривает основы и этапы вантового протезирования. Изложены традиционные методики протезирования; описаны методики вантовых систем и шинировани… Скачать книгу бесплатно
Название: Точный оттиск
Автор: Ряховский А.Н., Мурадов М.А.
Год издания: 2006
Размер: 23.28 МБ
Формат: djvu
Язык: Русский
Описание: Практическое руководство «Точный оттиск» под ред., Ряховского А.Н., и соавт., рассматривает методику выбора оптимального оттискного материала и его применения в клинической практике стоматологом. Пред… Скачать книгу бесплатно
Название: Изготовление металлокерамических конструкций: Практический атлас
Автор: Мороз А.Б.
Год издания: 2007
Размер: 30.17 МБ
Формат: djvu
Язык: Русский
Описание: «Изготовление металлокерамических конструкций: Практический атлас» под ред., Мороз А.Б., рассматривает производство металлокерамических протезов. Описана этапность выполнения данных конструкций. Описа… Скачать книгу бесплатно
Название: Оттискные материалы в стоматологии
Автор: Ибрагимов Т.И., Цаликова Н.А.
Год издания: 2007
Размер: 1.75 МБ
Формат: djvu
Язык: Русский
Описание: Практическое пособие «Оттискные материалы в стоматологии» под ред., Ибрагимова Т.И., и соавт., рассматривает методику выбора оптимального оттискного материала и его применения в клинической практике с… Скачать книгу бесплатно
Название: Функциональные и аппаратурные методы исследования в ортопедической стоматологии
Автор: Лебеденко И.Ю., Ибрагимов Т.И., Ряховский А.Н.
Год издания: 2003
Размер: 65.77 МБ
Формат: pdf
Язык: Русский
Описание: Учебное руководство «Функциональные и аппаратурные методы исследования в ортопедической стоматологии» под ред., Лебеденко И.Ю., и соавт., рассматривает вопросы диагностики в практике стоматолога. Изло… Скачать книгу бесплатно
Название: Челюстно-лицевая ортопедическая стоматология
Автор: Жулев Е.Н., Арутюнов С.Д., Лебеденко И.Ю.
Год издания: 2008
Размер: 13.71 МБ
Формат: djvu
Язык: Русский
Описание: Практическое пособие «Челюстно-лицевая ортопедическая стоматология» под ред., Жулева Е.Н., и соавт., рассматривает вопросы этиологии, патогенеза, патоморфологии. клинической картины, диагностики врожд… Скачать книгу бесплатно
Учебная литература
медицинских вузов для студентов
РУКОВОДСТВО
К
ПРАКТАЧЕСКИМ
ЗАНЯТИЯМ
ПО
МЕДИЦИНСКОЙ
МИКРОБИОЛОГИИ,
ВИРУСОЛОГИИ
И ИММУНОЛОГИИ
Под редакцией
доктора медицинских
наук,
профессора В.В.Теца
Издание второе,
переработанное и дополненное
Допущено
Департаментом образовательных
медицинских учреждений и кадровой
политики Министерства здравоохранения
Российской Федерации в качестве учебного
пособия для студентов медицинских
вузов
Руководство
к практическим занятиям по медицинской
Р85 микробиологии, вирусологии и
иммунологии/Под ред. В.В.Теца. — Изд.
2-е, перераб. и доп. — М.: Медицина, 2002. —
352 с.: ил. ISBN
5-225-04644-4
Настоящее
руководство представляет собой 2-е
издание «Руководства к лабораторным
занятиям по медицинской микробиологии,
вирусологии и иммунологии» (М.:
Медицина, 1993), все разделы которого
кардинально переработаны проф.
В.В.Тецем, проф. И.С.Фрейдлин и доц.
Е.Н.Шмидт.
Руководство
рекомендуется для самостоятельной
подготовки к практическим занятиям.
Изложены общие сведения о методах
изучения микробов. Рассказано о методах
стерилизации, дезинфекции и определении
чувствительности микробов к антибиотикам.
Описаны основы прикладной иммунологии.
Приведены современные методы диагностики
многих инфекций.
Для студентов
медицинских вузов.
ББК 52.64
Авторы
выражают благодарность &.К.Артеменко
и В. И. Кура-новой за помощь в подготовке
р&пмЪ* к изданию.
• •
ISBN
5-225-04644-4 ^ g
/©^Ъллектив авторов, 2002
Все
права авторов защищены. 10f
odnfj^c—mb
этого издания не может быть занесена
в память компьютера Либо вйКюивведена
любым способом без предварительного
письменного разрешения иЗщлпеЛя.
Коллектив авторов
|
Тец
Виктор |
заведующий |
|
БОРИСОВ |
профессор |
|
КОЗЬМИН-СОКОЛОВ |
профессор кафедры |
|
ФРЕЙДЛИН |
завеующий |
|
ШМИДТ Елена |
доцент кафедры |
Часть
I.
Общая медицинская микробиология,
вирусология и иммунология
|
Глава 1. |
8 |
|
Тема |
10 |
|
Глава 2. |
16 |
|
Тема |
19 |
|
Тема 2.2. Изучение |
22 |
|
Тема 2.3. актиномицетов |
26 |
|
Тема 2.4. риккетсий, |
29 |
|
Глава 3. |
30 |
|
Тема |
35 |
|
Тема 3.2. |
44 |
|
Глава 4. |
50 |
|
Тема 4.1. Морфология |
52 |
|
Глава 5. Облигатные |
54 |
|
Тема |
55 |
|
Тема |
56 |
|
Тема |
63 |
|
Глава 6. |
67 |
|
Тема 6.1. |
68 |
|
Глава |
71 |
|
Тема |
71 |
|
Тема |
77 |
|
Глава 8. |
85 |
|
Тема 8.1. Микрофлора |
86 |
|
Тема |
95 |
|
Тема 8.3. Микрофлора |
100 |
|
Глава 9. |
104 |
|
Тема 9.1. Инфекция, |
104 |
|
Глава 10. |
110 |
|
Тема 10.1. Методы |
111 |
|
Тема |
121 |
|
Тема 10.3. Методы |
133 |
|
Тема 10.4. Методы |
142 |
|
Часть |
|
|
Глава |
147 |
|
Тема |
148 |
|
Глава 12. |
158 |
|
Тема |
159 |
|
Тема 12.2. Анаэробные |
171 |
|
Глава 13. |
178 |
|
Тема |
180 |
|
Тема |
189 |
|
Тема 13.3. Возбудители |
198 |
|
Глава 14. |
209 |
|
Тема 14.1. Возбудители |
211 |
|
Тема 14.2. Возбудители |
220 |
|
Тема 14.3. |
233 |
|
Глава 15. Возбудители |
246 |
|
Тема 15.1. Возбудители |
247 |
|
Тема |
252 |
|
Глава 16. |
257 |
|
Тема |
260 |
|
Глава 17. Возбудители |
280 |
|
Тема 17.1. |
282 |
|
Глава 18. |
288 |
|
Тема |
289 |
|
Глава 19. Возбудители |
296 |
|
Тема |
299 |
|
Глава 20. Возбудители |
310 |
|
Тема |
312 |
|
Глава |
319 |
|
Тема |
322 |
|
Глава 22. Онкогенные |
335 |
|
Тема |
338 |
|
Глава 23. |
342 |
|
Тема 23.1. |
343 |
|
Глава 24. |
348 |
|
Тема 24.1. |
350 |