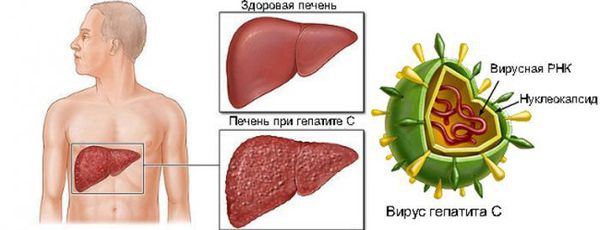
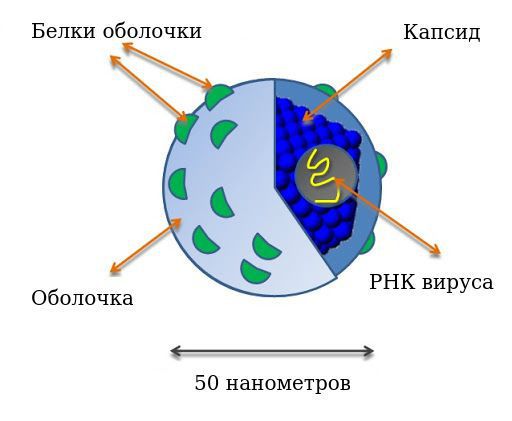
Таблетки Софосбувир и Велпатасвир 400 мг/100 мг представляют собой лекарственный препарат, который содержит действующие вещества софосбувир и велпатасвир в одной таблетке. Его назначают для лечения хронической (продолжительной) вирусной инфекции печени, называемой гепатитом С, у пациентов в возрасте 6 лет и старше и весом не менее 17 кг.
Действующие вещества в данном лекарственном препарате действуют вместе, блокируя два различных белка, которые необходимы вирусу для роста и размножения, что позволяет навсегда убрать инфекцию из организма.
Очень важно, чтобы Вы также прочитали инструкции по медицинскому применению других лекарственных препаратов, которые Вы будете принимать вместе с таблетками Софосбувир и Велпатасвир 400 мг/100 мг. Если у Вас возникнут вопросы касательно принимаемых лекарственных препаратов, проконсультируйтесь с Вашим лечащим врачом.
• если Вы страдаете от аллергии на софосбувир, велпатасвир или любой из компонентов, входящих в состав данного лекарственного препарата (см. раздел «Что содержат таблетки» данной инструкции).
При наличии аллергии не принимайте таблетки Софосбувир и Велпатасвир 400 мг/100 мги немедленно сообщите об этом своему лечащему врачу.
• Если вы принимаете какие-либо из перечисленных далее лекарственных препаратов:
— рифампицин или рифабутин (антибиотики, используемые для лечения инфекций, включая туберкулез)
— зверобой (лекарственный препарат растительного происхождения, используемый для лечения депрессии)
— карбамазепин, фенобарбитал или фенитоин (лекарственные препараты, используемые для лечения эпилепсии и предотвращения судорог).
Обратитесь к своему лечащему врачу, если:
• у Вас имеются проблемы с печенью, помимо гепатита С, например,
— если у Вас имеется в настоящее время или имелся ранее вирусный гепатит В, в связи с чем Ваш лечащий врач может захотеть более тщательно следить за Вашим состоянием
— если у Вас была пересадка печени
• у Вас проблемы с почками или Вы находитесь на диализе почек по причине того, что софосбувир/велпатасвир не был должным образом испытан на пациентах с определенными серьезными заболеваниями почек
• Вы лечитесь от вируса иммунодефицита человека (ВИЧ), в связи с чем Ваш лечащий врач может захотеть более тщательно следить за Вашим состоянием
Перед началом приема таблеток Софосбувир и Велпатасвир 400 мг/100 мг проконсультируйтесь со своим лечащим врачом в следующих случаях:
• Вы в настоящее время принимаете или в последние несколько месяцев принимали лекарственный препарат амиодарон для лечения аритмии сердца, что может привести к опасному для жизни замедлению сердечного ритма. Ваш лечащий врач может рассмотреть альтернативные методы лечения, если Вы принимали данный лекарственный препарат. В случае необходимости лечения таблетками Софосбувир и Велпатасвир 400 мг/100 мг Вам может потребоваться дополнительное наблюдение за частотой сердечных сокращений.
• у Вас диабет. Может потребоваться более тщательный мониторинг уровня глюкозы в крови и/или коррекция дозы противодиабетического препарата после начала лечения таблетками Софосбувир и Велпатасвир 400 мг/100 мг. У некоторых пациентов с диабетом отмечается низкий уровень сахара в крови (гипогликемия) после начала лечения такими препаратами, как таблетки Софосбувир и Велпатасвир 400 мг/100 мг.
Сразу же сообщите своему лечащему врачу, если Вы в настоящее время принимаете или в последние несколько месяцев принимали лекарственные препараты для лечения сердечных заболеваний и в ходе терапии Вы испытываете следующие симптомы:
• замедленное или нерегулярное сердцебиение либо проблемы с сердечным ритмом
• одышка или усиление имеющейся одышки
• боль в груди
• предобморочное состояние
• сердцебиение
• предобморочное состояние или обморок.
Анализ крови
Ваш лечащий врач будет назначать анализ крови до, в течение и после терапии таблетками Софосбувир и Велпатасвир 400 мг/100 мг. Это необходимо для того, чтобы:
• Ваш лечащий врач смог решить, следует ли Вам принимать таблетки Софосбувир и Велпатасвир 400 мг/100 мг и как долго.
• Ваш лечащий врач смог подтвердить, что лечение было успешным и Вы вылечились от вирусного гепатита С.
Дети и подростки
Не давайте данный лекарственный препарат детям в возрасте до 6 лет или весом менее 17 кг. Применение софосбувира/велпатасвира у пациентов в возрасте до 6 лет до сих пор не изучено.
Сообщите своему лечащему врачу, если Вы принимаете, недавно принимали или собираетесь принимать какие-либо другие препараты, такие как варфарин или схожие лекарственные препараты, относящиеся к антагонистам витамина К, которые используются для разжижения крови. Ваш врач может увеличить частоту сдачи анализов крови, чтобы проверить, насколько хорошо сворачивается Ваша кровь. При лечении гепатита С функция Вашей печени может измениться, что может повлиять на другие лекарственные препараты (например, препараты, используемые для подавления иммунной системы и т.д.). Вашему лечащему врачу может потребоваться внимательно следить за другими лекарственными препаратами, которые Вы принимаете, и корректировать их дозу после начала приема таблеток Софосбувир и Велпатасвир 400 мг/100 мг.
Если Вы не уверены, обратитесь к Вашему лечащему врачу.
Некоторые лекарственные препараты нельзя принимать вместе с таблетками Софосбувир и Велпатасвир 400 мг/100 мг.
• Не принимайте другие лекарственные препараты, содержащие софосбувир, одно из действующих веществ таблеток Софосбувир и Велпатасвир 400 мг/100 мг.
Сообщите своему лечащему врачу, если Вы принимаете какое-либо из нижеперечисленных лекарственных препаратов:
• амиодарон, используемый для лечения аритмии сердца
• рифапентин (антибиотик, используемый для лечения инфекций, включая туберкулез)
• окскарбазепин (лекарственный препарат, используемое для лечения эпилепсии и предотвращения судорог)
• тенофовира дизопроксил или любой лекарственный препарат, содержащее тенофовира дизопроксил, используемое для лечения ВИЧ-инфекции
• эфавиренц, используемый для лечения ВИЧ-инфекции
• дигоксин, используемый для лечения сердечных заболеваний
• дабигатран, используемый для разжижения крови
• модафинил, используемый для лечения нарушений сна
• розувастатин или другие статины, используемые для лечения высокого уровня холестерина.
Применение таблеток Софосбувир и Велпатасвир 400 мг/100 мг с любым из перечисленных выше лекарственных препаратов может блокировать действие Ваших лекарственных препаратов или усиливать побочные эффекты. Вашему лечащему врачу может потребоваться назначить Вам другой лекарственный препарат или скорректировать дозу лекарственного препарата, которую Вы принимаете. Указанное изменение может касаться таблеток Софосбувир и Велпатасвир 400 мг/100 мг или другого лекарственного препарата, которое Вы принимаете.
Проконсультируйтесь со своим лечащим врачом, если Вы принимаете лекарственные препараты, используемые для лечения язвы желудка, изжоги или кислотного рефлюкса, так как они могут уменьшить количество велпатасвира в Вашей крови. К таким лекарственным препаратам относятся:
• антациды (такие как гидроксид алюминия/магния или карбонат кальция). Их следует принимать как минимум за 4 часа до или через 4 часа после приема таблеток Софосбувир и Велпатасвир 400 мг/100 мг.
• ингибиторы протонного насоса (такие как омепразол, лансопразол, рабепразол, пантопразол и эзомепразол). Таблетки Софосбувир и Велпатасвир 400 мг/100 мг следует принимать во время еды за 4 часа до приема ингибитора протонного насоса.
• антагонисты Н2-рецепторов (такие как фамотидин, циметидин, низатидин или ранитидин). Если Вам необходимы высокие дозы этих лекарственных препаратов, Ваш лечащий врач может назначить Вам другой препарат или скорректировать дозу препарата, который Вы принимаете.
Указанные лекарственные препараты могут уменьшить количество велпатасвира в Вашей крови. Если Вы принимаете одно из этих лекарственных препаратов, Ваш лечащий врач либо назначит вам другой препарат от язвы желудка, изжоги или кислотного рефлюкса, либо порекомендует, как и когда принимать его.
Не кормите грудью во время лечения таблетками Софосбувир и Велпатасвир 400 мг/100 мг. Неизвестно, попадают ли в человеческое грудное молоко софосбувир или велпатасвир, два действующих вещества таблеток Софосбувир и Велпатасвир 400 мг/100 мг.
Таблетки Софосбувир и Велпатасвир 400 мг/100 мг не должны влиять на Вашу способность управлять транспортными средствами либо использовать какие-либо инструменты или механизмы.
Данный лекарственный препарат содержит лактозу. В случае аллергии на некоторые виды сахаров проконсультируйтесь с лечащим врачом перед приемом данного препарата.
Всегда принимайте лекарственный препарат согласно назначению Вашего лечащего врача. В случае возникновения вопросов проконсультируйтесь с лечащим врачом.
Рекомендуемая доза
Рекомендуемая доза таблеток Софосбувир и Велпатасвир 400 мг/100 мг для взрослых и подростков с массой тела более 30 кг составляет одну таблетку один раз в сутки в течение 12 недель.
Таблетку необходимо проглатывать целиком вне зависимости от приема пищи. Не жуйте, не раскалывайте и не раздавливайте таблетку, так как она вызывает сильную горечь во рту.
Если Вы принимаете антацид, делайте это как минимум за 4 часа до или как минимум через 4 часа после приема таблеток Софосбувир и Велпатасвир 400 мг/100 мг.
Если Вы принимаете ингибитор протонного насоса, принимайте таблетки Софосбувир и Велпатасвир 400 мг/100 мг во время еды за 4 часа до приема ингибитора протонного насоса.
Тошнота (рвота) после приема таблеток Софосбувир и Велпатасвир 400 мг/100 мг может повлиять на количество таблеток Софосбувир и Велпатасвир 400 мг/100 мг в Вашей крови. Она может снизить эффективность таблеток Софосбувир и Велпатасвир 400 мг/100 мг.
• В случае появления тошноты (рвоты) в течение менее 3 часов после приема таблеток Софосбувир и Велпатасвир 400 мг/100 мг примите еще одну таблетку.
• В случае появления тошноты (рвоты) спустя 3 часа после приема таблеток Софосбувир и Велпатасвир 400 мг/100 мг Вам не нужно принимать еще одну дозу до приема следующей запланированной дозы.
Если Вы случайно приняли дозу, превышающую рекомендуемую, обратитесь к Вашему лечащему врачу или незамедлительно обратитесь в ближайшее медицинское учреждение. Возьмите с собой упаковку для таблеток, чтобы Вы могли легко описать принятый Вами препарат.
Если Вы забыли принять таблетки Софосбувир и Велпатасвир 400 мг/100 мг
Важно не пропускать прием дозы данного лекарственного препарата.
Если Вы пропустили дозу, определите, сколько времени прошло с тех пор, как Вы в последний раз принимали таблетки Софосбувир и Велпатасвир 400 мг/100 мг:
• Если Вы заметили, что пропустили дозу в течение 18 часов после того, как Вы обычно принимаете таблетки Софосбувир и Велпатасвир 400 мг/100 мг, примите таблетку как можно скорее. Затем примите следующую дозу в обычное время.
• Если Вы заметили, что пропустили дозу через 18 часов после того, как Вы обычно принимаете таблетки Софосбувир и Велпатасвир 400 мг/100 мг, подождите и примите следующую дозу в обычное время. Не принимайте двойную дозу (две дозы с небольшим интервалом).
Прекращение приема таблеток Софосбувир и Велпатасвир 400 мг/100 мг
Не прекращайте принимать данный лекарственный препарат без указаний Вашего лечащего врача. Очень важно, чтобы Вы прошли полный курс лечения, чтобы дать лекарственному препарату возможность вылечить вирусный гепатит С.
В случае возникновения вопросов о применении данного препарата проконсультируйтесь с Вашим лечащим врачом.
Как и все лекарственные препараты, данный лекарственный препарат может вызывать побочные эффекты, хотя они возникают не у всех.
Частые побочные эффекты
(могут возникать не более чем у 1 пациента из 10)
• Сыпь
• Головная боль
• Усталость
Нечастые побочные эффекты
(могут возникать не более чем у 1 пациента из 100)
• Отек лица, губ, языка или гортани (ангионевротический отек)
Другие эффекты, которые могут наблюдаться во время лечения софосбувиром
Частота возникновения следующих побочных эффектов неизвестна (не может быть установлена на основании доступных данных):
• широко распространенная сильная сыпь с шелушением кожи, которая может сопровождаться лихорадкой, гриппоподобными симптомами, волдырями во рту, на глазах и/или гениталиях (синдром Стивенса-Джонсона).
При применении софосбувира (один из компонентов таблеток Софосбувир и Велпатасвир 400 мг/100 мг) с другими лекарственными препаратами от гепатита С (например, даклатасвир, симепревир или ледипасвир) и амиодароном (кардиологический препарат) Вы можете испытывать замедленное сердцебиение, что может привести к необходимости установки кардиостимулятора или смерти.
Немедленно обратитесь к своему лечащему врачу, если у Вас наблюдаются следующие симптомы замедленного сердцебиения:
• обморок или предобморочное состояние.
• головокружение или резкая слабость.
• плохое самочувствие.
• ощущение слабости или усталости.
• одышка.
• боль в груди.
• спутанность сознания или нарушения памяти.
Сообщение о побочных эффектах
При возникновении любых побочных эффектов обратитесь к своему лечащему врачу. Это также относится к любым возможным побочным эффектам, не указанным в данной инструкции. Вы также можете сообщать о побочных эффектах напрямую через национальную систему отчетности.
Сообщение о побочных эффектах
При возникновении любых побочных эффектов обратитесь к своему лечащему врачу. Это также относится к любым побочным эффектам, не указанным в данной инструкции. По возможности Вы также можете сообщать о побочных эффектах напрямую через национальную систему отчетности. Сообщая о побочных эффектах, Вы можете помочь в получении дополнительных сведений о безопасности данного лекарственного препарата.
Храните данный лекарственный препарат в недоступном для детей месте.
Не применяйте данный лекарственный препарат после истечения срока годности, указанного на упаковке после надписи «ГОДЕН ДО». Датой истечения срока годности является последний день указанного месяца.
Храните при температуре не выше 30°С. Лекарственный препарат следует хранить в оригинальной упаковке.
Не выбрасывайте лекарственные препараты в канализацию или вместе с бытовыми отходами. Спросите у своего лечащего врача, как утилизировать лекарственные препараты, которые Вы больше не используете. Эти меры помогут защитить окружающую среду.
Действующие вещества: софосбувир 400 мг и велпатасвир 100 мг,
Другие компоненты таблеток Софосбувир и Велпатасвир 400 мг/100 мг:
— Ядро таблетки: Коповидон; лактозы моногидрат; целлюлоза микрокристаллическая; кроскармеллоза натрия; кремния диоксид коллоидный; магния стеарат
— Пленочное покрытие: Поливиниловый спирт, частично гидролизованный; титана диоксид; макрогол/полиэтиленгликоль; тальк; индигокармин алюминиевый лак; железа оксид желтый
Таблетки Софосбувир и Велпатасвир 400 мг/100 мг представляет собой двояковыпуклые таблетки, покрытые пленочной оболочкой, светло-зеленого или зеленого цвета в форме модифицированных капсул со скощенными краями и гравировкой «М» на одной стороне и «SFV»
на другой стороне.
Таблетки Софосбувир и Велпатасвир 400 мг/100 мг выпускаются в круглом непрозрачном флаконе из ПЭВП голубого цвета с непрозрачной полипропиленовой завинчивающейся крышкой или с крышкой с защитой от вскрытия детьми голубого цвета, с алюминиевым вкладышем для индукционной запайки, с влагопоглотителем (кассетный фильтр 1 г или саше 1 г) или без него.
Размер упаковки: 28 таблеток
Поставщик и производитель
Поставщик
Mylan Laboratories Limited («Майлан
Лабораториз Лимитед»)
Участок № 564/А/22, дорога № 92, Джубили
Хиле
Хайдарабад — 500096
Телингана
Индия
Эл. почта: Imtiyaz.basade@viatris.com
Производитель
Mylan Laboratories Limited («Майлан Лабораториз Лимитед»)
Ф-4 и Ф-12, Корпорация промышленного развития штата Махараштра (MIDC), Малегаон, Синнар, Нашик — 422 113, Махараштра, Индия
Для получения подробной информации местному представителю поставщика.
Подробная информация о данном лекарственном средстве доступна на официальном сайте Всемирной организации здравоохранения (ВОЗ): https://extranet.who.int/pqweb/medicines
Эпклюза — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-005703
Торговое наименование:
Эпклюза®
Международное непатентованное или группировочное наименование:
велпатасвир + софосбувир
Лекарственная форма:
таблетки, покрытые пленочной оболочкой
Состав
1 таблетка содержит:
действующие вещества: велпатасвир 100,0 мг и софосбувир 400,0 мг;
вспомогательные вещества:
Ядро таблетки:
коповидон, целлюлоза микрокристаллическая, кроскармеллоза натрия, магния стеарат;
Оболочка таблетки:
Опадрай II розовый 85F94644: поливиниловый спирт, титана диоксид, макрогол 3350, тальк, краситель железа оксид красный.
Описание
Ромбовидные таблетки, покрытые пленочной оболочкой розового цвета, с гравировкой «GSI» на одной стороне и «7916» на другой.
Фармакотерапевтическая группа:
противовирусное средство
Код ATX:
J05AP55.
Фармакологические свойства
Фармакодинамика
Механизм действия
Софосбувир является пангенотипным ингибитором РНК-зависимой РНК полимеразы вируса гепатита С (ВГС) NS5B, необходимой для репликации вируса. Софосбувир – это нуклеотидное пролекарство, которое в результате внутриклеточного метаболизма преобразуется в фармакологически активный трифосфат (GS-461203), аналог уридина, который встраивается в РНК вируса гепатита С с помощью полимеразы NS5B и действует как терминатор цепи. GS-461203 (активный метаболит софосбувира) не является ингибитором человеческой ДНК и РНК полимераз, а также не является ингибитором митохондриальной РНК-полимеразы.
Велпатасвир является ингибитором ВГС, который воздействует на неструктурный NS5A протеин ВГС, необходимый и для репликации РНК, и формирования вирионов ВГС. Выборочные исследования резистентности и перекрестной резистентности in vitro показывают, что механизм действия велпатасвира – это воздействие на NS5A.
Противовирусная активность
В исследованиях с использованием репликонов ВГС значения эффективной концентрации (ЕС50) софосбувира против полноразмерных репликонов генотипов 1a, 1b, 2а, 3а и 4а составили 0,04, 0,11, 0,05, 0,05 и 0,04 мкмоль, соответственно, а значения ЕС50 софосбувира против химерных репликонов генотипа 1b, несущих последовательности NS5B из генотипов 2b, 5а или 6а, составили 0,014-0,015 мкмоль. Медиана ЕС50 софосбувира в отношении химерных репликонов, несущих последовательности NS5B из клинических изолятов, составило: 0,062 мкмоль для генотипа 1а; 0,102 мкмоль для генотипа 1b; 0,029 мкмоль для генотипа 2а и 0,081 мкмоль для генотипа 3а. Противовирусная активность софосбувира in vitro в отношении менее часто встречаемых генотипов 4, 5 и 6 была аналогичной активности в отношении генотипов 1, 2 и 3.
Значения ЕС50 велпатасвира против полноразмерных репликонов NS5A генотипов 1a, lb, 2а, 2b, 3а, 4а, 4d, 5а и 6а составили от 0,002 до 0,021 мкмоль. Медиана ЕС50 велпатасвира против химерных репликонов, кодирующих последовательности NS5A клинических изолятов с генотипами 1a, 1b, 2а, 2b, 3а, 4а, 4d, 4r, 5а и 6а составили от 0,002 до 0,019 мкмоль.
Присутствие 40% сыворотки крови человека не оказывало влияния на активность софосбувира против ВГС, но снизило в 13 раз активность велпатасвира против репликонов генотипа 1а ВГС.
Софосбувир в комбинации с велпатасвиром не проявили антагонистического действия в снижении уровня ВГС РНК в клетках репликонов.
Резистентность
В культуре клеток
Репликоны ВГС с пониженной чувствительностью к софосбувиру были выделены в клеточной культуре для многих генотипов, включая 1b, 2а, 2b, 3а, 4а, 5а и 6а. Пониженная чувствительность к софосбувиру была связана с первичным замещением S282T в NS5B у репликонов всех исследуемых генотипов. Направленный мутагенез замены S282T в репликонах генотипов 1-6 приводил к 2-18-кратному снижению чувствительности к софосбувиру и снижению репликативной активности вируса на 89-99% по сравнению с соответствующим вирусом дикого типа. В биохимических тестах способность активного трифосфата софосбувира (GS-461203) к ингибированию рекомбинантной полимеразы NS5B генотипов 1b, 2а, 3а и 4а, с экспрессированием замены S282T, снизилась по сравнению с возможностью ингибирования рекомбинантной полимеразы NS5B дикого типа, в соответствии с 8,5-24-кратным повышением 50% ингибирующей концентрации (IC50).
Репликоны ВГС с пониженной чувствительностью к велпатасвиру были выделены в клеточной культуре in vitro для многих генотипов, включая 1a, 1b, 2а, 3а, 4а, 5а и 6а. Замены в позициях 24, 28, 30, 31, 32, 58, 92 и 93 были связаны с резистентностью NS5A. Варианты, связанными с резистентностью, отобранные в 2 или более генотипах, имели замены F28S, L31I/V и Y93H. Сайт-направленный мутагенез известных вариантов, связанных с резистентностью NS5A, показал, что заменами, указывающими на более, чем стократное сокращение чувствительности к велпатасвиру, являются 28G, А92К и Y93H/N/R/W в генотипе 1а, А92К в генотипе 1b, С92Т и Y93H/N в генотипе 2b, Y93H в генотипе 3, а также, L31V и P32A/L/Q/R в генотипе 6. Отдельные замены, исследованные в генотипах 2а, 4а или 5а, не указывали на >100-кратное сокращение чувствительности к велпатасвиру. Комбинации этих вариантов часто указывали на более выраженное снижение чувствительности к велпатасвиру, чем отдельные варианты, связанные с резистентностью.
В клинических исследованиях
Пациенты без цирроза и пациенты с компенсированным циррозом
В объединенном анализе пациентов без цирроза и с компенсированным циррозом, получавшими препарат Эпклюза® в течение 12 недель в ходе трех исследований Фазы 3, 12 пациентов (2 с генотипом 1 и 10 с генотипом 3) были квалифицированы как подходящие для анализа резистентности ввиду вирусологической неудачи. Ни один пациент с генотипом 2, 4, 5 или 6 ВГС не имел вирусологическую неудачу.
В обоих случаях вирусологической неудачи при 1 генотипе ВГС выявлены варианты NS5A (штаммы с вариантом, ассоциирующимся с лекарственной резистентностью) при вирусологической неудаче, одна с Y93N, а другая с L31I/V и Y93H. У обоих пациентов исходно варианты, связанные с резистентностью NS5A, были скрыты. Варианты, связанные с резистентностью к нуклеозидному ингибитору NS5B, у этих 2 пациентов на момент вирусологической неудачи не были выявлены.
Из 10 пациентов с генотипом 3 и вирусологической неудачей, Y93H выявили у всех 10 пациентов на момент неудачи, у 4 пациентов Y93H также обнаруживался исходно. Варианты, связанные с резистентностью к нуклеозидному ингибитору NS5B, на момент неудачи не были выявлены ни у одного из 10 пациентов.
Пациенты с декомпенсированным циррозом
В ходе одного из исследований Фазы 3, у пациентов с декомпенсированным циррозом, получавшим препарат Эпклюза® + рибавирин (РБВ) в течение 12 недель, 3 пациента (1 с генотипом 1 и 2 с генотипом 3), были квалифицированы как подходящие для анализа резистентности ввиду вирусологической неудачи. Ни один пациент с генотипом 2 или 4 ВГС при лечении с применением препарата Эпклюза® + РБВ в течение 12 недель не имел вирусологическую неудачу. Из трех пациентов два пациента с генотипом 3 имели вариант Y93H, связанный с резистентностью NS5A, возникший на момент неудачи, и у другого пациента был Y93H исходно и на момент вирусологической неудачи, а также на момент неудачи были выявлены на низком уровне (<5%) варианты N142T и E237G, связанные с резистентностью к нуклеозидному ингибитору NS5B. Анализ фармакокинетики у этого пациента указывал на отсутствие приверженности к лечению.
В данном исследовании у 2 пациентов, получавших лечение препаратом Эпклюза® в течение 12 или 24 недель без РБВ, развился вариант NS5B S282T при низких уровнях (<5%), наряду с L159F.
Влияние исходных уровней резистентных вариантов вируса гепатита С на лечение
Пациенты без цирроза и пациенты с компенсированным циррозом
Из 1035 пациентов, получавших лечение софосбувиром/велпатасвиром в трех клинических исследованиях Фазы 3, 1023 пациента были включены в анализ вариантов, связанных с резистентностью NS5A у 380/1023 (37%) пациентов имелись варианты, связанные с резистентностью NS5A, исходно. У пациентов, инфицированных генотипом 2, 4 и 6 ВГС, варианты, связанные с резистентностью NS5A, встречались чаще (70%, 63% и 52%, соответственно), чем у пациентов с генотипом 1 (23%), генотипом 3 (16%) и генотипом 5 (18%) ВГС.
Присутствующие исходно варианты, связанные с резистентностью, не оказывали существенного воздействия на частоту достижения УВ012 у пациентов с генотипом 1, 2, 4, 5 и 6 ВГС. Пациенты, инфицированные генотипом 3 ВГС с вариантом Y93H, связанным с резистентностью NS5A, исходно, реже достигали УВ012 в сравнении с пациентами без Y93H после лечения препаратом Эпклюза® в течение 12 недель (84 ,0% в сравнении с 96,4%).
Перекрестная резистентность
Данные in vitro предполагают, что большинство вариантов, связанных с резистентностью NS5A, которая указывает на резистентность к ледипасвиру и даклатасвиру, оставались чувствительными к велпатасвиру. Велпатасвир был полностью активен против замены S282T в NS5B, связанной с резистентностью к софосбувиру, в то время как все велпатасвир-резистентные замены в NS5A были полностью чувствительны к софосбувиру. Софосбувир и велпатасвир были в полной степени активны против замен, связанных с резистентностью к другим классам противовирусных препаратов прямого действия с разными механизмами действия, например, ненуклеозидным ингибиторам NS5B и ингибиторам протеазы NS3. Эффективность препарата Эпклюза® не оценивалась для пациентов, которые ранее показали неудовлетворительные результаты лечения по другим схемам, включающим ингибитор NS5A.
Дети
Не установлена эффективность и безопасность применения препарата Эпклюза® у детей и подростков в возрасте до 18 лет. Данные отсутствуют.
Фармакокинетика
Всасывание
Фармакокинетические свойства софосбувира, основного циркулирующего неактивного метаболита софосбувира (GS-331007) и велпатасвира оценивались у здоровых добровольцев, а также, у пациентов с хроническим гепатитом С. После приема препарата Эпклюза® внутрь софосбувир быстро всасывается и пиковая медианная концентрация в плазме крови наблюдалась через час после приема дозы. Медианный пик концентрации неактивного метаболита (GS-331007) в плазме крови наблюдался через 3 часа после приема дозы. Медианные пиковые концентрации велпатасвира наблюдали через 3 часа после приема дозы.
По результатам популяционных фармакокинетических исследований у пациентов, инфицированных ВГС, в равновесном состоянии значения AUC0-24 софосбувира (n = 982), неактивного метаболита (GS331007) (n = 1,428) и велпатасвира (n = 1,425) составили 1,260, 13,970 и 2,970 нг•ч/мл, соответственно. Значения Сmax софосбувира, неактивного метаболита (GS-331007) и велпатасвира в равновесном состоянии составили 566, 868 и 259 нг/мл, соответственно. AUC0-24 и Сmax софосбувира и неактивного метаболита (GS-331007) совпадали у здоровых взрослых и у пациентов с инфекцией ВГС. Относительно здоровых субъектов (n = 331) показатели AUC0-24 и Сmax велпатасвира были, соответственно, на 37% и 41% ниже у пациентов, инфицированных ВГС.
Влияние приема пищи
В зависимости от приема пищи прием однократной дозы препарата Эпклюза® с умеренно жирной пищей (~600 ккал, 30% жира) или с пищей повышенной жирности (~800 ккал, 50% жира) приводил к 34% и 21% повышению AUC0-inf велпатасвира, соответственно, а также к 31% и 5% повышению Сmax, соответственно. Пища с умеренным или высоким содержанием жира повышала значение AUC0-inf софосбувира на 60% и 78%, соответственно, однако, не оказала существенного эффекта на значение Сmax софосбувира. Пища с умеренным или высоким содержанием жира не изменяла значение AUC0-inf неактивного метаболита (GS-331007), но привела к 25% и 37% снижению значения Сmax, соответственно. Процент отклика в исследовании Фазы 3 был одинаковым для пациентов, инфицированных ВГС, получавших препарат Эпклюза® независимо от приема пищи. Препарат Эпклюза® может приниматься независимо от приема пищи.
Распределение
Степень связывания софосбувира с белками плазмы крови человека составляет 61-65%. Связывание происходит независимо от концентрации лекарственного препарата в диапазоне от 1 мкг/мл до 20 мкг/мл. Связывание неактивного метаболита (GS-331007) с белками плазмы крови человека было минимальным. После однократного приема дозы 400 мг [14С]-софосбувира у здоровых добровольцев, коэффициент соотношения [14С]-радиоактивности крови и плазмы составил приблизительно 0,7.
Степень связывания софосбувира с белками плазмы крови человека составляет >99,5%. Связывание происходит независимо от концентрации лекарственного препарата в диапазоне от 0,09 мкг/мл до 1,8 мкг/мл. После однократного приема дозы 100 мг [14С]-велпатасвира у здоровых добровольцев коэффициент соотношения [14С]-радиоактивности крови и плазмы был в диапазоне от 0,52 до 0,67.
Биотрансформация
Софосбувир метаболизируется преимущественно в печени с образованием фармакологически активного нуклеозидного аналога трифосфата GS-461203. Метаболический путь активации включает последовательный гидролиз эфира карбоновой кислоты, который катализируется катепсином А человека или карбоксилэстеразой 1, и расщепление фосфорамидата нуклеотид-связывающим белком 1 с гистидиновыми триадами с последующим фосфорилированием в процессе биосинтеза пиримидинового нуклеотида. Дефосфорилирование приводит к образованию нуклеозидного неактивного метаболита (GS-331007), который не поддается эффективному рефосфорилированию, не обладает действием против ВГС in vitro. Софосбувир и неактивный метаболит (GS-331007) не являются субстратами или ингибиторами UGT1A1 или энзимов CYP3A4, CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19 и CYP2D6. После однократной дозы 400 мг [14С]-софосбувира внутрь, доля неактивного метаболита (GS331007) составляет приблизительно >90% от общей системной экспозиции.
Велпатасвир является субстратом энзимов CYP2B6, CYP2C8 и CYP3A4 с медленным оборотом. При однократной дозе в 100 мг [14С]-велпатасвира, большая часть (>98%) радиоактивности в плазме крови приходилось на исходную субстанцию препарата. Моногидроксилированный и дезметилированный велпатасвир – метаболиты, идентифицированные в плазме крови человека. Неизменный велпатасвир является основной субстанцией, присутствующей в кале.
Выведение
После однократного приема внутрь [14С]-софосбувира в дозе 400 мг, средняя величина общего выведения радиоактивности [14С] составила более 92%, из которой приблизительно 80%, 14% и 2,5% выводилось с мочой, калом и выдыхаемым воздухом, соответственно. Большую часть дозы софосбувира, выводимой с мочой, составлял неактивный метаболит (GS-331007) (78%) и лишь 3,5% выводилось в неизменном виде. Эти данные показывают, что почечный клиренс является основным путем выведения неактивного метаболита (GS-331007). Средний терминальный период полувыведения софосбувира и неактивного метаболита (GS-331007) после приема препарата Эпклюза® составил 0,5 и 25 часов, соответственно.
После однократного приема внутрь [14С]-велпатасвира в дозе 100 мг, средняя величина общего выведения радиоактивности [14С] составила 95%, из которой приблизительно 94 и 0,4% выводилось с калом и мочой, соответственно. Неизменный велпатасвир являлся основной субстанцией, присутствовавшей в кале, из расчета по среднему значению 77% от принятой дозы, с дальнейшим образованием моногидроксилированного велпатасвира (5,9%) и дезметилированного велпатасвира (3,0%). Эти данные указывают на то, что экскреция исходной субстанции препарата с жёлчью являлась основным путем выведения велпатасвира. Медианный терминальный период полувыведения велпатасвира после приема препарата Эпклюза® приблизительно составил 15 часов.
Линейность/нелинейность
Значение AUC велпатасвира повышается приблизительно пропорционально принятой дозе в диапазоне доз от 25 мг до 150 мг. Значение AUC софосбувира и неактивного метаболита (GS-331007) приблизительно пропорциональны принятой дозе в диапазоне доз от 200 мг до 1200 мг.
Вероятность лекарственного взаимодействия софосбувира/велпатасвира in vitro
Софосбувир и велпатасвир являются субстратами транспортеров препаратов Р-гликопротеина и белка резистентности рака молочной железы (BCRP), а неактивный метаболит (GS-331007) – нет. Велпатасвир, также, является субстратом ОАТР1В. В исследовании in vitro наблюдали медленный метаболический оборот велпатасвира посредством энзимов CYP2B6, CYP2C8 и CYP3A4.
Велпатасвир является ингибитором транспортера препарата Р-гликопротеина, BCRP, ОАТР1В1 и ОАТР1В3 и его участие во взаимодействии препаратов с этими транспортерами, прежде всего, ограничивается процессом абсорбции. При клинически важной концентрации в плазме велпатасвир не является ингибитором печеночных транспортеров помпы, выводящая соли желчных кислот (BSEP), ко-транспортерного белка натрия таурохолата (NTCP), ОАТР2В1, ОАТР1А2 или переносчика органических катионов (ОСТ) 1, почечных транспортеров ОСТ2, ОАТ1, ОАТЗ, белка 2 множественной лекарственной резистентности (MRP2) или белка экструзии лекарственных препаратов и токсинов (МАТЕ) 1 или цитохрома Р450, или энзимов уридинглюкуронозилтрансферазы (UGT) 1А1.
Софосбувир и неактивный метаболит (GS-331007) не являются ингибиторами транспортеров препаратов Р-гликопротеина, BCRP, MRP2, BSEP, ОАТР1В1, ОАТР1В3 и ОСТ1. Неактивный метаболит (GS-331007) не является ингибитором ОАТ1, ОСТ2 и МАТЕ1.
Фармакокинетика у особых групп пациентов
Пол и раса
Расовая принадлежность или пол не оказывают клинически значимого эффекта на фармакокинетику софосбувира, неактивного метаболита (GS-331007) или велпатасвира.
Пожилые пациенты
На основании популяционного анализа фармакокинетики у пациентов, инфицированных ВГС в диапазоне от 18 до 82 лет, возраст не оказывает клинически значимого эффекта на экспозицию софосбувира, неактивного метаболита (GS-331007) или велпатасвира.
Пациенты с почечной недостаточностью
Фармакокинетику софосбувира изучали после применения разовой дозы софосбувира 400 мг у пациентов, не инфицированных ВГС, при почечной недостаточности легкой степени (расчетная скорость клубочковой фильтрации [рСКФ] ≥50 и <80 мл/мин/1,73 м²), средней (рСКФ ≥30 и <50 мл/мин/1,73 м²) и тяжелой степени (рСКФ <30 мл/мин/1,73 м²), а также у пациентов с терминальной стадией почечной недостаточности, которым необходим гемодиализ. По сравнению с пациентами с нормальной функцией почек (рСКФ >80 мл/мин/1,73 м²), при почечной недостаточности легкой, средней и тяжелой степени тяжести, AUC0-inf софосбувира был выше, соответственно, на 61%, 107% и 171%, в то время как повышение AUC0-inf неактивного метаболита (GS-331007) составило 55%, 88% и 451%, соответственно. У пациентов с терминальной стадией почечной недостаточности наблюдалось повышение AUC0-inf софосбувира на 28% при приеме софосбувира за 1 час до сеанса гемодиализа в сравнении с повышением на 60% при приеме софосбувира через 1 час после сеанса гемодиализа, соответственно. У пациентов с терминальной стадией почечной недостаточности, которые принимали софосбувир за 1 час до или 1 час после сеанса гемодиализа, показатель AUC0-inf неактивного метаболита (GS-331007) увеличивался не менее, чем в 10 и 20 раз, соответственно. Неактивный метаболит (GS-331007) эффективно выводится гемодиализом с коэффициентом экстракции примерно 53%. После однократного приема дозы 400 мг софосбувира при 4-часовом сеансе гемодиализа выводится 18% введенной дозы (см. раздел «Способ применения и дозы»).
Фармакокинетику велпатасвира определяли, вводя однократную дозу велпатасвира 100 мг пациентам, не инфицированным ВГС, с тяжелым нарушением функции почек (рСКФ <30 мл/мин по формуле Кокрофт-Голта). Относительно лиц с нормальной функцией почек, значение AUCinf велпатасвира было на 50% выше у лиц с серьезным нарушением функции почек (см. раздел «Способ применения и дозы»).
Пациенты с печеночной недостаточностью
Популяционные анализы фармакокинетики у пациентов, инфицированных ВГС, показали, что цирроз (включая декомпенсированный цирроз) не оказывает клинически значимого влияния на экспозицию софосбувира и неактивного метаболита (GS-331007).
Популяционные анализы фармакокинетики у пациентов, инфицированных ВГС, показали, что цирроз (включая декомпенсированный цирроз) не оказывает клинически значимого влияния на экспозицию велпатасвира (см. раздел «Способ применения и дозы»).
Масса тела
На основании популяционных анализов фармакокинетики установлено, что вес тела не оказывает клинически существенного влияния на экспозицию софосбувира или велпатасвира.
Дети
Фармакокинетика софосбувира, неактивного метаболита (GS-331007) и велпатасвира у детей и подростков не установлена (см. раздел «Способ применения и дозы»).
Показания к применению
Лечение хронического гепатита С (ХГС) у взрослых пациентов.
Противопоказания
- Повышенная чувствительность к действующим веществам или любому другому компоненту препарата;
- Беременность;
- Детский возраст до 18 лет (эффективность и безопасность не установлена у данной популяции);
- Почечная недостаточность тяжелой степени тяжести (рСКФ <30 мл/мин/1,73 м²) или терминальная стадия почечной недостаточности, когда необходимо проведение гемодиализа (безопасность не установлена у данной популяции пациентов);
- У пациентов, получающих мощные индукторы Р-гликопротеина или цитохрома Р450 (CYP) (рифампицин, рифабутин, зверобой продырявленный [Hypericum perforatum], карбамазепин, фенобарбитал и фенитоин).
С осторожностью
Следует применять с осторожностью со следующими препаратами (см. разделы «Особые указания» и «Взаимодействие с другими лекарственными средствами»):
- Совместное применение с дигоксином;
- Совместное применение с дабигатрана этексилатом;
- Совместное применение с препаратом элвитегравир/кобицистат/эмгрицитабин/тенофовира дизопроксил фумарат или тенофовира дизопроксил фумарат, усиленный ингибитором протеазы ВИЧ.
Совместное применение не рекомендуется со следующими препаратами (см. разделы «Особые указания» и «Взаимодействие с другими лекарственными средствами»):
- Лекарственные препараты, которые являются умеренными индукторами Р-гликопротеина или CYP (например, окскарбазепин, модафинил или эфавиренз);
- Ингибиторы протонной помпы (например, омепразол, лансопразол, рабепразол, пантопразол, эзомепразол);
- Противосудорожные препараты (например, окскарбазепин);
- Антимикобактериальные препараты (например, рифапентин).
Следует избегать совместного применения со следующими препаратами (см. разделы «Особые указания» и «Взаимодействие с другими лекарственными средствами»):
- Совместное применение с другими лекарственными препаратами, содержащими софосбувир;
- Совместное применение с амиодароном.
Применение при беременности и в период грудного вскармливания
Беременность
Нет достаточных данных (менее 300 исходов беременностей) о применении софосбувира, велпатасвира или препарата Эпклюза® во время беременности.
Софосбувир
Результаты доклинических исследований не обнаружили прямую или опосредованную репродуктивную токсичность.
Тем не менее, нельзя полностью оценить действие предельных концентраций софосбувира у крыс и соотнести его с действием рекомендуемых клинических доз у человека.
Велпатасвир
Исследования на животных показали возможную связь с репродуктивной токсичностью.
В качестве меры предосторожности применение препарата Эпклюза® в период беременности противопоказано.
Грудное вскармливание
Неизвестно, проникают ли софосбувир, метаболиты софосбувира или велпатасвир в грудное молоко человека.
Имеющиеся данные по фармакокинетике у животных свидетельствуют о выделении велпатасвира и метаболитов софосбувира в грудное молоко.
Нельзя исключить риск для новорожденного/младенца. Таким образом, препарат Эпклюза® не следует применять в период грудного вскармливания.
Влияние на репродуктивную функцию
Данные о влиянии препарата Эпклюза® на репродуктивную функцию у человека отсутствуют. Исследования применения софосбувира или велпатасвира на животных не выявили неблагоприятного влияния препарата на репродуктивную функцию.
Если рибавирин применяется совместно с препаратом Эпклюза®, следует обратить внимание на противопоказания, связанные с применением рибавирина во время беременности и кормления грудью (см. инструкцию по применению рибавирина для дополнительной информации).
Способ применения и дозы
Для приема внутрь.
Лечение препаратом Эпклюза® должно начинаться и контролироваться врачом, имеющим опыт лечения хронического гепатита С.
Одну таблетку препарата Эпклюза® рекомендуется принимать один раз в сутки независимо от приема пищи. Таблетку необходимо проглатывать целиком, запивая водой. Таблетки не рекомендуется разжевывать или разламывать из-за горького вкуса.
Таблица 6. Рекомендуемая продолжительность лечения при всех генотипах ВГС
| Популяция пациентова | Продолжительность лечения |
| Пациенты без цирроза и пациенты с компенсированным циррозом | Эпклюза® в течение 12 недель Добавление рибавирина можно рассмотреть для пациентов, инфицированных генотипом 3 с компенсированным циррозом. |
| Пациенты с декомпенсированным циррозом | Эпклюза® + рибавирин в течение 12 недель |
а. Включает пациентов, ко-инфицированных вирусом иммунодефицита человека (ВИЧ) и пациентов с рецидивом ВГС после пересадки печени (см. раздел «Особые указания»).
При использовании комбинации рибавирина с препаратом Эпклюза® (см, инструкцию по применению рибавирина для дополнительной информации).
Рекомендуется прием рибавирина с разделением на две суточные дозы, с едой:
Таблица 7. Руководство по приему рибавирина при назначении с препаратом Эпклюза® пациентам с некомпенсированным циррозом.
| Пациент | Прием рибавирина |
| Цирроз класса В по классификации Чайлд-Пью-Туркотт до трансплантации | 1000 мг в сутки пациентам <75 кг и 1200 мг для пациентов ≥75 кг |
| Цирроз класса С но классификации Чайлд-Пью-Туркотт до трансплантации Цирроз класса В по классификации Чайлд-Пью-Туркотт или класса С до трансплантации |
Начальную дозу 600 мг можно титровать до максимума в 1000/1200 мг (1000 мг для пациентов весом <75 кг и 1200 мг для пациентов весом ≥75 кг) при хорошей переносимости. Если начальная доза плохо переносится, дозу следует уменьшить, как это показано клинически, на основании уровней гемоглобина. |
В том случае, если рибавирин применяется для пациентов, инфицированных генотипом 3 с компенсированным циррозом (до или после трансплантации), рекомендуемая доза рибавирина составляет 1000/1200 мг (1000 мг для пациентов <75 кг и 1200 мг для пациентов ≥75 кг).
Для изменения дозы рибавирина необходимо ознакомиться с инструкцией по применению лекарственного препарата, содержащего рибавирин.
Пациентам следует знать о том, что в случае рвоты в течение 3 часов с момента приема следует принять дополнительную таблетку препарата Эпклюза®. Если рвота возникла более чем через 3 часа после приема препарата, дополнительную таблетку препарата Эпклюза® принимать не нужно (см. раздел «Фармакологические свойства»).
Если опоздание в приеме препарата Эпклюза® составило менее 18 часов, пациенту следует принять очередную дозу как можно скорее, а затем продолжить обычный прием препарата. Если опоздание в приеме препарата Эпклюза® составило более 18 часов, пациенту следует подождать и прием следующей таблетки осуществить в обычное время. Пациенту не следует принимать двойную дозу препарата Эпклюза®.
Пациенты, с предшествующей неудачей лечения режимом, включающим NS5A
Можно рассмотреть схему терапии Эпклюза® + рибавирин в течение 24 недель (см. раздел «Особые указания»).
Пациенты пожилого возраста
Корректировка дозы для пациентов пожилого возраста не требуется (см. раздел «Фармакологические свойства»).
Почечная недостаточность
Для пациентов с легким или умеренным нарушением функции почек, коррекция дозы препарата Эпклюза® не требуется. У пациентов с нарушением функции почек тяжелой степени (расчетная скорость клубочковой фильтрации [рСКФ] <30 мл/мин/1,73 м²) или терминальной стадией хронической почечной недостаточности (терминальная стадия ХПН), требующей гемодиализа, безопасность и эффективность препарата Эпклюза® не оценивалась (см. раздел «Фармакологические свойства»).
Нарушение функции печени
Коррекция дозы препарата Эпклюза® не требуется у пациентов с легкими, средними и тяжелыми нарушениями функции печени (класс А, В или С по классификации Чайлд-Пью-Туркотт) (см. раздел «Фармакологические свойства»). Безопасность и эффективность препарата Эпклюза® оценивалась у пациентов с циррозом класса В по классификации Чайлд-Пью-Туркотт, но не у пациентов с циррозом класса С по классификации Чайлд-Пью-Туркотт (см. разделы «Фармакологические свойства», «Побочное действие» и «Особые указания»).
Дети
Не установлена эффективность и безопасность применения препарата Эпклюза® у детей и подростков в возрасте до 18 лет. Данные отсутствуют.
Побочное действие
Обзор профиля безопасности
Оценка безопасности препарата Эпклюза® основывалась на объединенных данных клинического исследования Фазы 3, полученных с участием пациентов с генотипом 1, 2, 3, 4, 5 или 6 ВГС (с компенсированным циррозом или без него), включающего 1035 пациентов, которые получали препарат Эпклюза® в течение 12 недель.
Доля пациентов, которые окончательно прекратили лечение по причине нежелательных явлений, составила 0,2%, а доля пациентов, перенесших какие-либо тяжелые нежелательные явления, составила 3,2% для пациентов, получающих препарат Эпклюза® в течение 12 недель. В соответствии с данными клинического исследования, головная боль, утомляемость и тошнота являлись наиболее частыми (частота возникновения ≥10%) нежелательными явлениями, связанными с лечением и отмечались у пациентов, принимавших препарат Эпклюза® в течение 12 недель. Эти и другие нежелательные явления были отмечены с аналогичной частотой у пациентов, получавших плацебо, в сравнении с пациентами, принимавшими препарат Эпклюза®.
Пациенты с декомпенсированным циррозом
Профиль безопасности препарата Эпклюза® оценивали в ходе одного открытого исследования, в ходе которого пациенты с циррозом класса В по классификации Чайлд-Пью-Туркотт принимали препарат Эпклюза® в течение 12 недель (n = 90), Эпклюза® + РБВ в течение 12 недель (n = 87) или Эпклюза® в течение 24 недель (n = 90). Наблюдавшиеся нежелательные явления соответствовали ожидаемым клиническим последствиям декомпенсированного заболевания печени или известному профилю токсичности рибавирина для пациентов, принимающих препарат Эпклюза® в сочетании с рибавирином.
Среди 87 пациентов, получавших лечение с применением препарата Эпклюза® + РБВ в течение 12 недель, снижение гемоглобина до значения менее 10 г/дл и 8,5 г/дл во время лечения было отмечено у 23% и 7% пациентов, соответственно. Рибавирин отменили у 15% пациентов, принимавших препарат Эпклюза® + РБВ в течение 12 недель вследствие нежелательных явлений.
Описание отдельных нежелательных реакций
Нарушения сердечного ритма
Наблюдались случаи тяжелой брадикардии и блокады сердца (в частности, атриовентрикулярная (АВ) или синоатриальная блокада) при применении софосбувир-содержащих режимов в сочетании с амиодароном и/или другими препаратами, которые снижают частоту сердечных сокращений (см. разделы «Взаимодействие с другими лекарственными средствами» и «Особые указания»).
Нарушения со стороны кожи
Частота не известна: синдром Стивенса-Джонсона.
Передозировка
Наибольшей документально зафиксированной дозой софосбувира и велпатасвира являлась однократная доза 1200 мг и однократная доза 500 мг, соответственно. В исследованиях принимали участие здоровые добровольцы. При применении препарата в указанных дозах какого-либо неблагоприятного воздействия не отмечалось, а частота и тяжесть нежелательных реакций были аналогичны зарегистрированным в группах, получавших плацебо. Влияние более высоких доз неизвестно.
Специфический антидот на случай передозировки препаратом Эпклюза® отсутствует. В случае передозировки следует контролировать состояние пациента на предмет выявления признаков интоксикации. Лечение передозировки препарата Эпклюза® заключается в проведении общих поддерживающих мероприятий, включая регулярный контроль основных физиологических показателей и наблюдение за клиническим состоянием пациента. Гемодиализ может способствовать эффективному выведению доминирующего циркулирующего метаболита софосбувира, GS-331007 (коэффициент экстракции 53%). Учитывая то, что велпатасвир в значительной степени связывается с белками, гемодиализ вряд ли приведет к существенному выведению велпатасвира.
Взаимодействие с другими лекарственными средствами
Поскольку препарат Эпклюза® содержит софосбувир и велпатасвир, при его приеме возможны любые случаи взаимодействия, обусловленные указанными активными веществами по отдельности.
Возможное влияние препарата Эпклюза® на другие лекарственные средства
Велпатасвир является ингибитором переносчика Р-гликопротеина и BCRP, транспортного полипептида органических анионов (ОАТР) 1В1 и ОАТР1В3. Одновременное применение препарата Эпклюза® с лекарственными препаратами, представляющими собой субстраты указанных транспортеров, может повысить экспозицию таких лекарственных препаратов. См. Таблицу 8, в которой приведены примеры взаимодействий с чувствительными субстратами Р-гликопротеина (дигоксином), BCRP (розувастатином) и ОАТР (правастатином).
Возможное влияние других лекарственных средств на препарат Эпклюза®
Ледипасвир и софосбувир являются субстратами переносчика активных веществ Р-гликопротеина и BCRP. Велпатасвир, также, является субстратом транспортера препаратов ОАТР1В. В исследовании in vitro наблюдали медленный метаболический оборот велпатасвира посредством CYP2B6, CYP2C8 и CYP3A4. Лекарственные препараты, являющиеся сильными индукторами Р-гликопротеина или сильными индукторами CYP2B6, CYP2C8 или CYP3A4 (например, рифампицин, рифабутин, зверобой продырявленный, карбамазепин, фенобарбитал и фенитоин), способны снизить концентрацию софосбувира или велпатасвира в плазме крови, что приводит к снижению терапевтического эффекта софосбувира/велпатасвира. Применение таких лекарственных препаратов с препаратом Эпклюза® противопоказано (см. раздел «Противопоказания»).
Лекарственные препараты, которые являются умеренными индукторами Р-гликопротеина или умеренными индукторами цитохрома Р450 (например, окскарбазепин, модафинил или эфавиренз), могут вызывать снижение концентрации софосбувира или велпатасвира в плазме крови, что может привести к ослаблению терапевтического эффекта препарата Эпклюза®. Совместное применение препарата Эпклюза® с такими лекарственными препаратами не рекомендуется (см. «Особые указания»). Совместное применение с лекарственными препаратами, ингибирующими Р-гликопротеин или BCRP может повысить концентрации софосбувира или велпатасвира в плазме крови. Лекарственные препараты, ингибирующие ОАТР, CYP2B6, CYP2C8 или CYP3A4, могут повысить концентрацию велпатасвира в плазме крови. Клинически значимые взаимодействия лекарственных препаратов с препаратом Эпклюза®, опосредованные ингибиторами Р-гликопротеина, BCRP, ОАТР или CYP450, не ожидаются. Препарат Эпклюза® может применяться совместно с ингибиторами Р-гликопротеина, BCRP, ОАТР и CYP.
Пациенты, получающие антагонисты витамина К
Поскольку при совместном применении с препаратом Эпклюза® может изменяться функция печени, рекомендуется тщательный мониторинг значений международного нормализованного отношения (МНО).
Взаимодействие препарата Эпклюза® и других лекарственных средств
В Таблице 8 представлен список установленных или потенциально клинически значимых случаев взаимодействия лекарственных средств (коэффициент 90% доверительного интервала (ДИ) геометрического среднего, рассчитанного методом наименьших квадратов был без изменений – повысился – понизился – в сравнении с установленными граничными значениями). Описанные случаи взаимодействия лекарственных средств основаны на исследованиях, проведенных с применением комбинации софосбувир/велпатасвир или велпатасвира и софосбувира, как отдельных действующих веществ, или же существуют предпосылки для случаев взаимодействия лекарственных средств, обусловленных применением комбинации софосбувир/велпатасвир. В таблицу включены не все препараты.
Таблица 8. Взаимодействия между препаратом Эпклюза® и другими лекарственными препаратами
| Лекарственный препарат (терапевтическая группа)/ Возможный механизм взаимодействия | Влияние на уровни лекарственного средства. Среднее отношение (90% доверительный интервал)a,b |
Рекомендации по совместному применению с препаратом Эпклюза® | |||
| Активный компонент |
Cmax | AUC | Cmin | ||
| СРЕДСТВА, СНИЖАЮЩИЕ КИСЛОТНОСТЬ | |||||
| Растворимость велпатасвира уменьшается с увеличением pH. Лекарственные средства, способные увеличивать pH желудка, могут снизить концентрацию велпатасвира. | |||||
| Антациды | |||||
| Например, гидроксид алюминия или магния; карбонат кальция (Повышение pH желудка) |
Взаимодействие не исследовалось. Ожидается. ↔ Софосбувир ↓ Велпатасвир |
Рекомендуется сделать перерыв в 4 часа между приемом антацида и препарата Эпклюза®. | |||
| Антагонисты Н2-гистаминовых рецепторов | |||||
| Фамотидин (40 мг раз в сутки)/ софосбувир/велпатасвир (400/ 100 мг однократная доза)c Фамотидин одновременно с препаратом Эпклюза® d Циметидинe Низатидинe Ранитидинe (Повышение pH желудка) |
Софосбувир | ↔ | ↔ | Антагонисты Н2-рецепторов могут применяться одновременно или с временными интервалами с препаратом Эпклюза® в дозе, которая не превышает дозы, сопоставимые с фамотидином 40 мг. дважды в сутки. | |
| Велпатасвир | ↓ 0,80 (0,70, 0,91) |
↓ 0,81 (0,71, 0,91) |
|||
| Фамотидин (40 мг раз в сутки)/ софосбувиp/велпатасвир (400/ 100 мг однократная доза)c Фамотидин за 12 часов до препарата Эпклюза® d (Повышение pH желудка) |
Софосбувир | ↓ 0,77 (0,68, 0,87) |
↓ 0,80 (0,73, 0,88) |
||
| Велпатасвир | ↔ | ↔ | |||
| Ингибиторы протонной помпы | |||||
| Омепразол (20 мг один раз в сутки)/ софосбувиp/ велпатасвир (400/ 100 мг однократная доза, на голодный желудок)c Омепразол одновременно с препаратом Эпклюза® d Лансопразолe (Повышение pН желудка) |
Софосбувир | ↓ 0,66 (0,55, 0,78) |
↓ 0,71 (0,60, 0,83) |
Не рекомендуется принимать совместно с ингибиторами протонной помпы. В том случае, когда рассматривается совместный прием, препарат Эпклюза® необходимо принимать с едой, за 4 часа до ингибитора протонной помпы в максимальных дозах, сопоставимых с 20 мг омепразола. | |
| Велпатасвир | ↓ 0,63 (0,50, 0,78) |
↓ 0,64 (0,52, 0,79) |
|||
| Омепразол (20 мг один раз в стуки) софосбувир/ велпатасвир (однократная доза 400/ 100 мг после еды)c Омепразол через 4 часа после приема препарата Эпклюза® d (Повышение pH желудка) |
Софосбувир | ↓ 0,79 (0,68, 0,92) |
↔ | ||
| Велпатасвир | ↓ 0,67 (0,58, 0,78) |
↓ 0,74 (0,63, 0,86) |
|||
| ПРОТИВОАРИТМИЧЕСКИЕ СРЕДСТВА | |||||
| Амиодарон | Взаимодействие нс исследовалось. Неизвестен эффект па концентрации амиодарона, велпатасвира и софосбувира. | Использовать только в случае отсутствия альтернативы. Рекомендуется тщательный мониторинг, если данный лекарственный препарат применяется одновременно с препаратом Эпклюза® (см. раздел «Побочное действие»). | |||
| Дигоксин | Изучалось только взаимодействие с велпатасвиром. Ожидается: ↔ Софосбувир |
Одновременное применение препарата Эпклюза® с дигоксином может привести к повышению концентрации дигоксина. При совместном применении дигоксина с препаратом Эпклюза® следует соблюдать осторожность, и рекомендуется регулярный контроль терапевтической концентрации дигоксина. | |||
| Дигоксин (0,25 мг однократная доза)f/ велпатасвир (100 мг однократная доза) (Ингибирование |
Эффект, оказываемый на экспозицию велпатасвира не изучался Ожидается: ↔ Велпатасвир |
||||
| Наблюдается: Дигоксин |
↑ 1,9 (1,7, 2,1) |
↑ 1,3 (1,1, 1,6) |
|||
| АНТИКОАГУЛЯНТЫ | |||||
| Дабигатрана этексилат
(Ингибирование |
Взаимодействие не исследовалось. Ожидается: ↑ Дабигатран ↔ Софосбувир ↔ Велпатасвир |
При совместном применении дабигатрана этексилата с препаратом Эпклюза® рекомендуется проводить клинический мониторинг с целью обнаружения признаков кровотечения и анемии. Анализ на свертываемость крови помогает выявить пациентов с повышенным риском кровотечения в связи с усилением воздействия дабигатрана. | |||
| Антагонисты витамина К | Взаимодействие не исследовалось. | При использовании совместно со всеми антагонистами витамина К требуется тщательный мониторинг МНО. Это связано с изменением функции печени во время лечения с применением препарата Эпклюза®. | |||
| ПРОТИВОСУДОРОЖНЫЕ ПРЕПАРАТЫ | |||||
| Карбамазепин Фенитоин Фенобарбитал (Индукция Р-гликопротеина и ферменты системы цитохрома) |
Взаимодействие не исследовалось. Ожидается: ↓ Софосбувир ↓ Велпатасвир |
Препарат Эпклюза® противопоказан в комбинации с карбамазепином, фенобарбиталом и фенитоином, которые являются сильными индукторами P-gp и цитохрома Р450 (см. радел «Противопоказания»). | |||
| Окскарбазепин
(Индукция Р-гликопротеина и ферментов системы цитохрома) |
Взаимодействие не исследовалось. Ожидается: ↓ Софосбувир ↓ Велпатасвир |
Считается, что совместное применение препарата Эпклюза® с окскарбазепином понижает концентрацию софосбувира и велпатасвира, что приведет к снижению терапевтического эффекта препарата Эпклюза®. Одновременный прием не рекомендуется (см. раздел «Особые указания»). |
|||
| ПРОТИВОГРИБКОВЫЕ СРЕДСТВА | |||||
| Кетоконазол | Изучалось только взаимодействие с велпатасвиром. Ожидается: ↔ Софосбувир |
Корректировка дозы препарата Эпклюза® или кетоконазола не требуется. | |||
| Кетоконазол (200 мг дважды в сутки)/ велпатасвир (100 мг однократная доза)d |
Эффект на экспозицию кетоконазола не исследовался. Ожидается: ↔ Кетоконазол (Ингибирование Р-гликопротеина и ферментов системы цитохрома) Итраконазолe |
||||
| Наблюдается: Велпатасвир |
↑ 1,3 (1,0, 1,6) |
↑ 1,7 (1,4, 2,2) |
|||
| АНТИМИКОБАКТЕРИАЛЬНЫЕ СРЕДСТВА | |||||
| Рифампицин (600 мг один раз в стуки)/ софосбувир (однократная доза 400 мг)d
(Индукция Р-гликопротеина и ферментов системы цигохрома) |
Эффект, оказываемый на экспозицию рифампицина не изучался. Ожидается: ↔ Рифампицин |
Совместное применение препарата Эпклюза® с рифампицином, мощным индуктором Р-гликопротеина и цигохрома Р450 противопоказано (см. раздел «Противопоказания»). | |||
| Наблюдается: Софосбувир |
↓ 0,23 (0,19, 0,29) |
↓ 0,28 (0,24, 0,32) |
|||
| Рифампицин (600 мг один раз в стуки)/ велпатасвир (однократная доза 100 мг)
(Индукция Р-гликопротеина и ферментов системы цитохрома) |
Эффект, оказываемый на экспозицию рифампицина не изучался.
Ожидается: |
||||
| Наблюдается: Велпатасвир |
↓ 0,29 (0,23, 0,37) |
↓ 0,18 (0,15, 0,22) |
|||
| Рифабутин Рифапентин (Индукция Р-гликопротеина и ферментов системы цитохрома) |
Взаимодействие не исследовалось. Ожидается: ↓ Софосбувир ↓ Велпатасвир |
Совместное применение препарата Эпклюза® с рифабутином, мощным индуктором Р-гликопротеина и цитохрома Р450 противопоказано (см. раздел «Противопоказания»).
Считается, что совместное применение препарата Эпклюза® с рифапентином понижает концентрацию софосбувира и велпатасвира, что приведет к снижению терапевтического эффекта препарата Эпклюза®. Одновременный прием не рекомендуется (см. раздел «Особые указания»). |
|||
| ПРОТИВОВИРУСНЫЕ ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ ВИЧ: ИНГИБИТОРЫ ОБРАТНОЙ ТРАНСКРИПТАЗЫ | |||||
| Тенофовира дизопроксила фумарат | Препарат Эпклюза® продемонстрировал повышение экспозиции тенофовира (ингибирование Р-гликопротеина). Повышение экспозиции тенофовира (AUC и Сmax) приблизительно составило 40-80% во время совместного применения с препаратом Эпклюза® и тенофовира дизопроксила фумарат/эмтрицитабин в различных схемах лечения ВИЧ.
Пациенты, получающие одновременно тенофовира дизопроксила фумарат и препарат Эпклюза®, должны подвергаться мониторингу на выявление нежелательных реакций, связанных с тенофовира дизопроксила фумаратом. См. инструкцию по медицинскому применению препаратов, содержащих тенофовира дизопроксила фумарат, для получения рекомендаций по мониторингу функции почек (см. раздел «Особые указания»). |
||||
| Эфавиренз/ эмтрицитабин/ тенофовира дизопроксила фумарат (600/ 200/ 300 мг один раз в сутки)/ софосбувир/ велпатасвир (400/ 100 мг один раз в сутки)c,d |
Эфавиренз | ↔ | ↔ | ↔ | Совместное применение препарата Эпклюза® с препаратами эфавиренз/ эмтрицитабин/ тенофовира дизопроксила фумарат ожидаемо снизит концентрацию велпатасвира. Совместное применение препарата Эпклюза® в схемах, содержащих эфавиренз, не рекомендуется (см. раздел «Особые указания»). |
| Софосбувир | ↑ 1,4 (1,1, 1,7) |
↔ | |||
| Велпатасвир | ↓ 0,53 (0,43, 0,64) |
↓ 0,47 (0,39, 0,57) |
↓ 0,43 (0,36, 0,52) |
||
| Эмтрицитабин/ рилпивирин/ тенофовира дизопроксила фумарат (200/ 25/ 300 мг один раз в сутки)/ софосбувир/ велпатасвир (400/ 100 мг один раз в сутки)c,d |
Рилпивирин | ↔ | ↔ | ↔ | Корректировка дозы препарата Эпклюза® или эмтрицитабии/рилпивирин/ тенофовира дизопроксила фумарат не требуется. |
| Софосбувир | ↔ | ↔ | |||
| Велпатасвир | ↔ | ↔ | ↔ | ||
| ПРОТИВОВИРУСНЫЕ ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ ВИЧ: ИНГИБИТОРЫ ПРОТЕАЗЫ ВИЧ | |||||
| Атазанавир, усиленный ритонавиром (300/ 100 мг один раз в сутки) + эмтрицитабин/ тенофовира дизопроксила фумарат (200/300 мг один раз в сутки)/ софосбувир / велпатасвир (400 / 100 мг один раз/сутки)c,d |
Атазанавир | ↔ | ↔ | ↑ 1,4 (1,2, 1,6) |
Корректировка дозы препарата Эпклюза®, атазанавира (усиленного ритонавиром) или эмтрицитабин/ тенофовира дизопроксила фумарат не требуется. |
| Ритонавир | ↔ | ↑ 1,3 (1,5, 1,4) |
|||
| Софосбувир | ↔ | ↔ | |||
| Велпатасвир | ↑ 1,6 (1,4, 1,7) |
↑ 2,4 (2,2, 2,6) |
↑ 4,0 (3,6, 4,5) |
||
| Дарунавир, усиленный ритонавиром (800 мг/ 100 мг один раз в сутки) + эмтрицитабин/ тенофовира дизопроксила фумарат (200/ 300 мг один раз в сутки) / софосбувир/ велпатасвир (400/ 100 мг один раз в сутки)c,d |
Дарунавир | ↔ | ↔ | ↔ | Корректировка дозы препарата Эпклюза®, дарунавира (усиленного ритонавиром) или эмтрицитабин/ тенофовира дизопроксила фумарат не требуется, |
| Ритонавир | ↔ | ↔ | ↔ | ||
| Софосбувир | ↓ 0,62 (0,54, 0,71) |
↓ 0,72 (0,66, 0,80) |
|||
| Велпатасвир | ↓ 0,76 (0,65, 0,89) |
↔ | ↔ | ||
| Лопннавир, усиленный ритонавиром (4×200 мг/ 50 мг один раз в сутки) + эмтрицитабин/ тенофовира дизопроксила фумарат (200/300 мг один раз в сутки) / софосбувир/ велпатасвир (400/100 мг один раз в сутки )c,d |
Лопинавир | ↔ | ↔ | ↔ | Корректировка дозы препарата Эпклюза®, лопинавира (усиленного ритонавиром) или эмтрицитабин/ тенофовира дизопроксила фумарат не требуется. |
| Ритонавир | ↔ | ↔ | ↔ | ||
| Софосбувир | ↓ 0,59 (0,49 0,71) |
↓ 0,7 (0,6, 0,8) |
|||
| Велпатасвир | ↓ 0,70 (0,59, 0,83) |
↔ | ↑ 1,6 (1,4, 1,9) |
||
| ПРОТИВОВИРУСНЫЕ ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ ВИЧ: ИНГИБИТОРЫ ИНТЕГРАЗЫ | |||||
| Ралтегравир (400 мг дважды в сутки)g + эмтрицитабин/ тенофовира дизопроксила фумарат (200/300 мг один раз в сутки) / софосбувир/ велпатасвир (400/100 мг один раз в сутки)c,d |
Ралтегравир | ↔ | ↔ | ↓ 0,79 (0,42, 1,5) |
Корректировка дозы препарата Эпклюза®, ралтегравира или эмтрицитабин/ тенофовира дизопроксила фумарат не требуется. |
| Софосбувир | ↔ | ↔ | |||
| Велпатасвир | ↔ | ↔ | ↔ | ||
| Элвитегравнр/ кобицистат/ эмтрицитабин/ тенофовира дизопроксила фумарат (150/ 150/200/ 10 мг один раз в сутки ) софосбувир/ велпатасвир (400/ 100 мг один раз в сутки)c,d |
Элвитегравир | ↔ | ↔ | ↔ | Корректировка дозы препарата Элклюза0′ или элвитегравир/ кобицистат/эмтрицитабин / тенофовира дизопроксила фумарат не требуется. |
| Кобицистат | ↔ | ↔ | ↑ 2,0 (1,7, 2,5) |
||
| Тенофовира алафенамид |
↔ | ↔ | |||
| Софосбувир | ↔ | ↑ 1,4 (1,2, 1,5) |
|||
| Велпатасвир | ↑ 1,3 (1,2, 1,5) |
↑ 1,5 (1,4, 1,7) |
↑ 1,6 (1,4, 1,8) |
||
| Элвитегравир/ кобицистат/ эмтрицитабин/ тенофовира дизопроксила фумарат (150/ 150/ 200/ 300 мг один раз в сутки)/ софосбувир/ велпатасвир (400/ 100 мг один раз в сутки)c,d |
Элвитегравир | ↔ | ↔ | ↔ | Корректировка дозы препарата Эпклюза® или элвитегравир/ кобицистат/эмтрицитабин/ тенофовира дизопроксила фумарат не требуется. |
| Кобицистат | ↔ | ↔ | ↑ 1,7 (1,5, 1,9) |
||
| Софосбувир | ↔ | ↔ | |||
| Велпатасвир | ↔ | ↔ | ↑ 1,4 (1,2, 1,5) |
||
| Долутегравир (50 мг один раз в сутки)/ софосбувир/ велпатасвир (400/ 100 мг один раз в сутки) |
Долутегравир | ↔ | ↔ | ↔ | Корректировка дозы препарата Эпклюза® или долутегравира не требуется. |
| Софосбувир | ↔ | ↔ | |||
| Велпатасвир | ↔ | ↔ | ↔ | ||
| ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ РАСТИТЕЛЬНОГО ПРОИСХОЖДЕНИЯ | |||||
| Зверобой продырявленный (Индукция Р-гликопротеина и ферментов системы цитохрома) |
Взаимодействие не исследовалось. Ожидается: ↓ Софосбувир ↓ Велпатасвир |
Совместное применение препарата Эпклюза® со зверобоем продырявленным, мощным индуктором Р-гликопротеина и цитохрома Р450 противопоказано (см. раздел «Противопоказания»). | |||
| ИНГИБИТОРЫ РЕДУКТАЗЫ ГМГ-КоА | |||||
| Розувастатин | Изучалось только взаимодействие с велпатасвиром. Ожидается: ↔ Софосбувир |
Совместное применение препарата Эпклюза® и розувастатина может увеличить концентрацию розувастатина, и таким образом увеличить риск возникновения миопатии, включая рабдомиолиз. Розувастатин в дозе, не превышающей 10 мг, может применяться с препаратом Эпклюза®. | |||
| Розувастатин (10 мг однократная доза)/ велпатасвир (100 мг один раз в сутки )d (Ингибирование ОАТР1В и BCRP) |
Наблюдается: Розувастатин |
↑ 2,6 (2,3, 2,9) |
↑ 2,7 (2,5, 2,9) |
||
| Эффект, оказываемый на воздействие велпатасвира, не изучался Ожидается: ↔ Велпатасвир |
|||||
| Правастатин | Изучалось только взаимодействие с велпатасвиром. Ожидается: ↔ Софосбувир |
Корректировка дозы препарата Эпклюза® или правастатина не требуется. | |||
| Правастатин (40 мг однократная доза)/ велпатасвир (100 мг один раз в суткиd
(Ингибирование ОАТР1В) |
Наблюдается: Правастатин |
↑ 1,3 (1,1, 1,5) |
↑ 1,4 (1,2, 1,5) |
||
| Эффект, оказываемый на воздействие велпатасвира, не изучался Ожидается: ↔ Велпатасвир |
|||||
| Другие статины | Ожидается: ↑ Статины |
Взаимодействия с другими ингибиторами редуктазы ГМГ-КоА не могут исключаться. При совместном применении с препаратом Эпклюза® следует рассматривать уменьшение дозы статинов, также следует проводить тщательный мониторинг нежелательных реакций, связанных с приемом статинов. | |||
| НАРКОТИЧЕСКИЕ АНАЛЬГЕТИКИ | |||||
| Метадон (Поддерживающая терапия метадоном [30-130 мг/сутки])/ софосбувир (400 мг один раз/сутки )d |
R-метадон | ↔ | ↔ | ↔ | Корректировка дозы препарата Эпклюза® или метадона не требуется. |
| S-метадон | ↔ | ↔ | ↔ | ||
| Софосбувир | ↔ | ↑ 1,3 (1,0, 1,7) |
|||
| Метадон | Изучалось только взаимодействие с софосбувиром Ожидается: ↔ Велпатасвир |
||||
| ИММУНОДЕПРЕССАНТЫ | |||||
| Циклоспорин (600 мг однократная доза)/ софосбувир (400 мг однократная доза)f |
Циклоспорин | ↔ | ↔ | Корректировка дозы препарата Эпклюза® или циклоспорина не требуется. | |
| Софосбувир | ↑ 2,5 (1,9, 3,5) |
↑ 4,5 (3,3, 6,3) |
|||
| Циклоспорин (600 мг однократная доза)f/ велпатасвир (100 мг однократная доза)d |
Циклоспорин | ↔ | ↓ 0,88 (0,78, 1,0) |
||
| Велпатасвир | ↑ 1,6 (1,2, 2,0) |
↑ 2,0 (1,5, 2,7) |
|||
| Такролимус (5 мг однократная доза)f/ софосбувир (400 мг однократная доза)d |
Такролимус | ↑ 0,73 (0,59, 0,90) | ↑ 1,1 (0,84, 1,4) | Корректировка дозы препарата Эпклюза® или такролимуса не требуется. | |
| Софосбувир | ↓ 0,97 (0,65, 1,4) |
↑ 1,1 (0,81, 1,6) |
|||
| Такролимус | Эффект, оказываемый на воздействие велпатасвира, не изучался. Ожидается: ↔ Велпатасвир |
||||
| ПЕРОРАЛЬНЫЕ КОНТРАЦЕПТИВЫ | |||||
| Норгэстимат/ этинилэстрадиол (норгэстимат 0,180 мг/ 0,215 мг/ 0,25 мг/ этинилэстрадиол 0,025 мг)/ софосбувир (400 мг раз в сутки )d |
Норэлгестромин | ↔ | ↔ | ↔ | Корректировка дозы пероральных контрацептивов не требуется. |
| Норгестрел | ↔ | ↑ 1,2 (0,98, 1,5) |
↑ 1,2 (1,0, 1,5) |
||
| Этинилэстрадиол | ↔ | ↔ | ↔ | ||
| Норгэстимат/ этинилэстрадиол (норгэстимат 0,180 мг/ 0,215 мг/ 0,25 мг/ этинилэстрадиол 0,025 мг)/ велпатасвир (100 мг раз в сутки )d |
Норэлгестромин | ↔ | ↔ | ↔ | |
| Норгестрел | ↔ | ↔ | ↔ | ||
| Этинилэстрадиол | ↑ |
1,4 (1,2, 1,7)↔ |
↓ 0,83 (0,65, 1,1) |
а. Среднее соотношение (90% ДИ) фармакокинетики совместно вводимого препарата с исследуемым лекарственным препаратом в отдельности или в комбинации. Отсутствие эффекта = 1,00
b. Все исследования межлекарственных взаимодействий проводились с участием здоровых добровольцев.
c. Принимаемый в составе препарата Эпюпоза®.
d. Отсутствие ограничений фармакокинетического взаимодействия составляет 70-143%.
e. Эти препараты относятся к классу, в котором представляется возможным предвидеть подобные случаи взаимодействия.
f. Пределы биоэквивалентности/эквивалентности составляют 80-125%.
g. Отсутствие ограничений фармакокинетического взаимодействия составляет 50-200%.
Особые указания
Препарат Эпклюза® не следует одновременно применять с другими лекарственными препаратами, содержащими софосбувир.
Тяжелая брадикардия и блокада сердца (в частности, атриовентрикулярная (АВ) или синоатриальная блокада)
Наблюдались случаи тяжелой брадикардии и блокады сердца (в частности, атриовентрикулярная (АВ) или синоатриальная блокада) при применении софосбувир-содержащих режимов в сочетании с амиодароном, независимо от других лекарственных препаратов, замедляющих частоту сердечных сокращений. Механизм действия не был установлен.
Сопутствующий прием амиодарона был ограничен в ходе клинической разработки софосбувира. Такие случаи потенциально представляют угрозу для жизни, поэтому амиодарон должен применяться у пациентов, которые принимают препарат Эпклюза®, только в случае если другие альтернативные антиаритмические виды лечения не переносятся или противопоказаны.
В случае если сопутствующий прием амиодарона считается необходимым, рекомендуется проводить тщательный мониторинг пациентов, которые начинают прием препарата Эпклюза®. Пациенты, которые находятся в группе высокого риска возникновения брадиаритмии, должны находиться под непрерывным мониторингом в течение 48 часов в надлежащих клинических условиях.
Ввиду продолжительного периода полувыведения амиодарона, соответствующий мониторинг также должен осуществляться у пациентов, которые прекратили прием амиодарона в течение последних нескольких месяцев и должны начать прием препарата Эпклюза®.
Всех пациентов, принимающих препарат Эпклюза® в комбинации с амиодароном, независимо от приема других препаратов, понижающих частоту сердечных сокращений, следует также предупредить о симптомах брадикардии и блокады сердца (в частности, атриовентрикулярная (АВ) или синоатриальная блокада) и порекомендовать незамедлительно обращаться за медицинской помощью в случае их возникновения.
Пациенты с неудачей лечения терапией по схеме, включающей NS5A
Клинические данные, подтверждающие эффективность софосбувира/велпатасвира для лечения пациентов, продемонстрировавших отсутствие результатов предыдущего лечения режимом, включающим другой ингибитор NS5A, отсутствуют. Тем не менее, на основании вариантов, связанных с резистентностью к NS5A, обычно наблюдавшихся у пациентов с неэффективностью предыдущего лечения, включающего другой ингибитор NS5A, фармакологии велпатасвира in vitro, а также результатов лечения в исследованиях ASTRAL с применением софосбувира/велпатасвира у пациентов, ранее не получавших лечение с применением NS5A, и исходно имевших варианты, связанные с резистентностью к NS5A, лечение с применением препарата Эпклюза® + РБВ в течение 24 недель может быть рассмотрено для пациентов с неудачей предыдущего лечения, включающего NS5A и с высоким риском прогрессирования клинического заболевания при отсутствии альтернативных вариантов лечения.
Почечная недостаточность
Для пациентов с легким или умеренным нарушением функции почек, корректировка дозы препарата Эпклюза® не требуется. У пациентов с нарушением функции почек тяжелой степени (расчетная скорость клубочковой фильтрации [рСКФ] <30 мл/мин/1,73 м²) или терминальной стадией хронической почечной недостаточности (терминальная стадия ХПН), требующей гемодиализа, безопасность препарата Эпклюза® не оценивалась. При использовании препарата Эпклюза® в комбинации с рибавирином у пациентов с клиренсом креатинина (КК) <50 мл/мин необходимо также ознакомиться с краткой характеристикой лекарственного препарата рибавирина (см. раздел «Фармакологические свойства»).
Применение совместно с умеренными индукторами Р-гликопротеина или умеренными индукторами цитохрома Р450
Лекарственные препараты, которые являются умеренными индукторами Р-гликопротеина или умеренными индукторами цитохрома Р450 (например, окскарбазепин, модафинил или эфавиренз), могут вызывать снижение концентрации софосбувира или велпатасвира в плазме крови, что может привести к ослаблению терапевтического действия препарата Эпклюза®. Совместное применение препарата Эпклюза® с такими препаратами не рекомендуется (см. раздел «Взаимодействие с другими лекарственными средствами»).
Применение совместно с некоторыми схемами антиретровирусной терапии для лечения ВИЧ
Препарат Эпклюза® увеличивает экспозицию тенофовира, особенно при совместном применении со схемой лечения ВИЧ, содержащей тенофовира дизопроксил фумарат и фармакокинетические усилитель (ритонавир или кобицистат). Безопасность тенофовира дизопроксил фумарата на фоне применения препарата Эпклюза® и фармакокинетического усилителя не установлена. Потенциальные риски и польза, связанные с одновременным приемом препарата Эпклюза® и комбинированного препарата с фиксированными дозами, содержащего элвитегравир/кобицистат/эмтрицитабин/тенофовира дизопроксил фумарат или с приемом тенофовира дизопроксил фумарата, который назначается совместно с усиленным ингибитором протеазы ВИЧ (например, атазанавиром или дарунавиром), должны рассматриваться, особенно у пациентов с повышенным риском почечной дисфункции. Пациенты, принимающие препарат Эпклюза® совместно с такими препаратами, как элвитегравир/ кобицистат/ эмтрицитабин/ тенофовира дизопроксил фумарат или тенофовира дизопроксил фумарат и усиленный ингибитор протеазы ВИЧ, должны наблюдаться на предмет возникновения нежелательных реакций, связанных с тенофовиром. Для ознакомления с рекомендациями по контролю функции почек см. инструкцию по применению препаратов, в состав которых входят тенофовира дизопроксила фумарат, эмтрицитабин/тенофовира дизопроксила фумарат или элвитегравир/кобицистат/эмтрицитабин/тенофовира дизопроксила фумарат.
Применение у пациентов с сахарным диабетом
У пациентов с сахарным диабетом может отмечаться улучшение контроля глюкозы, что может приводить к симптоматической гипогликемии после начала лечения препаратами прямого противовирусного действия для лечения гепатита С. Следует тщательно контролировать уровень глюкозы у пациентов с сахарным диабетом, начинающих лечение препаратами прямого противовирусного действия, особенно в течение первых 3 месяцев, и при необходимости менять лекарственную терапию сахарного диабета. Врач, отвечающий за лечение пациента с сахарным диабетом, должен быть проинформирован о начале противовирусной терапии гепатита С препаратами прямого действия.
Ко-инфекция ВГС/ВГВ (вирус гепатита В)
Во время или после приема противовирусных препаратов прямого действия сообщалось о случаях повторной активации вируса гепатита В (ВГВ), некоторые из которых привели к фатальным исходам. Скрининг на выявление ВГВ должен проводиться для всех пациентов перед началом лечения. Пациенты, имеющие сопутствующие ко-инфекции ВГС/ВГВ, имеют риск повторной активации ВГВ, поэтому их состояние следует отслеживать и контролировать в соответствии с действующими клиническими руководствами.
Цирроз класса С по классификации Чайлд-Пью-Туркотт
Безопасность и эффективность препарата Эпклюза® не оценивалась у пациентов с циррозом класса С по классификации Чайлд-Пью-Туркотт (см. разделы «Фармакологические свойства» и «Побочное действие»).
Пациенты, перенесшие трансплантацию печени
Безопасность и эффективность препарата Эпклюза® у пациентов, инфицированных ВГС, перенесших трансплантацию печени, не оценивалась. При принятии решения относительно лечения с применением препарата Эпклюза® согласно рекомендуемому дозированию (см. раздел «Способ применения и дозы»), следует руководствоваться оценкой потенциальных рисков и пользы для каждого пациента.
Влияние на способность управлять транспортными средствами, механизмами
Препарат Эпклюза® не оказывает или оказывает умеренное влияние на способность управлять транспортными средствами и механизмами.
Форма выпуска
Таблетки, покрытые пленочной оболочкой, 100 мг + 400 мг.
По 28 таблеток во флакон белого цвета, вместимостью 75 мл из полиэтилена высокой плотности (ПЭВП), запаянный алюминиевой фольгой, укупоренный полипропиленовой крышкой с системой защиты от вскрытия детьми.
Свободное пространство флакона заполняют упаковочным материалом из полиэфирного волокна.
По 1 флакону вместе с инструкцией по применению в пачке картонной.
Условия хранения
Хранить при температуре не выше 30 °С.
Хранить в местах, недоступных для детей.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска
Отпускают по рецепту.
Владелец регистрационного удостоверения
Гилеад Сайенсиз Интернешнл Лтд., Великобритания
Gilead Sciences International Ltd, UK
Flowers Building, Granta Park, Great Abington, Cambridge, CB21 6GT, UK
Производитель
Производство готовой лекарственной формы:
Гилеад Сайенсиз Айелэнд ЮСи, Ирландия
Gilead Sciences Ireland UC, Ireland
IDA Business and Technology Park, Carrigtohill, Co. Cork, Ireland
Патеон Инк., Канада
Patheon Inc., Canada
2100 Syntex Court, Mississauga, Ontario, L5N 7K9, Canada
Первичная упаковка:
Гилеад Сайенсиз Айелэнд ЮСи, Ирландия
Gilead Sciences Ireland UC, Ireland
IDA Business and Technology Park, Carrigtohill, Co. Cork, Ireland
Патеон Инк., Канада Patheon Inc., Canada
2100 Syntex Court, Mississauga, Ontario, L5N 7K9, Canada
Выпускающий контроль качества:
Гилеад Сайенсиз Айелэнд ЮСи, Ирландия
Gilead Sciences Ireland UC, Ireland
IDA Business and Technology Park, Carrigtohill, Co. Cork, Ireland
Получить дополнительную информацию о препарате, а также направить свои претензии и информацию о нежелательных явлениях можно по адресу:
ООО «Гилеад Сайенсиз Раша»
Российская Федерация, 115114 Москва, ул. Летниковская, дом, 2 строение 1
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Софбувир (Sofbuvir)
💊 Состав препарата Софбувир
✅ Применение препарата Софбувир
Описание активных компонентов препарата
Софбувир
(Sofbuvir)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2022.07.01
Владелец регистрационного удостоверения:
Код ATX:
J05AP08
(Софосбувир)
Лекарственная форма
| Софбувир |
Таб., покр. пленочной оболочкой, 400 мг: 28 или 30 шт. рег. №: ЛП-006616 |
Форма выпуска, упаковка и состав
препарата Софбувир
Таблетки, покрытые пленочной оболочкой белого цвета, капсуловидные, двояковыпуклые; на изломе таблетка белого или почти белого цвета.
Вспомогательные вещества: гипролоза — 80 мг, кремния диоксид коллоидный — 6 мг, мальтитол — 134 мг, натрия стеарилфумарат — 6 мг, повидон К30 — 14 мг.
Состав пленочной оболочки: титана диоксид — 2 мг, макрогол 3350 — 2.1 мг. поливиниловый спирт — 4.2 мг, тальк — 1.7 мг.
7 шт. — упаковки ячейковые контурные (4) — пачки картонные.
10 шт. — упаковки ячейковые контурные (3) — пачки картонные.
28 шт. — банки — пачки картонные.
Фармакологическое действие
Противовирусное средство, пан-генотипический ингибитор РНК-зависимой РНК-полимеразы NS5B вируса гепатита С. Софосбувир — нуклеотидное про-лекарство, подвергается внутриклеточному метаболизму, в процессе которого формируется фармакологически активный аналог уридинтрифосфата (GS-461203). С помощью NS5B полимеразы GS-461203 может встраиваться в строящуюся цепочку РНК вируса гепатита С и действовать как обрыватель цепи. Этот активный метаболит софосбувира (GS-461203) подавляет активность полимеразы генотипов 1b, 2а, 3а и 4а вируса гепатита С в концентрациях, вызывающих 50% ингибицию (IC50), в диапазоне от 0.7 до 2.6 мкмоль.
Фармакокинетика
После приема внутрь софосбувир быстро всасывается, Cmax в плазме крови достигается через 0.5-2 ч вне зависимости от величины принятой дозы. Сmax неактивного метаболита (GS-331007) в плазме крови достигалась через 2-4 ч после приема препарата. По результатам популяционного анализа фармакокинетических данных у пациентов с генотипами 1-6 вируса гепатита С, значения AUC0-24 софосбувира и неактивного метаболита (GS-331007) в равновесном состоянии равны 1010 нг×ч/мл и 7200 нг×ч/мл соответственно. По сравнению со здоровыми добровольцами, AUC0-24 софосбувира и неактивного метаболита (GS-331007) у пациентов с хроническим гепатитом С на 57% выше и на 39% ниже соответственно.
Прием софосбувира в однократной дозе с пищей с высоким содержанием жиров замедляет скорость всасывания софосбувира. Полнота всасывания софосбувира увеличивается примерно в 1.8 раз, при этом наблюдается незначительное влияние на Cmax. Прием пищи с высоким содержанием жиров не влияет на экспозицию неактивного метаболита (GS-331007). Установлено, что при приеме натощак софосбувира в дозах от 200 мг до 400 мг AUC софосбувира и неактивного метаболита (GS-331007) практически пропорциональна дозе.
Софосбувир примерно на 85% связывается с белками плазмы крови человека (данные ex vivo), степень связывания не зависит от концентрации препарата в диапазоне 1-20 мкг/мл. Неактивный метаболит (GS-331007) в минимальной степени связывается с белками плазмы крови. После однократного приема [14С]-софосбувира в дозе 400 мг здоровыми добровольцами соотношение радиоактивности 14С в крови/плазме составляло приблизительно 0.7.
Софосбувир интенсивно метаболизируется в печени с формированием фармакологически активного нуклеозидного (уридинового) аналога трифосфата (GS-461203). Метаболический путь активации включает последовательный гидролиз молекулы карбоксилэстеразы катепсином A (CatA) или карбоксилэстеразой 1 (CES1) и расщепление фосфорамидата нуклеотид-связывающим белком 1 с гистидиновыми триадами (HINT1) с последующим фосфорилированием путем биосинтеза пиримидинового нуклеотида. Дефосфорилирование приводит к образованию нуклеозидного неактивного (>90%) метаболита, который не может быть полностью рефосфорилирован, и не обладает активностью против HCV in vitro.
После однократного приема внутрь [14С]-софосбувира в дозе 400 мг системная экспозиция софосбувира и неактивного метаболита (GS-331007) составляла примерно 4 и >90% соответственно от системной экспозиции материала, связанного с препаратом (сумма AUC софосбувира и его метаболитов с коррекцией на молекулярную массу).
После однократного приема внутрь [14С]-софосбувира в дозе 400 мг среднее общее выведение радиоактивной дозы составляло более 92%, при этом приблизительно 80%, 14% и 2.5% выводилось почками, кишечником и легкими соответственно. Большая часть дозы софосбувира, выводимая почками, представляла неактивный метаболит (GS-331007) (78%), тогда как 3.5% выводилось в виде софосбувира. Эти данные показывают, что почечный клиренс является основным путем выведения неактивного метаболита (GS-331007) с преимущественной активной секрецией. Средний Т1/2 софосбувира и неактивного метаболита (GS-331007) составляет 0.4 ч и 27 ч соответственно.
Фармакокинетика в особых клинических случаях
По сравнению с пациентами с нормальной функцией почек (КК >80 мл/мин), не инфицированными вирусом гепатита С, при почечной недостаточности легкой, средней и тяжелой степени тяжести, AUC0-inf софосбувира была выше соответственно на 61%, 107% и 171%, a AUC0-inf неактивного метаболита (GS-331007) была выше на 55%, 88% и 451% соответственно. У пациентов с хронической почечной недостаточностью по сравнению с пациентами с нормальной функцией почек AUC0-inf софосбувира была на 28% выше, если софосбувир принимали за 1 ч до сеанса гемодиализа, и на 60% выше, если софосбувир принимали через 1 ч после сеанса гемодиализа. Основной неактивный метаболит (GS-331007) может быть эффективно удален с помощью гемодиализа (клиренс составляет около 53%). После 4-часового сеанса гемодиализа выводится примерно 18% от принятой дозы препарата.
По сравнению с пациентами с нормальной функцией печени AUC0-24 софосбувира была на 126% и 143% выше у пациентов с печеночной недостаточностью средней и тяжелой степени тяжести, AUC0-24 неактивного метаболита (GS-331007) была выше на 18% и 9% соответственно.
Показания активных веществ препарата
Софбувир
Лечение хронического гепатита С у взрослых пациентов (в комбинации с другими лекарственными препаратами).
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Внутрь. Рекомендуемая доза составляет 400 мг 1 раз/сут.
Софосбувир применяют в комбинации с другими лекарственными препаратами для лечения хронического гепатита С. Монотерапия софосбувиром не рекомендуется.
Побочное действие
Нежелательные реакции, идентифицированные при применении софосбувира в комбинации с рибавирином
Со стороны системы кроветворения: очень часто — снижение концентрации гемоглобина; часто — анемия.
Нарушения психики: очень часто — бессонница; часто — депрессия.
Со стороны нервной системы: очень часто — головная боль; часто — нарушение внимания.
Со стороны дыхательной системы: часто — назофарингит, одышка, одышка при физической нагрузке, кашель.
Со стороны пищеварительной системы: очень часто — тошнота, повышение концентрации билирубина в крови; часто — дискомфорт в животе, запор, диспепсия.
Со стороны кожи и подкожно-жировой клетчатки: часто — алопеция, сухость кожи, зуд.
Со стороны костно-мышечной системы: часто — артралгия, боль в спине, мышечные спазмы, миалгия.
Прочие: очень часто — раздражительность, утомляемость; часто — лихорадка, астения.
Нежелательные реакции, идентифицированные при применении софосбувира в комбинации с пэгинтерфероном альфа/рибавирином
Со стороны системы кроветворения: очень часто — анемия, нейтропения, снижение числа лимфоцитов, снижение числа тромбоцитов.
Нарушения психики: очень часто — бессонница; часто — депрессия, тревожность, возбуждение.
Со стороны нервной системы: очень часто — головокружение, головная боль; часто — мигрень, ухудшение памяти, нарушение внимания.
Со стороны органа зрения: часто — неясное зрение.
Со стороны дыхательной системы: очень часто — одышка, кашель; часто — одышка при физической нагрузке.
Со стороны пищеварительной системы: очень часто — снижение аппетита, диарея, тошнота, рвота, повышение концентрации билирубина в крови; часто — запор, сухость во рту, гастроэзофагеальный рефлюкс.
Со стороны кожи и подкожно-жировой клетчатки: очень часто — сыпь, зуд; часто — алопеция, сухость кожи.
Со стороны костно-мышечной системы: очень часто — артралгия, миалгия; часто — мышечные спазмы.
Прочие: очень часто — озноб, утомляемость, гриппоподобное состояние, раздражительность, боль, лихорадка; часто — снижение массы тела, боль в спине, боль в груди, астения.
Противопоказания к применению
Повышенная чувствительность к софосбувиру; сочетанное инфицирование вирусами гепатита С и В (отсутствуют данные о применении софосбувира у данной популяции пациентов); почечная недостаточность тяжелой степени тяжести (КК<30 мл/мин) или терминальная стадия почечной недостаточности, когда необходимо проведение гемодиализа; декомпенсированный цирроз печени; одновременное применение мощных индукторов Р-гликопротеина (например, рифампицин, зверобой продырявленный (Hypericum perforatum), карбамазепин, фенитоин, фенобарбитал, окскарбазепин); беременность; возраст до 18 лет.
Применение при беременности и кормлении грудью
Противопоказано применение софосбувира во время беременности.
Не следует применять софосбувир в период грудного вскармливания.
В случаях, когда софосбувир применяют в комбинации с рибавирином или с пэгинтерфероном альфа/рибавирином, женщины с сохраненным детородным потенциалом или их партнеры должны применять эффективные методы контрацепции в период лечения и после его окончания в течение необходимого периода времени, согласно рекомендациям при применении рибавирина.
Применение при нарушениях функции печени
Противопоказано применение при декомпенсированном циррозе печени.
Применение при нарушениях функции почек
Противопоказано применение при почечной недостаточности тяжелой степени тяжести (КК<30 мл/мин) или терминальной стадии почечной недостаточности, когда необходимо проведение гемодиализа.
Применение у детей
Противопоказано применение в возрасте до 18 лет (эффективность и безопасность не установлены у данной популяции).
Применение у пожилых пациентов
Препарат разрешен для применения у пожилых пациентов
Особые указания
Т.к. софосбувир назначают в комбинации с другими лекарственными препаратами для лечения хронического гепатита С, при прекращении приема других лекарственных препаратов софосбувир также отменяют.
С осторожностью следует назначать софосбувир пациентам с генотипом 1, 4, 5 и 6 вирусного гепатита С, ранее получавших противовирусную терапию, особенно в случаях, когда имеет место один и более факторов, исторически связанных с низкой частотой ответов на лечение интерфероном (распространенный фиброз/цирроз печени, исходно высокая концентрация вируса, негроидная раса, наличие не-СС аллели генотипа IL28B); пациентам, одновременно принимающим другие противовирусные препараты для лечения гепатита С (например, телапревир или боцепревир).
Сообщалось о случаях развития выраженной брадикардии и блокады сердца при применении комбинации софосбувира и даклатасвира в сочетании с амиодароном и/или другими лекарственными препаратами, замедляющими ЧСС. Побочные реакции, возникающие на фоне применения такой сочетанной терапии, потенциально угрожают жизни, поэтому применение амиодарона вместе с комбинацией софосбувира и даклатасвира допустимо лишь при непереносимости или наличии противопоказаний к альтернативной антиаритмической терапии. В тех случаях, когда сопутствующее применение амиодарона необходимо, рекомендуется пристальное наблюдение за пациентами в начале лечения комбинацией софосбувира и даклатасвира.
Софосбувир следует применять совместно с другими противовирусными препаратами прямого действия только в том случае, когда польза от такой комбинации превышает риск согласно имеющимся данным.
При применении софосбувира в комбинации с рибавирином или пэгинтерфероном альфа/рибавирином у пациентов с КК <50 мл/мин следует смотреть инструкцию по медицинскому применению препарата рибавирин.
Влияние на способность к управлению транспортными средствами и механизмами
Софосбувир оказывает умеренное влияние на способность управления транспортными средствами и механизмами. Пациентов необходимо проинформировать о том, что во время применения софосбувира в комбинации с пэгинтерфероном альфа и рибавирином возможно нарушение внимания, развитие утомляемости, головокружения и снижение четкости зрения. В случае появления указанных симптомов пациентам следует воздержаться от выполнения потенциально опасных видов деятельности, таких как управление транспортными средствами и использование механизмов.
Лекарственное взаимодействие
Мощные индукторы Р-гликопротеина в кишечнике (например, рифампицин, зверобой продырявленный, карбамазепин и фенитоин) могут понижать плазменную концентрацию софосбувира, приводя к снижению терапевтической эффективности препарата.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код

13.03.2023
Описание препарата Эпклюза® (таблетки, покрытые пленочной оболочкой, 100 мг+400 мг) основано на официальной инструкции, утверждено компанией-производителем в 2023 году
Дата согласования: 13.03.2023
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Отзывы
Действующее вещество
ATX
Фармакологическая группа
Состав
| Таблетки, покрытые пленочной оболочкой | 1 табл. |
| действующие вещества: | |
| велпатасвир | 100,0 мг |
| софосбувир | 400,0 мг |
| вспомогательные вещества | |
| ядро: коповидон; МКЦ; кроскармеллоза натрия; магния стеарат | |
| оболочка пленочная: Опадрай II розовый 85F94644 — поливиниловый спирт; титана диоксид; макрогол 3350; тальк; краситель железа оксид красный |
Описание лекарственной формы
Таблетки: ромбовидные, покрытые пленочной оболочкой розового цвета, с гравировкой «GSI» на одной стороне и «7916» — на другой.
Фармакологическое действие
Фармакологическое действие
—
противовирусное.
Фармакодинамика
Механизм действия
Софосбувир является пангенотипным ингибитором РНК-зависимой РНК-полимеразы NS5B вируса гепатита C (ВГС), необходимой для репликации вируса. Софосбувир — нуклеотидное пролекарство, которое в результате внутриклеточного метаболизма преобразуется в фармакологически активный трифосфат (GS-461203), аналог уридина, который встраивается в РНК ВГС с помощью полимеразы NS5B и действует как терминатор цепи. GS-461203 (активный метаболит софосбувира) не является ингибитором человеческой ДНК- и РНК-полимераз, а также не является ингибитором митохондриальной РНК-полимеразы.
Велпатасвир является ингибитором ВГС, который воздействует на неструктурный белок ВГС NS5A, необходимый и для репликации РНК и для формирования вирионов ВГС. Выборочные исследования резистентности и перекрестной резистентности in vitro показывают, что механизм действия велпатасвира — это воздействие на NS5A.
Противовирусная активность
В исследованиях c использованием репликонов ВГС значения эффективной концентрации (EC50) софосбувира против полноразмерных репликонов генотипов 1a, 1b, 2a, 3a и 4a составили 0,04, 0,11, 0,05, 0,05 и 0,04 мкмоль/л соответственно, а значения EC50 софосбувира против химерных репликонов генотипа 1b, несущих последовательности NS5B из генотипов 2b, 5a или 6a, составили 0,014–0,015 мкмоль/л. Медиана EC50 софосбувира в отношении химерных репликонов, несущих последовательности NS5B из клинических изолятов, составила 0,062 мкмоль/л для генотипа 1a; 0,102 мкмоль/л для генотипа 1b; 0,029 мкмоль/л для генотипа 2a и 0,081 мкмоль/л для генотипа 3a. Противовирусная активность софосбувира in vitro в отношении реже встречаемых генотипов 4, 5 и 6 была аналогичной активности в отношении генотипов 1, 2 и 3.
Значения ЕС50 велпатасвира против полноразмерных репликонов NS5A генотипов 1a, 1b, 2a, 2b, 3a, 4a, 4d, 5a и 6a составили от 0,002 до 0,021 мкмоль/л. Медиана EC50 велпатасвира против химерных репликонов, кодирующих последовательности NS5A клинических изолятов с генотипами 1a, 1b, 2a, 2b, 3a, 4a, 4d, 4r, 5a и 6a, составила от 0,002 до 0,019 мкмоль/л.
Присутствие 40% сыворотки крови человека не оказывало влияния на активность софосбувира против ВГС, но снижало в 13 раз активность велпатасвира против репликонов генотипа 1а ВГС.
Софосбувир в комбинации с велпатасвиром не проявляли антагонистического действия в снижении уровня РНК ВГС в клетках репликонов.
Резистентность
В культуре клеток
Репликоны ВГС с пониженной чувствительностью к софосбувиру были выделены в клеточной культуре для многих генотипов, включая 1b, 2a, 2b, 3а, 4а, 5а и 6а. Пониженная чувствительность к софосбувиру была связана с первичным замещением S282T в NS5B в репликонах всех исследуемых генотипов. Направленный мутагенез замены S282T в репликонах генотипов 1–6 приводил к 2–18-кратному снижению чувствительности к софосбувиру и снижению репликативной активности вируса на 89–99% по сравнению с соответствующим вирусом дикого типа. В биохимических тестах способность активного трифосфата софосбувира (GS-461203) к ингибированию рекомбинантной полимеразы NS5B генотипов 1b, 2a, 3a и 4a, с экспрессированием замены S282T, была снижена по сравнению со способностью к ингибированию рекомбинантной полимеразы NS5B дикого типа, что подтверждено 8,5–24-кратным повышением IC50.
Репликоны ВГС с пониженной чувствительностью к велпатасвиру были выделены в клеточной культуре in vitro для многих генотипов, включая 1a, 1b, 2a, 3а, 4а, 5а и 6а. Замены в позициях 24, 28, 30, 31, 32, 58, 92 и 93 были связаны с резистентностью к ингибиторам NS5A. Варианты, ассоциированные с резистентностью, отобранные в 2 или более генотипах, имели замены F28S, L31I/V и Y93H. Направленный мутагенез известных вариантов NS5A, ассоциированных с резистентностью, показал, что заменами, указывающими на >100-кратное сокращение чувствительности к велпатасвиру, являются М28G, A92K и Y93H/N/R/W в генотипе 1a, A92K в генотипе 1b, C92T и Y93H/N в генотипе 2b, Y93H в генотипе 3, а также L31V и P32A/L/Q/R в генотипе 6. Отдельные замены, исследованные в генотипах 2a, 4a или 5a, не указывали на >100-кратное снижение чувствительности к велпатасвиру. Комбинации этих вариантов часто указывали на более выраженное снижение чувствительности к велпатасвиру, чем отдельные варианты, ассоциированные с резистентностью.
В клинических исследованиях
Пациенты без цирроза и пациенты с компенсированным циррозом. В объединенном анализе пациентов без цирроза и с компенсированным циррозом, получавших препарат Эпклюза® в течение 12 недель в ходе трех исследований фазы 3, 12 пациентов (2 с генотипом 1 и 10 с генотипом 3) были квалифицированы как подходящие для анализа резистентности ввиду вирусологической неудачи. Ни у одного из пациентов с ВГС генотипов 2, 4, 5 или 6 не развилась вирусологическая неудача.
В обоих случаях вирусологической неудачи при генотипе 1 ВГС были выявлены варианты NS5A, ассоциированные с резистентностью: один с заменой Y93N, другой с L31I/V и Y93H. У обоих пациентов исходно варианты NS5A, ассоциированные с резистентностью, не выявлялись. Варианты, ассоциированные с резистентностью к нуклеозидному ингибитору NS5B, у этих 2 пациентов на момент вирусологической неудачи выявлены не были.
Из 10 пациентов с генотипом 3 и вирусологической неудачей Y93H выявили у всех 10 пациентов на момент неудачи, у 4 пациентов Y93H также обнаруживался исходно. Варианты, ассоциированные с резистентностью к нуклеозидному ингибитору NS5B, на момент неудачи не были выявлены ни у одного из 10 пациентов.
Пациенты с декомпенсированным циррозом. В ходе одного из исследований фазы 3 у пациентов с декомпенсированным циррозом, получавших препарат Эпклюза® + рибавирин (РБВ) в течение 12 недель, 3 пациента (1 с генотипом 1 и 2 с генотипом 3), были квалифицированы как подходящие для анализа резистентности ввиду вирусологической неудачи. Ни у одного из пациентов с генотипом 2 или 4 ВГС при лечении препаратом Эпклюза® + РБВ в течение 12 недель не развилась вирусологическая неудача. Из 3 пациентов 2 пациента с генотипом 3 имели вариант Y93H в NS5A, ассоциированный с резистентностью, возникший на момент неудачи, и у другого пациента был вариант Y93H исходно и на момент вирусологической неудачи, а также на момент неудачи были выявлены на низком уровне (<5%) варианты N142T и E237G, ассоциированные с резистентностью к нуклеозидному ингибитору NS5B. Анализ фармакокинетики у этого пациента указывал на отсутствие приверженности к лечению.
В данном исследовании у 2 пациентов, получавших лечение препаратом Эпклюза® в течение 12 или 24 недель без РБВ, наряду с L159F развился вариант NS5B S282T на низком уровне (<5%).
Влияние исходных уровней вариантов вируса гепатита С, ассоциированных с резистентностью, на результат лечения
Пациенты без цирроза и с компенсированным циррозом. Из 1035 пациентов, получавших лечение софосбувиром/велпатасвиром в трех клинических исследованиях фазы 3, 1023 пациента были включены в анализ вариантов NS5A, ассоциированных с резистентностью. У 380 из 1023 пациентов (37%) исходно имелись варианты NS5A, ассоциированные с резистентностью. У пациентов, инфицированных ВГС генотипов 2, 4 и 6, варианты NS5A, ассоциированные с резистентностью, встречались чаще (70, 63 и 52% соответственно), чем у пациентов с генотипом 1 (23%), генотипом 3 (16%) и генотипом 5 (18%) ВГС.
Присутствующие исходно варианты, ассоциированные с резистентностью, не оказывали существенного воздействия на частоту достижения устойчивого вирусологического ответа (УВО12) у пациентов с генотипами 1, 2, 4, 5 и 6 ВГС. Пациенты, инфицированные ВГС генотипа 3, исходно с вариантом Y93H в NS5A, связанным с резистентностью NS5A, реже достигали УВО12 в сравнении с пациентами без Y93H после лечения препаратом Эпклюза® в течение 12 нед (84,0% в сравнении с 96,4%).
Дети. Наличие вариантов NS5A и NS5B, ассоциированных с резистентностью, не оказывало влияния на исход лечения. Все пациенты, имевшие исходно варианты, ассоциированные с резистентностью к NS5A или нуклеозидному ингибитору NS5B, достигли УВО через 12 недель лечения препаратом Эпклюза®.
Перекрестная резистентность
Данные in vitro предполагают, что большинство вариантов NS5A, ассоциированных с резистентностью, которая указывает на устойчивость к ледипасвиру и даклатасвиру, оставались чувствительными к велпатасвиру. Велпатасвир был полностью активен при замене S282T в NS5B, ассоциированной с резистентностью к софосбувиру, в то время как все велпатасвир-резистентные замены в NS5A были полностью чувствительны к софосбувиру. Софосбувир и велпатасвир были в полной степени активны против замен, связанных с резистентностью к другим классам препаратов прямого противовирусного действия с разными механизмами действия, например к ненуклеозидным ингибиторам NS5B и ингибиторам протеазы NS3. Эффективность препарата Эпклюза® не оценивалась у пациентов, с предшествующей неудачей лечения другими схемами, включающими ингибитор NS5A.
Дети
Эффективность применения комбинации велпатасвир/софосбувир в течение 12 недель у детей от 12 и <18 лет, инфицированных ВГС генотипов 1, 2, 3, 4 или 6, оценивалась в открытом клиническом исследовании фазы 2, включавшем 102 пациента с ВГС.
В общей сложности 80 пациентов (78%) ранее не получали противовирусную терапию, а 22 пациента (22%) имели опыт лечения. Средний возраст составлял 15 лет (от 12 до 17 лет); 51% пациентов были женского пола; 73% были европеоидной расы, 9% — афроамериканцы, 11% — азиатского происхождения; 14% были испаноговорящие/латиноамериканского происхождения; средний индекс массы тела составлял 22,7 кг/м2 (в диапазоне от 12,9 до 48,9 кг/м2); 58% исходно имели уровень РНК ВГС, превышающий или равный 800000 МЕ/мл; соотношение пациентов с генотипами 1, 2, 3, 4 или 6 ВГС составляло 74, 6, 12, 2 и 6% соответственно; ни один пациент не имел установленный цирроз печени. Большинство пациентов (89%) были инфицированы путем вертикальной передачи.
Общая частота УВО составила 95% (97/102): 93% (71/76) у пациентов с инфекцией ВГС генотипа 1 и 100% у пациентов с ВГС генотипа 2 (6/6), генотипа 3 (12/12), генотипа 4 (2/2) и генотипа 6 (6/6). У одного пациента, который раньше прекратил лечение, на 4-й неделе развился рецидив; другие четыре пациента, которые не достигли УВО12, не соответствовали критериям вирусологической неудачи (например, потеря из-под наблюдения).
Фармакокинетика
Всасывание. Фармакокинетические свойства софосбувира, основного циркулирующего неактивного метаболита софосбувира (GS-331007) и велпатасвира оценивались у здоровых добровольцев, а также у пациентов с хроническим гепатитом C. После приема препарата Эпклюза® внутрь софосбувир быстро всасывается, и средняя Cmax в плазме крови наблюдается через 1 ч после приема дозы. Средние Cmax неактивного метаболита (GS-331007) в плазме крови наблюдаются через 3 ч после приема дозы. Средние Cmax велпатасвира наблюдаются через 3 ч после приема дозы.
По результатам популяционных фармакокинетических исследований, у пациентов, инфицированных ВГС, в равновесном состоянии значения AUC0–24 софосбувира (n=982), неактивного метаболита (GS-331007) (n=1428) и велпатасвира (n=1425) составили 1260, 1397 и 2970 нг·ч/мл соответственно. Значения Cmax софосбувира, неактивного метаболита (GS-331007) и велпатасвира в равновесном состоянии составили 566, 868 и 259 нг/мл соответственно. AUC0–24 и Cmax софосбувира и неактивного метаболита (GS-331007) были аналогичными у здоровых взрослых и пациентов с инфекцией ВГС. Относительно здоровых субъектов (n=331) показатели AUC0–24 и Cmax велпатасвира были соответственно на 37 и 41% ниже у пациентов, инфицированных ВГС.
Влияние приема пищи. Прием однократной дозы препарата Эпклюза® с умеренно жирной пищей (~600 ккал, 30% жира) или с пищей повышенной жирности (~800 ккал, 50% жира) приводил к повышению AUC0–inf велпатасвира на 34 и 21% соответственно и к повышению Cmax на 31 и 5% соответственно, по сравнению с приемом препарата натощак. Пища с умеренным или высоким содержанием жира повышала значение AUC0–inf софосбувира на 60 и 78% соответственно, однако не оказывала существенного влияния на Cmax софосбувира. Пища с умеренным или высоким содержанием жира не изменяла значение AUC0–inf неактивного метаболита (GS–331007), но приводила к снижению значения Cmax на 25 и 37% соответственно. Процент отклика в исследовании фазы 3 был одинаковым у пациентов, инфицированных ВГС, принимавших препарат Эпклюза® вместе с приемом пищи или в другое время. Препарат Эпклюза® может приниматься независимо от приема пищи.
Распределение. Степень связывания софосбувира с белками плазмы крови человека составляет 61–65%. Связывание происходит независимо от концентрации лекарственного препарата в диапазоне от 1 до 20 мкг/мл. Связывание неактивного метаболита (GS-331007) с белками плазмы крови человека было минимальным. После однократного приема дозы 400 мг (14C)-софосбувира у здоровых добровольцев, коэффициент соотношения (14C)-радиоактивности крови и плазмы составил приблизительно 0,7.
Степень связывания велпатасвира с белками плазмы крови человека составляет >99,5%. Связывание происходит независимо от концентрации лекарственного препарата в диапазоне от 0,09 до 1,8 мкг/мл. После однократного приема дозы 100 мг (14C)-велпатасвира у здоровых добровольцев коэффициент соотношения (14C)-радиоактивности крови и плазмы был в диапазоне от 0,52 до 0,67.
Биотрансформация. Софосбувир метаболизируется преимущественно в печени с образованием фармакологически активного нуклеозидного аналога трифосфата GS-461203. Метаболический путь активации включает последовательный гидролиз эфира карбоновой кислоты, который катализируется катепсином А человека или карбоксилэстеразой-1, и расщепление фосфорамидата нуклеотид-связывающим белком 1 с гистидиновыми триадами с последующим фосфорилированием в процессе биосинтеза пиримидинового нуклеотида. Дефосфорилирование приводит к образованию нуклеозидного неактивного метаболита (GS-331007), который не поддается эффективному рефосфорилированию, не обладает действием против ВГС in vitro. Софосбувир и неактивный метаболит (GS-331007) не являются субстратами или ингибиторами UGT1A1 или изоферментов CYP3A4, CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19 и CYP2D6. После приема однократной дозы 400 мг (14C)-софосбувира внутрь доля неактивного метаболита (GS-331007) составляет приблизительно >90% от общей системной экспозиции.
Велпатасвир является субстратом изоферментов CYP2B6, CYP2C8 и CYP3A4 с медленным оборотом. При приеме однократной дозы в 100 мг (14C)-велпатасвира бóльшая часть (>98%) радиоактивности в плазме крови приходилась на исходную субстанцию препарата.
Моногидроксилированный и дезметилированный велпатасвир — метаболиты, идентифицированные в плазме крови человека. Неизменный велпатасвир является основной субстанцией, присутствующей в кале.
Выведение. После однократного приема внутрь (14C)-софосбувира в дозе 400 мг средняя величина общего выведения радиоактивности (14C) составила более 92%, из которой приблизительно 80, 14 и 2,5% выводилось с мочой, калом и выдыхаемым воздухом соответственно. Бóльшую часть дозы софосбувира, выводимой с мочой, составлял неактивный метаболит (GS-331007) (78%), и лишь 3,5% выводилось в неизмененном виде. Эти данные показывают, что почечный клиренс является основным путем выведения неактивного метаболита (GS-331007). Средний терминальный период полувыведения (T1/2) софосбувира и неактивного метаболита (GS-331007) после приема препарата Эпклюза® составил 0,5 и 25 ч соответственно.
После однократного приема внутрь (14C)-велпатасвира в дозе 100 мг средняя величина общего выведения радиоактивности (14C) составила 95%, из которой приблизительно 94 и 0,4% выводилось с калом и мочой соответственно. Неизменный велпатасвир являлся основной субстанцией, присутствовавшей в кале, из расчета около 77% от принятой дозы, с дальнейшим образованием моногидроксилированного велпатасвира (5,9%) и дезметилированного велпатасвира (3,0%). Эти данные указывают на то, что экскреция исходной субстанции препарата с желчью является основным путем выведения велпатасвира. Средний терминальный T1/2 велпатасвира после приема препарата Эпклюза® составляет около 15 ч.
Линейность/нелинейность. Значение AUC велпатасвира повышается приблизительно пропорционально принятой дозе в диапазоне доз от 25 до 150 мг. Значение AUC софосбувира и неактивного метаболита (GS-331007) приблизительно пропорциональны принятой дозе в диапазоне доз от 200 до 1200 мг.
Вероятность лекарственного взаимодействия софосбувира/велпатасвира in vitro. Софосбувир и велпатасвир являются субстратами транспортеров препаратов Р-гликопротеина (P-gp) и белка резистентности рака молочной железы (BCRP), а неактивный метаболит (GS-331007) — нет. Велпатасвир также является субстратом OATP1B. В исследовании in vitro наблюдали медленный метаболический оборот велпатасвира посредством изоферментов CYP2B6, CYP2C8 и CYP3A4.
Велпатасвир является ингибитором транспортера P-gp, BCRP, OATP1B1 и OATP1B3, и его участие во взаимодействии препаратов с этими транспортерами прежде всего ограничивается процессом абсорбции. При клинически значимой концентрации в плазме велпатасвир не ингибирует печеночный белок-транспортер солей желчных кислот (BSEP), котранспортерный белок натрия таурохолата (NTCP), OATP2B1, OATP1A2 или переносчики органических катионов (OCT1) и почечных транспортеров OCT2, OAT1, OAT3, белок множественной лекарственной резистентности (MRP2) или белок экструзии лекарственных препаратов и токсинов (MATE1) или изоферменты системы цитохрома P450 или уридинглюкуронозилтрансферазы (UGT) 1A1.
Софосбувир и неактивный метаболит (GS-331007) не являются ингибиторами транспортеров P-gp, BCRP, MRP2, BSEP, OATP1B1, OATP1B3 и OCT1. Неактивный метаболит (GS-331007) не является ингибитором OAT1, OCT2 и MATE1.
Особые группы пациентов
Пол и раса. Расовая принадлежность или пол не оказывают клинически значимого эффекта на фармакокинетику софосбувира, неактивного метаболита (GS-331007) или велпатасвира.
Пожилые пациенты. На основании популяционного анализа фармакокинетики у пациентов, инфицированных ВГС, в диапазоне от 18 до 82 лет, возраст не оказывает клинически значимого эффекта на экспозицию софосбувира, неактивного метаболита (GS-331007) или велпатасвира.
Пациенты с почечной недостаточностью. Влияние почечной недостаточности различной степени тяжести на экспозицию компонентов препарата Эпклюза® по сравнению с экспозицией у пациентов с нормальной функцией почек (как описано ниже) суммировано в таблице 1.
Таблица 1
Влияние почечной недостаточности различной степени тяжести на экспозицию (AUC) софосбувира, его метаболита GS-331007 и велпатасвира по сравнению с экспозицией у пациентов с нормальной функцией почек
| Компоненты | Пациенты без ВГС | Пациенты, инфицированные ВГС | |||||
| Почечная недостаточность легкой степени тяжести (рСКФ ≥50 и <80 мл/мин / 1,73 м2) | Почечная недостаточность средней степени тяжести (рСКФ ≥30 и <50 мл/мин / 1,73 м2) | Почечная недостаточность тяжелой степени (рСКФ <30 мл/мин / 1,73 м2) | Терминальная стадия почечной недостаточности, когда необходимо применение диализа | Почечная недостаточность тяжелой степени (рСКФ <30 мл/мин / 1,73 м2) | Терминальная стадия почечной недостаточности, когда необходимо применение диализа | ||
| Прием дозы препарата за 1 час до проведения диализа | Прием дозы препарата через 1 час после проведения диализа | ||||||
| Софосбувир | ↑ в 1,6 раза | ↑ в 2,1 раза | ↑ в 2,7 раза | ↑ в 1,3 раза | ↑ в 1,6 раза | ↑ в ~2 раза | ↑ в 1,8 раза |
| GS-331007 | ↑ в 1,6 раза | ↑ в 1,9 раза | ↑ в 5,5 раза | ↑ в ≥10 раз | ↑ в ≥20 раз | ↑ в ~7 раз | ↑ в 18 раз |
| Велпатасвир | — | — | ↑ в 1,5 раза | — | — | — | ↑ в 1,4 раза |
Фармакокинетика софосбувира изучалась после приема разовой дозы софосбувира 400 мг взрослыми пациентами, не инфицированными ВГС, с нарушением функции почек легкой (рСКФ≥50 и <80 мл/мин/1,73 м2), средней (рСКФ ≥30 и <50 мл/мин/1,73 м2) и тяжелой (рСКФ <30 мл/мин/1,73 м2) степени, а также у пациентов с терминальной стадией почечной недостаточности, которым необходимо проведение гемодиализа. Фармакокинетику софосбувира оценивали в сравнении с пациентами с нормальной функцией почек (рСКФ >80 мл/мин/1,73 м2). Неактивный метаболит GS-331007 эффективно выводился при гемодиализе с коэффициентом экстракции примерно 53%. После однократного приема 400 мг софосбувира при 4-часовом сеансе гемодиализа выводилось 18% принятой дозы софосбувира.
Фармакокинетика софосбувира и GS-331007 у пациентов, инфицированных ВГС, с почечной недостаточностью тяжелой степени, принимавших софосбувир в дозе 200 мг с рибавирином (n=10) или софосбувир в дозе 400 мг с рибавирином (n=10) в течение 24 недель или комбинацию ледипасвир/софосбувир в дозе 90 мг/400 мг в течение 12 недель (n=18) была сопоставима с фармакокинетикой у пациентов с почечной недостаточностью тяжелой степени, не инфицированных ВГС.
Фармакокинетика велпатасвира изучалась после приема разовой дозы велпатасвира 100 мг взрослыми пациентами, не инфицированными ВГС, с нарушением функции почек тяжелой степени (рСКФ <30 мл/мин по формуле Кокрофта-Голта).
Фармакокинетика велпатасвира, софосбувира и GS-331007 изучалась у пациентов, инфицированных ВГС, с терминальной стадией почечной недостаточности, когда необходимо проведение диализа, принимавших препарат Эпклюза® в течение 12 недель (n=59), и оценивалась в сравнении с пациентами без почечной недостаточности, принимавшими участие в клинических исследованиях велпатасвира/софосбувира 2/3-й фазы.
Пациенты с печеночной недостаточностью. Популяционные анализы фармакокинетики у взрослых пациентов, инфицированных ВГС, показали, что цирроз печени (включая декомпенсированный цирроз) не оказывает клинически значимого влияния на экспозицию софосбувира и неактивного метаболита (GS-331007).
Популяционные анализы фармакокинетики у взрослых пациентов, инфицированных ВГС, показали, что цирроз печени (включая декомпенсированный цирроз) не оказывает клинически значимого влияния на экспозицию велпатасвира (см. «Способ применения и дозы»).
Масса тела. На основании популяционных анализов фармакокинетики у взрослых, установлено, что масса тела не оказывает клинически существенного влияния на экспозицию софосбувира или велпатасвира.
Дети. Экспозиция велпатасвира, софосбувира и неактивного метаболита (GS-331007) у пациентов детского возраста от 12 лет и старше, принимавших препарат велпатасвир/софосбувир в дозе 100/400 мг внутрь один раз в день, была аналогична экспозиции у взрослых пациентов, принимавших препарат велпатасвир/софосбувир в дозе 100/400 мг внутрь один раз в день.
Фармакокинетика велпатасвира, софосбувира и неактивного метаболита (GS-331007) у детей в возрасте младше 12 лет с массой тела менее 30 кг не установлена.
Показания
Лечение хронического гепатита С (ХГС) у взрослых и подростков от 12 лет и старше или с массой тела не менее 30 кг с инфекцией ВГС генотипов 1, 2, 3, 4, 5 или 6.
Противопоказания
гиперчувствительность к действующим веществам или любому другому компоненту препарата;
беременность;
детский возраст до 12 лет или масса тела менее 30 кг;
пациентам, получающим сильные индукторы Р-гликопротеина или изоферментов цитохрома Р450 (CYP) (карбамазепин, фенобарбитал, фенитоин, рифампицин, рифабутин, зверобой продырявленный Hypericum perforatum).
С осторожностью
Пациентам с почечной недостаточностью тяжелой степени тяжести (рСКФ <30 мл/мин/1,73 м2) или с терминальной стадией почечной недостаточности, когда необходимо проведение гемодиализа (см. «Способ применения и дозы» и «Особые указания»).
Следует применять с осторожностью со следующими препаратами (см. «Взаимодействие» и «Особые указания»): дигоксин, дабигатрана этексилат, элвитегравир/кобицистат/эмтрицитабин/тенофовира дизопроксила фумарат или тенофовира дизопроксила фумарат и усиленный ингибитор протеазы ВИЧ.
Совместное применение не рекомендуется со следующими препаратами (см. «Взаимодействие» и «Особые указания»): лекарственные препараты, которые являются умеренными индукторами Р-gp или изоферментов CYP (например, эфавиренз, модафинил, окскарбазепин или рифапентин); ингибиторы протонной помпы (например, омепразол, лансопразол, рабепразол, пантопразол, эзомепразол).
Следует избегать совместного применения со следующими препаратами (см. «Взаимодействие» и «Особые указания»): другие лекарственные препараты, содержащими софосбувир; амиодарон.
Применение при беременности и кормлении грудью
Беременность
Нет достаточных данных (менее 300 исходов беременностей) о применении софосбувира, велпатасвира или препарата Эпклюза® во время беременности.
Софосбувир. Результаты доклинических исследований не обнаружили прямую или опосредованную репродуктивную токсичность.
Тем не менее нельзя полностью оценить действие предельных концентраций софосбувира у крыс и соотнести его с действием рекомендуемых клинических доз у человека.
Велпатасвир. Исследования на животных показали возможную связь с репродуктивной токсичностью. В качестве меры предосторожности применение препарата Эпклюза® в период беременности противопоказано.
Грудное вскармливание
Неизвестно, проникают ли софосбувир, метаболиты софосбувира или велпатасвир в грудное молоко человека. Имеющиеся данные по фармакокинетике у животных свидетельствуют о выделении велпатасвира и метаболитов софосбувира в грудное молоко. Нельзя исключить риск для новорожденного/младенца. Таким образом, препарат Эпклюза® не следует применять в период грудного вскармливания.
Влияние на репродуктивную функцию
Данные о влиянии препарата Эпклюза® на репродуктивную функцию у человека отсутствуют. Исследования применения софосбувира или велпатасвира на животных не выявили неблагоприятного влияния препарата на репродуктивную функцию.
Если рибавирин применяется совместно с препаратом Эпклюза®, следует обратить внимание на противопоказания, связанные с применением рибавирина во время беременности и кормления грудью (см. инструкцию по применению рибавирина для дополнительной информации).
Способ применения и дозы
Внутрь, независимо от приема пищи. Таблетку необходимо проглатывать целиком, запивая водой. Таблетки не рекомендуется разжевывать или разламывать из-за горького вкуса.
Лечение препаратом Эпклюза® должно начинаться и контролироваться врачом, имеющим опыт лечения ХГС.
1 табл. препарата Эпклюза® рекомендуется принимать 1 раз в сутки.
Таблица 2
Рекомендуемая продолжительность лечения у взрослых при всех генотипах ВГС
| Популяция взрослых пациентова | Продолжительность лечения |
| Пациенты без цирроза и пациенты с компенсированным циррозом | Эпклюза® в течение 12 нед Добавление рибавирина можно рассмотреть для пациентов, инфицированных ВГС генотипа 3, с компенсированным циррозом |
| Пациенты с декомпенсированным циррозом | Эпклюза® + РБВ в течение 12 нед |
a Включает пациентов, коинфицированных ВИЧ, и пациентов с рецидивом ВГС после трансплантации печени (см. «Особые указания»).
При использовании рибавирина в комбинации с препаратом Эпклюза® см. инструкцию по медицинскому применению РБВ для дополнительной информации. Рекомендуется принимать РБВ с едой, разделяя дозу препарата на два приема в день.
Таблица 3
Рекомендации по изменению дозы РБВ для совместного приема с препаратом Эпклюза® у взрослых пациентов с декомпенсированным циррозом печени
| Пациент | Прием РБВ |
| Класс В по классификации Чайлд-Пью-Туркотт (ЧПТ) цирроза печени у пациентов до трансплантации | 1000 мг в день для пациентов с массой тела <75 кг и 1200 мг для пациентов с массой тела ≥75 кг |
| Класс C по классификации Чайлд-Пью-Туркотт (ЧПТ) цирроза печени у пациентов до трансплантации | Начальная доза составляет 600 мг, но может быть увеличена до 1000 мг/1200 мг (1000 мг в день для пациентов с массой тела <75 кг и 1200 мг в день для пациентов с массой тела ≥75 кг) в случае хорошей переносимости. Если начальная доза не является хорошо переносимой, то следует уменьшить дозу в соответствии с клиническими показаниями на основании концентрации гемоглобина |
| Классы B или C по классификации Чайлд-Пью-Туркотт (ЧПТ) цирроза печени у пациентов после трансплантации |
В том случае, если РБВ применяется для взрослых пациентов, инфицированных ВГС генотипа 3 с компенсированным циррозом (до или после трансплантации), рекомендуемая доза рибавирина составляет 1000/1200 мг (1000 мг для взрослых пациентов с массой тела <75 кг и 1200 мг для взрослых пациентов с массой тела ≥75 кг).
Для изменения дозы РБВ необходимо ознакомиться с инструкцией по медицинскому применению лекарственного препарата, содержащего РБВ.
Пациентам следует знать, что в случае рвоты в течение 3 ч с момента приема препарата следует принять дополнительную таблетку препарата Эпклюза®. Если рвота возникла более чем через 3 ч после приема препарата, дополнительную таблетку препарата Эпклюза® принимать не нужно (см. «Фармакокинетика»).
Если опоздание в приеме препарата Эпклюза® составило менее 18 ч, пациенту следует принять очередную дозу как можно скорее, а затем продолжить обычный прием препарата. Если опоздание в приеме препарата Эпклюза® составило более 18 ч, пациенту следует подождать и прием следующей таблетки осуществить в обычное время. Пациенту не следует принимать двойную дозу препарата Эпклюза®.
Взрослые пациенты, с предшествующей неудачей лечения режимом, включающим NS5A. Можно рассмотреть схему терапии Эпклюза® + рибавирин в течение 24 нед (см. «Особые указания»).
Пожилые пациенты. Коррекция дозы для пациентов пожилого возраста не требуется (см. «Фармакокинетика»).
Почечная недостаточность. Для пациентов с легким или умеренным нарушением функции почек коррекция дозы препарата Эпклюза® не требуется. У пациентов с нарушением функции почек тяжелой степени (рСКФ <30 мл/мин/1,73 м2) или терминальной стадией почечной недостаточности, когда необходимо проведение гемодиализа, данные по безопасности ограничены. Препарат Эпклюза® можно назначать данным группам пациентов (коррекция дозы при этом не требуется) в тех случаях, когда другие возможные варианты терапии недоступны (см. «Фармакокинетика», «Побочные действия» и «Особые указания»).
Нарушение функции печени. Коррекция дозы препарата Эпклюза® не требуется у пациентов с легкими, средними и тяжелыми нарушениями функции печени (классы A, B или C по классификации Чайлд-Пью-Туркотт) (см. «Фармакокинетика»). Безопасность и эффективность препарата Эпклюза® оценивалась у пациентов с циррозом печени класса B по классификации Чайлд-Пью-Туркотт, но не у пациентов с циррозом класса С по классификации Чайлд-Пью-Туркотт (см. «Фармакокинетика», «Побочные действия» и «Особые указания»).
Дети. Рекомендуемая доза препарата Эпклюза® у подростков в возрасте от 12 лет и старше или с массой тела не менее 30 кг составляет одну таблетку (100 мг велпатасвира и 400 мг софосбувира) один раз в сутки внутрь, независимо от приема пищи, в течение 12 недель. Эффективность и безопасность применения препарата Эпклюза® у детей младше 12 лет или с массой тела менее 30 кг не установлена. Данные отсутствуют.
Побочные действия
Обзор профиля безопасности
На основании объединенных данных клинических исследований фазы 3, проведенных с участием пациентов, инфицированных ВГС генотипов 1, 2, 3, 4, 5 или 6, доля пациентов, которые окончательно прекратили лечение по причине нежелательных явлений, составила 0,2%, а доля пациентов, перенесших какие-либо тяжелые нежелательные явления, составила 3,2% для пациентов, получавших препарат Эпклюза® в течение 12 недель. В соответствии с данными клинических исследований, головная боль, усталость и тошнота являлись наиболее частыми нежелательными явлениями (частота возникновения ≥10%), связанными с лечением, и отмечались у пациентов, принимавших препарат Эпклюза® в течение 12 недель. Эти и другие нежелательные явления были отмечены с аналогичной частотой у пациентов, получавших плацебо, в сравнении с пациентами, принимавшими препарат Эпклюза®.
Табличное резюме нежелательных реакций
Оценка нежелательных реакций на фоне приема препарата Эпклюза® основана на данных по безопасности, полученных из клинических исследований и в рамках пострегистрационного применения. Все нежелательные реакции представлены ниже в Таблице 4 и распределены по классам систем органов и частоте. Частота определяется следующим образом: очень часто (≥1/10); часто (от ≥1/100 до <1/10); нечасто (от ≥1/1000 до <1/100); редко (≥1/10000 до <1/1000); очень редко (<1/10000).
Таблица 4
Нежелательные лекарственные реакции, идентифицированные при применении препарата Эпклюза®
| Частота | Нежелательная лекарственная реакция |
| Нарушения со стороны кожи и подкожных тканей: | |
| Часто | Сыпьа |
| Нечасто | Ангионевротический отека |
аНежелательная реакция, определенная в рамках пострегистрационного применения препарата, содержащего велпатасвир/софосбувир.
Пациенты с декомпенсированным циррозом
Профиль безопасности препарата Эпклюза® оценивался в ходе одного открытого исследования, в котором пациенты с циррозом печени класса B по классификации Чайлд-Пью-Туркотт принимали препарат Эпклюза® в течение 12 недель (n=90), Эпклюза® + РБВ в течение 12 недель (n=87) или Эпклюза® в течение 24 недель (n=90).
Наблюдавшиеся нежелательные явления соответствовали ожидаемым клиническим последствиям декомпенсированного заболевания печени или известному профилю токсичности рибавирина для пациентов, принимающих препарат Эпклюза® в сочетании с РБВ.
Среди 87 пациентов, получавших лечение с применением препарата Эпклюза® + РБВ в течение 12 недель, снижение гемоглобина до значения менее 10 и 8,5 г/дл во время лечения было отмечено у 23 и 7% пациентов соответственно. РБВ был отменен у 15% пациентов, принимавших препарат Эпклюза® + РБВ в течение 12 недель, вследствие нежелательных явлений.
Пациенты с почечной недостаточностью. Безопасность препарата Эпклюза® оценивалась в 12-недельном неконтролируемом клиническом исследовании, включавшем 59 пациентов с терминальной стадией почечной недостаточности, когда необходимо проведение диализа. В этих условиях экспозиция метаболита софосбувира GS-331007 увеличивалась в 20 раз, превышая уровни, при которых в доклинических исследованиях наблюдались нежелательные реакции. По результатам оценки этих ограниченных клинических данных по безопасности профиль нежелательных явлений и летальных исходов на фоне приема препарата практически не отличался от ожидаемого профиля у пациентов с терминальной стадией почечной недостаточности.
Дети. Оценка безопасности применения препарата Эпклюза® у подростков в возрасте от 12 лет и старше основывается на данных, полученных в открытом клиническом исследовании фазы 2, в котором принимало участие 102 пациента, принимавших велпатасвир/софосбувир в течение 12 недель. Наблюдаемые нежелательные реакции соответствовали тем, которые наблюдались в клинических исследованиях препарата Эпклюза® с участием взрослых.
Описание отдельных нежелательных реакций
Нарушения сердечного ритма. Наблюдались случаи тяжелой брадикардии и блокады сердца (в частности, атриовентрикулярной (АV) или синоатриальной блокады) при применении софосбувирсодержащих режимов в сочетании с амиодароном и/или другими препаратами, которые снижают частоту сердечных сокращений (см. «Взаимодействие» и «Особые указания»).
Нарушения со стороны кожи. Частота неизвестна — синдром Стивенса-Джонсона.
Взаимодействие
Поскольку препарат Эпклюза® содержит софосбувир и велпатасвир, при его приеме возможны любые случаи взаимодействия, обусловленные указанными действующими веществами по отдельности.
Возможное влияние препарата Эпклюза® на другие ЛС
Велпатасвир является ингибитором переносчика P-gp и BCRP, транспортного полипептида органических анионов (OATP) 1B1 и OATP1B3. Одновременное применение препарата Эпклюза® с лекарственными препаратами, представляющими собой субстраты указанных транспортеров, может повысить экспозицию таких лекарственных препаратов. См. таблицу 5, в которой приведены примеры взаимодействий с чувствительными субстратами P-gp (дигоксин), BCRP (розувастатин) и OATP (правастатин).
Возможное влияние других ЛС на препарат Эпклюза®
Велпатасвир и софосбувир являются субстратами переносчика активных веществ P-gp и BCRP. Велпатасвир также является субстратом транспортера препаратов OATP1B. В исследовании in vitro наблюдали медленный метаболический оборот велпатасвира посредством изоферментов CYP2B6, CYP2C8 и CYP3A4. Лекарственные препараты, являющиеся сильными индукторами P-gp или сильными индукторами изоферментов CYP2B6, CYP2C8 или CYP3A4 (например, карбамазепин, фенобарбитал и фенитоин, рифампицин, рифабутин, зверобой продырявленный (Hypericum perforatum), способны снизить концентрацию велпатасвира или софосбувира в плазме крови, что приводит к снижению терапевтического эффекта велпатасвира/софосбувира. Применение таких лекарственных препаратов с препаратом Эпклюза® противопоказано (см. «Противопоказания»). Лекарственные препараты, которые являются умеренными индукторами P-gp и/или изоферментов CYP (например, эфавиренз, модафинил, окскарбазепин или рифапентин), могут вызывать снижение концентрации велпатасвира или софосбувира в плазме крови, что может привести к ослаблению терапевтического эффекта препарата Эпклюза®. Совместное применение препарата Эпклюза® с такими лекарственными препаратами не рекомендуется (см. С осторожностью, «Особые указания»). Совместное применение с лекарственными препаратами, ингибирующими P-gp или BCRP, может повысить концентрации велпатасвира или софосбувира в плазме крови. Лекарственные препараты, ингибирующие OATP, CYP2B6, CYP2C8 или CYP3A4, могут повысить концентрацию велпатасвира в плазме крови. Клинически значимые взаимодействия лекарственных препаратов с препаратом Эпклюза®, опосредованные ингибиторами P-gp, BCRP, OATР или CYP450, не ожидаются. Препарат Эпклюза® может применяться совместно с ингибиторами P-gp, BCRP, OATР и изоферментов CYP.
Пациенты, получающие антагонисты витамина К
Поскольку при совместном применении с препаратом Эпклюза® может изменяться функция печени, рекомендуется тщательный мониторинг значений МНО.
Влияние противовирусных препаратов прямого действия на препараты, метаболизирующиеся в печени
Изменения функции печени при приеме противовирусных препаратов прямого действия могут оказывать влияние на фармакокинетику препаратов, метаболизирующихся в печени (например, иммуносупрессивных препаратов, таких как ингибиторы кальциневрина), в отношении выведения ВГС из организма.
Взаимодействие препарата Эпклюза® и других ЛС
В таблице 5 представлен список установленных или потенциально клинически значимых взаимодействий ЛС (90% ДИ геометрического среднего, рассчитанного методом наименьших квадратов, был без изменений — «↔», повысился — «↑», понизился — «↓» в сравнении с установленными граничными значениями). Описанные случаи взаимодействия ЛС основаны на исследованиях, проведенных с применением комбинации велпатасвир/софосбувир или велпатасвира и софосбувира как отдельных действующих веществ, или же существуют предпосылки для взаимодействия ЛС, обусловленных применением комбинации велпатасвир/софосбувир. В таблицу включены не все препараты.
Таблица 5
Взаимодействия между препаратом Эпклюза® и другими лекарственными препаратами
| Лекарственный препарат (терапевтическая группа)/возможный механизм взаимодействия | Влияние на концентрации лекарственного препарата. Среднее отношение (90% ДИ)a, b | Рекомендации по совместному применению с препаратом Эпклюза® | |||
| Активный компонент | Cmax | AUC | Cmin | ||
| СРЕДСТВА, СНИЖАЮЩИЕ КИСЛОТНОСТЬ | |||||
| Растворимость велпатасвира уменьшается с увеличением рН. ЛС, способные увеличивать рН в желудке, могут снизить концентрацию велпатасвира | |||||
| Антациды | |||||
| Например, алюминия или магния гидроксид; кальция карбонат (повышение рН желудка) |
Взаимодействие не исследовалось. Ожидается: ↔Софосбувир ↓Велпатасвир |
Рекомендуется сделать перерыв в 4 ч между приемом антацида и препарата Эпклюза® | |||
| Антагонисты H2-гистаминовых рецепторов | |||||
| Фамотидин (40 мг однократно)/велпатасвир/софосбувир (100/400 мг однократно)c Фамотидин одновременно с препаратом Эпклюза®d Циметидинe Низатидинe Ранитидинe (повышение pH желудка) |
Софосбувир | ↔ | ↔ | Антагонисты H2-рецепторов могут применяться одновременно или с временными интервалами с препаратом Эпклюза® в дозе, которая не превышает дозы, сопоставимые с фамотидином 40 мг, дважды в сутки | |
| Велпатасвир | ↓0,80 (0,70, 0,91) | ↓0,81 (0,71, 0,91) | |||
| Фамотидин (40 мг раз в сутки)/велпатасвир/софосбувир (100/400 мг однократно)c Фамотидин за 12 ч до препарата Эпклюза®d (повышение pH желудка) |
Софосбувир | ↓0,77 (0,68, 0,87) | ↓0,80 (0,73, 0,88) | ||
| Велпатасвир | ↔ | ↔ | |||
| Ингибиторы протонной помпы | |||||
| Омепразол (20 мг 1 раз в сутки)/велпатасвир/софосбувир (100/400 мг однократно, на голодный желудок)c Омепразол одновременно с препаратом Эпклюза®d Лансопразолe Рабепразолe Пантопразолe Эзомепразолe (повышение pH желудка) |
Софосбувир | ↓0,66 (0,55, 0,78) | ↓0,71 (0,60, 0,83) | Не рекомендуется принимать совместно с ингибиторами протонной помпы. В том случае, когда рассматривается совместный прием, препарат Эпклюза® необходимо принимать с едой, за 4 ч до ингибитора протонной помпы в максимальных дозах, сопоставимых с 20 мг омепразола | |
| Велпатасвир | ↓0,63 (0,50, 0,78) | ↓0,64 (0,52, 0,79) | |||
| Омепразол (20 мг 1 раз в сутки)/велпатасвир/софосбувир (100/400 мг однократно после еды)с Омепразол через 4 ч после приема препарата Эпклюза®d (повышение pH желудка) |
Софосбувир | ↓0,79 (0,68, 0,92) | ↔ | ||
| Велпатасвир | ↓0,67 (0,58, 0,78) | ↓0,74 (0,63, 0,86) | |||
| ПРОТИВОАРИТМИЧЕСКИЕ СРЕДСТВА | |||||
| Амиодарон | Неизвестен эффект на концентрации амиодарона, велпатасвира и софосбувира | Совместное применение амиодарона с софосбувир-содержащими режимами может приводить к развитию серьезной симптоматической брадикардии. Использовать только в случае отсутствия альтернативы. Рекомендуется тщательный мониторинг, если данный препарат применяется одновременно с препаратом Эпклюза® (см. разделы «Побочные действия» и «Особые указания») | |||
| Дигоксин
Дигоксин (0,25 мг однократно)f/велпатасвир (100 мг однократная доза) (ингибирование P-gp) |
Изучалось только взаимодействие с велпатасвиром. Ожидается: ↔Софосбувир Эффект, оказываемый на экспозицию велпатасвира не изучался. Ожидается: ↔Велпатасвир |
Одновременное применение препарата Эпклюза® с дигоксином может привести к повышению концентрации дигоксина. При совместном применении дигоксина с препаратом Эпклюза® следует соблюдать осторожность, и рекомендуется регулярный контроль терапевтической концентрации дигоксина | |||
| Наблюдается Дигоксин |
↑1,90 (1,70, 2,10) | ↑1,30 (1,10, 1,60) | |||
| АНТИКОАГУЛЯНТЫ | |||||
| Дабигатрана этексилат
(ингибирование P-gp) |
Взаимодействие не исследовалось. Ожидается: ↑Дабигатран ↔Софосбувир ↔Велпатасвир |
При совместном применении дабигатрана этексилата с препаратом Эпклюза® рекомендуется проводить клинический мониторинг с целью обнаружения признаков кровотечения и анемии. Анализ на свертываемость крови помогает выявить пациентов с повышенным риском кровотечения в связи с усилением воздействия дабигатрана | |||
| Антагонисты витамина К | Взаимодействие не исследовалось | При использовании совместно с любым антагонистом витамина К требуется тщательный мониторинг МНО. Это связано с изменением функции печени во время лечения препаратом Эпклюза® | |||
| ПРОТИВОСУДОРОЖНЫЕ ПРЕПАРАТЫ | |||||
| Фенитоин Фенобарбитал (индукция P-gp и изоферментов системы цитохрома) |
Взаимодействие не исследовалось. Ожидается: ↓Софосбувир ↓Велпатасвир |
Препарат Эпклюза® противопоказан одновременно с фенобарбиталом и фенитоином (см. «Противопоказания») | |||
| Карбамазепин
(индукция P-gp и изоферментов системы цитохрома) |
Взаимодействие не исследовалось. Ожидается: ↓ Велпатасвир |
Препарат Эпклюза® противопоказан одновременно с карбамазепином (см.«Противопоказания») | |||
| Наблюдается: Софосбувир |
↓ 0,52 (0,43, 0,62) | ↓0,52 (0,46, 0,59) | |||
| Окскарбазепин
(Индукция P-gp и изоферментов системы цитохрома) |
Взаимодействие не исследовалось. Ожидается: ↓ Софосбувир ↓Велпатасвир |
Ожидается, что совместное применение препарата Эпклюза® с окскарбазепином может понижать концентрацию софосбувира и велпатасвира, что приведет к снижению терапевтического эффекта препарата Эпклюза®. Одновременный прием не рекомендуется (см. «Особые указания») | |||
| ПРОТИВОГРИБКОВЫЕ СРЕДСТВА | |||||
| Кетоконазол | Изучалось только взаимодействие с велпатасвиром. Ожидается: ↔ Софосбувир |
Корректировка дозы препарата Эпклюза® или кетоконазола не требуется | |||
| Кетоконазол (200 мг 2 раза в сутки) / Велпатасвир (100 мг однократно)d
(Ингибирование P-gp и изоферментов системы цитохрома) Итраконазолe |
Эффект на экспозицию кетоконазола не исследовался. Ожидается: ↔ Кетоконазол |
||||
| Наблюдается: Велпатасвир |
↑1,30 (1,00, 1,60) | ↑1,70 (1,40, 2,20) | |||
| АНТИМИКОБАКТЕРИАЛЬНЫЕ СРЕДСТВА | |||||
| Рифампицин (600 мг 1 раз в сутки)/ Софосбувир (400 мг однократно)d
(Индукция P-gp и изоферментов системы цитохрома) |
Эффект, оказываемый на экспозицию рифампицина, не изучался. Ожидается: ↔Рифампицин |
Совместное применение препарата Эпклюза® с рифампицином противопоказано (см. «Противопоказания») | |||
| Наблюдается: Софосбувир |
↓0,23 (0,19, 0,29) | ↓0,28 (0,24, 0,32) | |||
| Рифампицин (600 мг 1 раз в сутки) / Велпатасвир (100 мг однократно) (Индукция P-gp и изоферментов системы цитохрома) |
Эффект, оказываемый на экспозицию рифампицина, не изучался. Ожидается: ↔Рифампицин |
||||
| Наблюдается: Велпатасвир |
↓0,29 (0,23, 0,37) | ↓0,18 (0,15, 0,22) | |||
| Рифабутин (Индукция P-gp и изоферментов системы цитохрома) |
Взаимодействие не исследовалось Ожидается: ↓ Велпатасвир |
Совместное применение препарата Эпклюза® с рифабутином противопоказано (см. «Противопоказания») | |||
| Наблюдается: Софосбувир |
↓0,64 (0,53, 0,77) | ↓0,76 (0,63, 0,91) | |||
| Рифапентин
(Индукция P-gp и изоферментов системы цитохрома) |
Взаимодействие не исследовалось. Ожидается: ↓ Софосбувир ↓ Велпатасвир |
Ожидается, что совместное применение препарата Эпклюза® с рифапентином может снижать концентрацию софосбувира и велпатасвира, что приведет к снижению терапевтического эффекта препарата Эпклюза®. Одновременный прием не рекомендуется (см.«Особые указания») | |||
| ПРОТИВОВИРУСНЫЕ ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ ВИЧ: ИНГИБИТОРЫ ОБРАТНОЙ ТРАНСКРИПТАЗЫ | |||||
| Тенофовира дизопроксила фумарат | Препарат Эпклюза® продемонстрировал повышение экспозиции тенофовира (ингибирование P-gp). Повышение экспозиции тенофовира (AUC и Cmax) составило около 40–80% во время совместного применения препарата Эпклюза® и тенофовира дизопроксила фумарат/эмтрицитабина в различных схемах лечения ВИЧ. Пациенты, получающие одновременно тенофовира дизопроксила фумарат и препарат Эпклюза®, должны подвергаться мониторингу на выявление нежелательных реакций, связанных с тенофовира дизопроксила фумаратом. См. инструкцию по медицинскому применению препаратов, содержащих тенофовира дизопроксила фумарат, для получения рекомендаций по мониторингу функции почек (см. «Особые указания») |
||||
| Эфавиренз/эмтрицитабин/тенофовира дизопроксила фумарат (600/200/300 мг 1 раз в сутки)/велпатасвир/софосбувир (100/400 мг 1 раз в сутки)c, d | Эфавиренз | ↔ | ↔ | ↔ | Совместное применение препарата Эпклюза® с препаратом эфавиренз/эмтрицитабин/тенофовира дизопроксила фумарат ожидаемо снизит концентрацию велпатасвира. Совместное применение препарата Эпклюза® в схемах, содержащих эфавиренз, не рекомендуется (см. «Особые указания») |
| Софосбувир | ↑1,4 (1,1, 1,7 | ↔ | |||
| Велпатасвир | ↓0,53 (0,43, 0,64) | ↓0,47 (0,39, 0,57) | ↓0,43 (0,36, 0,52) | ||
| Эмтрицитабин/рилпивирин/тенофовира дизопроксила фумарат (200/25/300 мг 1 раз в сутки)
/велпатасвир/софосбувир (100/400 мг 1 раз в сутки)c, d |
Рилпивирин | ↔ | ↔ | ↔ | Корректировка дозы препарата Эпклюза® или эмтрицитабина/рилпивирина/тенофовира дизопроксила фумарата не требуется |
| Софосбувир | ↔ | ↔ | |||
| Велпатасвир | ↔ | ↔ | ↔ | ||
| ПРОТИВОВИРУСНЫЕ ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ ВИЧ: ИНГИБИТОРЫ ПРОТЕАЗЫ ВИЧ | |||||
| Атазанавир, усиленный ритонавиром (300/100 мг 1 раз в сутки) + эмтрицитабин/тенофовира дизопроксила фумарат (200/300 мг 1 раз в сутки) Велпатасвир/софосбувир (100/400 мг 1 раз/сутки)c, d |
Атазанавир | ↔ | ↔ | ↑1,40 (1,20, 1,60) | Корректировка дозы препарата Эпклюза®, атазанавира (усиленного ритонавиром) или эмтрицитабина/тенофовира дизопроксила фумарата не требуется |
| Ритонавир | ↔ | ↑1,30 (1,50, 1,40) | |||
| Софосбувир | ↔ | ↔ | |||
| Велтапасвир | ↑1,60 (1,40, 1,70) | ↑2,40 (2,20, 2,60) | ↑4,0 (3,60, 4,50) | ||
| Дарунавир, усиленный ритонавиром (800/100 мг 1 раз в сутки) + эмтрицитабин/тенофовира дизопроксила фумарат (200/300 мг 1 раз в сутки)/ Велпатасвир/софосбувир (100/400 мг 1 раз в сутки)c, d |
Дарунавир | ↔ | ↔ | ↔ | Корректировка дозы препарата Эпклюза®, дарунавира (усиленного ритонавиром) или эмтрицитабина/тенофовира дизопроксила фумарата не требуется |
| Ритонавир | ↔ | ↔ | ↔ | ||
| Софосбувир | ↓0,62 (0,54, 0,71) | ↓0,72 (0,66, 0,8) | |||
| Велпатасвир | ↓0,76 (0,65, 0,89) | ↔ | ↔ | ||
| Лопинавир, усиленный ритонавиром (4×200 мг/50 мг 1 раз в сутки + эмтрицитабин/тенофовира дизопроксила фумарат (200/300 мг 1 раз в сутки) Велпатасвир/софосбувир (100/400 мг 1 раз в сутки)c, d |
Лопинавир | ↔ | ↔ | ↔ | Корректировка дозы препарата Эпклюза®, лопинавира (усиленного ритонавиром) или эмтрицитабина/тенофовира дизопроксила фумарата не требуется |
| Ритонавир | ↔ | ↔ | ↔ | ||
| Софосбувир | ↓0,59 (0,49, 0,71) | ↓0,7 (0,6, 0,8) | |||
| Велпатасвир | ↓0,7 (0,59, 0,83) | ↔ | ↑ 1,6 (1,4, 1,9) | ||
| ПРОТИВОВИРУСНЫЕ ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ ВИЧ: ИНГИБИТОРЫ ИНТЕГРАЗЫ | |||||
| Ралтегравир (400 мг 2 раза в сутки)g + эмтрицитабин/тенофовира дизопроксила фумарат (200/300 мг 1 раз в сутки) Велпатасвир/софосбувир (100/400 мг 1 раз в сутки)c, d |
Ралтегравир | ↔ | ↔ | ↓0,79 (0,42, 1,50) | Корректировка дозы препарата Эпклюза®, ралтегравира или эмтрицитабина/тенофовира дизопроксила фумарата не требуется |
| Софосбувир | ↔ | ↔ | |||
| Велпатасвир | ↔ | ↔ | ↔ | ||
| Элвитегравир/кобицистат/эмтрицитабин/тенофовира алафенамида фумарат (150/150/200/10 мг 1 раз в сутки)
Велпатасвир/софосбувир (100/400 мг 1 раз в сутки)софосбувир/ велпатасвир (400/100 мг) 1 раз в сутки) c, d |
Элвитегравир | ↔ | ↔ | ↔ | Корректировка дозы препарата Эпклюза® или элвитегравира/кобицистата/эмтрицитабина/тенофовира алафенамида фумарата не требуется |
| Кобицистат | ↔ | ↔ | ↑2,0 (1,70, 2,50) | ||
| Тенофовира алафенамид | ↔ | ↔ | |||
| Софосбувир | ↔ | ↑1,40 (1,20, 1,50) | |||
| Велтапасвир | ↑1,30 (1,20, 1,50) | ↑1,50 (1,40, 1,70) | ↑1,60 (1,40, 1,80) | ||
| Элвитегравир/кобицистат/эмтрицитабин/тенофовира дизопроксила фумарат (150/150/200/300 мг 1 раз в сутки)/
Велпатасвир/софосбувир (400/100 мг) 1 раз в сутки) |
Элвитегравир | ↔ | ↔ | ↔ | Корректировка дозы препарата Эпклюза® или элвитегравира/кобицистата/эмтрицитабина/тенофовира дизопроксила фумарата не требуется |
| Кобицистат | ↔ | ↔ | ↑1,7 (1,5, 1,9) | ||
| Софосбувир | ↔ | ↔ | |||
| Велтапасвир | ↔ | ↔ | ↑1,4 (1,2, 1,5) | ||
| Долутегравир (50 мг 1 раз в сутки)/софосбувир/велтапасвир (400/100 мг 1 раз в сутки) | Долутегравир | ↔ | ↔ | ↔ | Корректировка дозы препарата Эпклюза® или долутегравира не требуется |
| Софосбувир | ↔ | ↔ | |||
| Велтапасвир | ↔ | ↔ | ↔ | ||
| ЛС РАСТИТЕЛЬНОГО ПРОИСХОЖДЕНИЯ | |||||
| Зверобой продырявленный
(Индукция P-gp и изоферментов системы цитохрома) |
Взаимодействие не исследовалось. Ожидается: ↓Софосбувир ↓Велтапасвир |
Совместное применение препарата Энклюза® со зверобоем продырявленным противопоказано (см. «Противопоказания») | |||
| ИНГИБИТОРЫ ГМГ-КоА-РЕДУКТАЗЫ | |||||
| Аторвастатин (40 мг однократно)/Велпатасвир/софосбувир (100 мг/ 400 мг 1 раз в сутки)d | Наблюдается: Аторвастатин |
↑1,70 (1,50, 1,90) |
↑1,50 (1,50,1,60) |
Корректировка дозы препарата Эпклюза® или аторвастатина не требуется | |
| Розувастатин | Изучалось только взаимодействие с велпатасвиром. Ожидается: ↔Софосбувир |
Совместное применение препарата Эпклюза® и розувастатина может увеличить концентрацию розувастатина, и таким образом увеличить риск возникновения миопатии, включая рабдомиолиз. Розувастатин в дозе, не превышающей 10 мг, может применяться с препаратом Эпклюза® | |||
| Розувастатин (10 мг однократно)/ Велпатасвир (100 мг 1 раз в сутки)d (Ингибирование OATP1B и BCRP) |
Наблюдается Розувастатин |
↑2,60 (2,30, 2,90) | ↑2,70 (2,50, 2,90) | ||
| Эффект, оказываемый на воздействие велпатасвира, не изучался. Ожидается: ↔Велпатасвир |
|||||
| Правастатин | Изучалось только взаимодействие с велпатасвиром. Ожидается: ↔Софосбувир |
Корректировка дозы препарата Эпклюза® или правастатина не требуется | |||
| Правастатин (40 мг однократно)/ Велпатасвир (100 мг один раз в сутки)d (Ингибирование OATP1B) |
Наблюдается: Правастатин |
↑1,30 (1,10, 1,50) | ↑1,40 (1,20, 1,50) | ||
| Эффект, оказываемый на воздействие велпатасвира, не изучался Ожидается: ↔Велпатасвир |
|||||
| Другие статины | Ожидается: ↑Статины |
Взаимодействия с другими ингибиторами ГМГ-КоА- редуктазы не могут быть исключены. При совместном применении с препаратом Эпклюза® следует рассматривать уменьшение дозы статинов, также следует проводить тщательный мониторинг нежелательных реакций, связанных с приемом статинов | |||
| НАРКОТИЧЕСКИЕ АНАЛЬГЕТИКИ | |||||
| Метадон | Изучалось только взаимодействие с софосбувиром. Ожидается: ↔ Велпатасвир |
Корректировка дозы препарата Эпклюза® или метадона не требуется | |||
| Метадон (поддерживающая терапия метадоном (30–130 мг/сут)/ софосбувир (400 мг 1 раз в сутки)d | R-метадон | ↔ | ↔ | ↔ | |
| S-метадон | ↔ | ↔ | ↔ | ||
| Софосбувир | ↔ | ↑1,30 (1,00, 1,70) | |||
| ИММУНОДЕПРЕССАНТЫ | |||||
| Циклоспорин (600 мг однократно)/
Софосбувир (400 мг однократная доза)f |
Циклоспорин | ↔ | ↔ | Корректировка дозы препарата Эпклюза® или циклоспорина на момент начала совместного применения не требуется. В процессе лечения может потребоваться корректировка дозы циклоспорина и тщательный мониторинг | |
| Софосбувир | ↑2,50 (1,90, 3,50) | ↑4,50 (3,30, 6,30) | |||
| Циклоспорин (600 мг однократно)f/
Велпатасвир (100 мг однократно)d |
Циклоспорин | ↔ | ↓0,88 (0,78, 1,00) | ||
| Велпатасвир | ↑1,60 (1,20, 2,0) | ↑2,0 (1,50, 2,70) | |||
| Такролимус (5 мг однократно)f/ Софосбувир (400 мг однократно)d |
Такролимус | ↓0,73 (0,59, 0,90) | ↑1,10 (0,84, 1,40) | Корректировка дозы препарата Эпклюза® или такролимуса на момент начала совместного применения не требуется. В процессе лечения может потребоваться корректировка дозы такролимуса и тщательный мониторинг | |
| Софосбувир | ↓0,97 (0,65, 1,40) | ↑1,10 (0,81, 1,60) | |||
| Такролимус | Эффект, оказываемый на воздействие велпатасвира, не изучался. Ожидается: ↔Велпатасвир |
||||
| ПЕРОРАЛЬНЫЕ КОНТРАЦЕПТИВЫ | |||||
| Норгестимат/этинилэстрадиол (норгестимат 0,180 мг/ 0,215 мг/ 0,25 мг/этинилэстрадиол 0,025 мг)/ Софосбувир (400 мг раз в сутки)d |
Норэлгестромин | ↔ | ↔ | ↔ | Корректировка дозы пероральных контрацептивов не требуется |
| Норгестрел | ↔ | ↑1,20 (0,98, 1,50) | ↑1,20 (1,0, 1,50) | ||
| Этинилэстрадиол | ↔ | ↔ | ↔ | ||
| Норгестимат/этинилэстрадиол (норгестимат 0,180 мг/0,215 мг/0,25 мг/ этинилэстрадиол 0,025 мг)/ Велпатасвир (100 мг раз в сутки)d |
Норэлгестромин | ↔ | ↔ | ↔ | |
| Норгестрел | ↔ | ↔ | ↔ | ||
| Этинилэстрадиол | ↑1,40 (1,20, 1,70) | ↔ | ↓0,83 (0,65, 1,10) |
aСреднее соотношение (90% ДИ) фармакокинетики совместно принимаемого препарата с исследуемым лекарственным препаратом отдельно или в комбинации. Отсутствие эффекта = 1,00.
b Все исследования межлекарственных взаимодействий проводились с участием здоровых добровольцев.
cПринимаемый в составе препарата Эпклюза®.
dОтсутствие ограничений фармакокинетического взаимодействия составляет 70–143%.
e.Эти препараты относятся к классу, в котором представляется возможным предвидеть подобные случаи взаимодействия.
fПределы биоэквивалентности/эквивалентности составляют 80–125%.
gОтсутствие ограничений фармакокинетического взаимодействия составляет 50–200%.
Передозировка
Наибольшей документально зафиксированной дозой софосбувира и велпатасвира являлась однократная доза 1200 мг и однократная доза 500 мг соответственно. В исследованиях принимали участие взрослые здоровые добровольцы. При применении препарата в указанных дозах какого-либо неблагоприятного воздействия не отмечалось, а частота и тяжесть нежелательных явлений были аналогичны зарегистрированным в группах, получавших плацебо. Влияние более высоких доз неизвестно.
Специфический антидот на случай передозировки препарата Эпклюза® отсутствует. В случае передозировки следует контролировать состояние пациента на предмет выявления признаков интоксикации.
Лечение: проведение общих поддерживающих мероприятий, включая регулярный контроль основных физиологических показателей и наблюдение за клиническим состоянием пациента. Гемодиализ может способствовать эффективному выведению доминирующего циркулирующего метаболита софосбувира, GS-331007 (коэффициент экстракции 53%). Учитывая то, что велпатасвир в значительной степени связывается с белками, гемодиализ вряд ли приведет к существенному выведению велпатасвира.
Особые указания
Препарат Эпклюза® не следует одновременно применять с другими лекарственными препаратами, содержащими софосбувир.
Тяжелая брадикардия и блокада сердца (в частности, AV- или синоатриальная блокада). Наблюдались случаи жизнеугрожающей тяжелой брадикардии и блокады сердца (в частности, AV- или синоатриальной блокады) при применении софосбувир-содержащих режимов в сочетании с амиодароном. Брадикардия, как правило, возникала в течение нескольких часов или дней, но наблюдались также случаи с более длительным временем ее развития, в основном, до двух недель после начала лечения ВГС-инфекции.
Амиодарон должен применяться у пациентов, которые принимают препарат Эпклюза®, только в случае, если другие альтернативные антиаритмические виды лечения не переносятся или противопоказаны.
В случае, если сопутствующий прием амиодарона считается необходимым, рекомендуется проводить тщательный мониторинг сердечных показателей пациентов в условиях стационара в течение первых 48 ч после начала совместного применения препаратов. После этого сердечный ритм следует контролировать в амбулаторных условиях или самостоятельно пациентом на ежедневной основе в течение не менее двух недель лечения.
Ввиду продолжительного периода полувыведения амиодарона, мониторинг сердечных показателей также должен осуществляться у пациентов, которые прекратили прием амиодарона в течение последних нескольких месяцев и должны начать прием препарата Эпклюза®.
Всех пациентов, принимающих или недавно принимавших амиодарон, следует предупредить о симптомах брадикардии и блокады сердца (в частности, AV- или синоатриальной блокады) и порекомендовать незамедлительно обращаться за медицинской помощью в случае их возникновения.
Коинфекция ВГС/ВГВ (вирус гепатита В). Во время или после приема противовирусных препаратов прямого действия сообщалось о случаях повторной активации ВГВ, некоторые из которых приводили к летальным исходам. Скрининг на выявление ВГВ должен проводиться для всех пациентов перед началом лечения. Пациенты, имеющие сопутствующие коинфекции ВГС/ВГВ, имеют риск повторной активации ВГВ, поэтому их состояние следует отслеживать и контролировать в соответствии с действующими клиническими руководствами.
Пациенты с неудачей лечения по схеме, включающей NS5A. Клинические данные, подтверждающие эффективность софосбувира/велпатасвира для лечения пациентов, продемонстрировавших отсутствие результатов предыдущего лечения режимом, включающим другой ингибитор NS5A, отсутствуют. Тем не менее на основании вариантов, ассоциированных с резистентностью к NS5A, обычно наблюдавшихся у пациентов с неэффективностью предыдущего лечения, включающего другой ингибитор NS5A, фармакологии велпатасвира in vitro, а также результатов лечения в исследованиях фазы 3 с применением софосбувира/велпатасвира у пациентов, ранее не получавших лечение режимом, содержащим ингибитор NS5A и исходно имевших варианты, ассоциированные с резистентностью к NS5A, лечение препаратом Эпклюза® + РБВ в течение 24 недель может быть рассмотрено для пациентов с неудачей предыдущего лечения, включающего NS5A, и с высоким риском прогрессирования клинического заболевания при отсутствии альтернативных вариантов лечения.
Почечная недостаточность. Данные по безопасности применения препарата у пациентов с нарушением функции почек тяжелой степени (рСКФ <30 мл/мин/1,73 м2) и с терминальной стадией почечной недостаточности, когда необходимо проведение гемодиализа, ограничены. Препарат Эпклюза® можно назначать данным группам пациентов (коррекция дозы при этом не требуется) в тех случаях, когда другие возможные варианты терапии не доступны (см. «Фармакокинетика» и «Побочные действия»). При использовании препарата Эпклюза® в комбинации с РБВ у пациентов с Cl креатинина <50 мл/мин необходимо также ознакомиться с инструкцией по медицинскому применению РБВ (см. «Фармакокинетика»).
Применение совместно с умеренными индукторами P-gp и/или умеренными индукторами изоферментов цитохрома Р450. Лекарственные препараты, которые являются умеренными индукторами P-gp и/или умеренными индукторами изоферментов цитохрома P450 (например, эфавиренз, модафинил, окскарбазепин или рифапентин), могут снижать концентрации софосбувира или велпатасвира в плазме крови, что может привести к ослаблению терапевтического действия препарата Эпклюза®. Совместное применение препарата Эпклюза® с такими препаратами не рекомендуется (см. «Взаимодействие»).
Применение совместно с некоторыми схемами антиретровирусной терапии ВИЧ-инфекции. Препарат Эпклюза® увеличивает экспозицию тенофовира, особенно при совместном применении со схемой лечения ВИЧ, содержащей тенофовира дизопроксила фумарат и фармакокинетический усилитель (ритонавир или кобицистат). Безопасность тенофовира дизопроксила фумарата на фоне применения препарата Эпклюза® и фармакокинетического усилителя не установлена. Необходимо оценивать потенциальные риски и пользу, связанные с одновременным приемом препарата Эпклюза® и комбинированного препарата с фиксированными дозами, содержащего элвитегравир/кобицистат/эмтрицитабин/тенофовира дизопроксила фумарат или с приемом тенофовира дизопроксила фумарата совместно с усиленным ингибитором протеазы ВИЧ (например, атазанавиром или дарунавиром), особенно у пациентов с повышенным риском почечной дисфункции. Пациенты, принимающие препарат Эпклюза® совместно с такими препаратами, как элвитегравир/кобицистат/эмтрицитабин/тенофовира дизопроксила фумарат или тенофовира дизопроксила фумарат и усиленный ингибитор протеазы ВИЧ, должны наблюдаться на предмет возникновения нежелательных реакций, связанных с тенофовиром. Для ознакомления с рекомендациями по контролю функции почек см. инструкцию по медицинскому применению препаратов, в состав которых входят тенофовира дизопроксила фумарат, эмтрицитабин/тенофовира дизопроксила фумарат или элвитегравир/кобицистат/эмтрицитабин/тенофовира дизопроксила фумарат.
Применение у пациентов с сахарным диабетом. У пациентов с сахарным диабетом может отмечаться улучшение контроля глюкозы, что может приводить к симптоматической гипогликемии после начала лечения препаратами прямого противовирусного действия для лечения гепатита C. Следует тщательно контролировать уровень глюкозы у пациентов с сахарным диабетом, начинающих лечение препаратами прямого противовирусного действия, особенно в течение первых 3 месяцев, и при необходимости корректировать лекарственную терапию сахарного диабета. Врач, отвечающий за лечение пациента с сахарным диабетом, должен быть проинформирован о начале лечения гепатита С препаратами прямого противовирусного действия.
Цирроз класса С по классификации ЧПТ. Безопасность и эффективность препарата Эпклюза® не оценивалась у пациентов с циррозом класса С по классификации Чайлд-Пью-Туркотт (см. «Фармакокинетика» и «Побочные действия»).
Пациенты, перенесшие трансплантацию печени. Безопасность и эффективность препарата Эпклюза® у пациентов, инфицированных ВГС, перенесших трансплантацию печени, не оценивалась. При принятии решения относительно лечения с применением препарата Эпклюза® согласно рекомендуемому дозированию (см. «Способ применения и дозы») следует руководствоваться оценкой потенциальных рисков и пользы для каждого пациента.
Влияние на способность управлять транспортными средствами, механизмами. Препарат Эпклюза® не оказывает или оказывает умеренное влияние на способность управлять транспортными средствами и механизмами.
Форма выпуска
Таблетки, покрытые пленочной оболочкой, 100 мг + 400 мг. По 28 табл. во флаконе белого цвета, вместимостью 75 мл из ПЭВП, запаянном алюминиевой фольгой, укупоренном полипропиленовой крышкой с системой защиты от вскрытия детьми.
Свободное пространство флакона заполняют упаковочным материалом из полиэфирного волокна. По 1 флакону вместе с инструкцией по применению помещают в пачку картонную.
При вторичной упаковке препарата на ОАО «Фармстандарт-Лексредства». По 28 табл. во флаконе белого цвета, вместимостью 75 мл из ПЭВП, запаянном алюминиевой фольгой, укупоренном полипропиленовой крышкой с системой защиты от вскрытия детьми.
Свободное пространство флакона заполняют упаковочным материалом из полиэфирного волокна.
По 1 флакону вместе с инструкцией по применению помещают в пачку из картона с контролем первого вскрытия.
Производитель
Производство готовой лекарственной формы. Гилеад Сайенсиз Айелэнд ЮСи, Ирландия./Gilead Sciences Ireland UC, Ireland. IDA Business and Technology Park, Carrigtohill, Co. Cork, Ireland.
Патеон Инк., Канада/Patheon Inc., Canada, 2100 Syntex Court, Mississauga, Ontario, L5N 7K9, Canada.
Первичная упаковка. Гилеад Сайенсиз Айелэнд ЮСи, Ирландия/Gilead Sciences Ireland UC, Ireland, IDA Business and Technology Park, Carrigtohill, Co. Cork, Ireland.
Патеон Инк., Канада/Patheon Inc., Canada. 2100 Syntex Court, Mississauga, Ontario, L5N 7K9, Canada.
Выпускающий контроль качества. Гилеад Сайенсиз Айелэнд ЮСи, Ирландия/Gilead Sciences Ireland UC, Ireland, IDA Business and Technology Park, Carrigtohill, Co. Cork, Ireland.
Владелец регистрационного удостоверения. Гилеад Сайенсиз Интернешнл Лтд., Великобритания/Gilead Sciences International Ltd, UK, Flowers Вuilding, Granta Park, Great Abington, Cambridge, CB21 6GT, UK.
Получить дополнительную информацию о препарате, а также направить свои претензии и информацию о нежелательных явлениях можно по адресу. ООО «Гилеад Сайенсиз Раша». Российская Федерация, 125196, Москва, ул. Лесная, 9.
Тел.: (495) 139-95-00.
e-mail: drugsafety.russia@gilead.com
При вторичной упаковке препарата на ОАО «Фармстандарт-Лексредства»
Производство готовой лекарственной формы. Гилеад Сайенсиз Айелэнд ЮСи, Ирландия/Gilead Sciences Ireland UC, Ireland. IDA Business and Technology Park, Carrigtohill, Co. Cork, Ireland.
Патеон Инк., Канада/Patheon Inc., Canada. 2100 Syntex Court, Mississauga, Ontario, L5N 7K9, Canada.
Первичная упаковка. Гилеад Сайенсиз Айелэнд ЮСи, Ирландия/Gilead Sciences Ireland UC, Ireland. IDA Business and Technology Park, Carrigtohill, Co. Cork, Ireland.
Патеон Инк., Канада/Patheon Inc., Canada 2100 Syntex Court, Mississauga, Ontario, L5N 7K9, Canada.
Вторичная упаковка, выпускающий контроль качества. Открытое акционерное общество «Фармстандарт-Лексредства» (ОАО «Фармстандарт-Лексредства»). 305022, Россия, Курская обл., г. Курск, ул. 2-я Агрегатная, д. 1а/18.
Организация, принимающая претензии потребителей. Открытое акционерное общество «Фармстандарт-Лексредства» (ОАО «Фармстандарт-Лексредства»). 305022, Россия, Курская обл., г. Курск, ул. 2-я Агрегатная, д. 1а/18.
Тел./факс: (4712) 34-03-13.
www.pharmstd.ru
Условия отпуска из аптек
По рецепту.
RU-EPC-0344-02-2023
Условия хранения
При температуре не выше 30 °C.
Хранить в недоступном для детей месте.
Срок годности
4 года.
Не применять по истечении срока годности, указанного на упаковке.
МНН: Софосбувир+Велпатасвир
Производитель: Natco Pharma Limited
Анатомо-терапевтическо-химическая классификация: Противовирусные препараты для лечения ВИЧ инфекции
Номер регистрации в РК:
РК-ЛС-5№024329
Информация о регистрации в РК:
09.10.2019 — 09.02.2024
- Скачать инструкцию медикамента
Торговое название
Велпанат
Международное непатентованное название
Нет
Лекарственная форма
Таблетки,
покрытые пленочной оболочкой, 400 мг/100 мг
Состав
Одна
таблетка содержит:
активные
вещества —
софосбувира 400,0 мг
велпатасвира 100,0 мг
вспомогательные
вещества: целлюлоза
микрокристаллическая, натрия кроскармеллоза, магния стеарат;
состав
оболочки: опадрай
II
синий 85F505153
(поливиниловый спирт, титана диоксид (Е 171), полиэтиленгликоль,
тальк, FD&C
синий#1/Бриллиантовый синий FCF
алюминиевый лак (Е 133)),
вода очищенная.
Описание
Таблетки
овальной формы, покрытые пленочной
оболочкой голубого
цвета, с маркировкой «S»
на одной стороне и «V»
на другой стороне
.
Фармакотерапевтическая группа
Противоинфекционные
препараты для системного применения. Противовирусные препараты для
системного применения. Противовирусные препараты прямого действия.
Противовирусные препараты для лечения вирусного гепатита С.
Код
АТХ J05AР
Фармакологические свойства
Фармакокинетика
Абсорбция
При
пероральном приеме софосбувира и велпатасвира, софосбувир всасывается
быстрее и средний пик концентрации препарата в плазме крови
составляет 1 час после приема. Средним пиком концентрации
велпатасвира является 3 часа после перорального приема.
Распределение
Софосбувир
приблизительно на 61-65% связывается с белками плазмы крови человека
и это связывание не зависит от концентрации лекарственного препарата
в диапазоне от 1 мкг/мл до 20 мкг/мл.
Неактивный
метаболит (GS-331007) в минимальной степени связывается с белками
плазмы крови человека.
Велпатасвир
связывается с белками плазмы крови больше чем на 99.5%, связывание не
зависит от концентрации препарата в пределах от 0.09 мкг/мл до 1.8
мкг/мл.
Биотрансформация
Софосбувир
интенсивно метаболизируется в печени образуя форму фармакологически
активного нуклеозидного аналога трифосфат
GS-461203. Путь метаболической активизации
включает в себя последовательный гидролиз части сложного эфира
карбоновой кислоты, катализируемый человеческим катепсином А (CatA)
или карбоксилэстеразой 1 (CES1) и расщеплением фосфорамидата с
помощью нуклеотид-связывающего белка 1 с гистидиновыми триадами
(HINT1), с последующим фосфорилированием по пути биосинтеза
пиримидиновых нуклеотидов. Велпатасвир
является субстратом CYP2B6, CYP2C8 и CYP3A4 с медленным оборотом.
Выведение
из организма
После
однократного перорального приема 400 мг – софосбувира, среднее
общее выведение радиоактивной дозы составляет более 92%, при этом
приблизительно 80%, 14% и 2,5% выводятся почками, кишечником и
легкими соответственно. Большая часть дозы софосбувира, выводимая
почками, представляет собой неактивный метаболит (GS-331007) 78%,
тогда как 3,5% выводится в виде софосбувира. Средний период
полувыведения софосбувира и неактивного метаболита (GS-331007)
составляет 0,4 часа и 27 часов соответственно.
После
однократного применения 100 мг — велпатасвира перорально, среднее
восстановление дозы составляет более 95%, выведение почками примерно
94% и кишечником 0,4 %. Билиарная
экскреция исходного лекарственного средства является основным путем
выведения из организма велпатасвира. Средний окончательный период
полувыведения велпатасвира при применении софосбувира и велпатасвира
составляет приблизительно 15 часов.
Фармакодинамика
Механизм
действия
Софосбувир
является пан-генотипическим ингибитором РНК-зависимой РНК-полимеразы
ВГС (вируса гепатита С) NS5B (неструктурного белка), которая
необходима для репликации вируса. Софосбувир представляет собой
нуклеотидное пролекарство, которое подвергается внутриклеточному
метаболизму с образованием фармакологически активного аналога уридина
трифосфата (GS-461203). С помощью NS5B-полимеразы GS-461203 может
встраиваться в строящуюся цепочку РНК ВГС и таким образом вызывать
обрыв цепи.
Велпатасвир
является ингибитором ВГС, соединенным с белком NS5A ВГС, который
необходим как для репликации РНК, так и для сборки вирионов ВГС.
Антивирусная
активность
В
исследованиях с использованием репликонов ВГС значения
эффективной концентрации (ЕС50) софосбувира и велпатасвира против
полноразмерных репликонов генотипов 1a, 1b, 2a, 3a и 4a, составили
0.04, 0.11, 0.05, 0.05 и 0.04 мкмоль, соответственно, а значения ЕС50
софосбувира и велпатасвира против химерных репликонов генотипа 1b,
несущих последовательности NS5B из клинических изолятов, генотипа 2b,
5а или 6а, составили 0,014 — 0,015 мкмоль. Среднее значение ЕС50±SD
софосбувира и велпатасвира в отношении химерных репликонов, несущих
последовательности NS5B из клинических изолятов, составило 0,068 ±
0,024 мкмоль для генотипа 1а, 0,11 ± 0,029 мкмоль для генотипа
1b, 0,035 ± 0,018 мкмоль для генотипа 2 и 0,085 ± 0,034
мкмоль для генотипа 3а. Противовирусная активность софосбувира и
велпатасвира в in vitro в
отношении менее часто встречаемых генотипов 4, 5 и 6 была аналогична
активности софосбувира и велпатасвира в отношении генотипов 1, 2 и
3.
Резистентность
В
культуре клеток
В
культуре клеток исследовались репликоны ВСГ нескольких генотипов,
включая 1b, 2a, 2b, 3а, 4а, 5а и 6а, со сниженной чувствительностью к
cофосбувиру.
Пониженная
чувствительность к софосбувиру ассоциировалась с первичной мутацией
S282T в NS5B всех исследованных генотипов репликонов ВГС (lb, 2а, 2b,
За, 4а, 5а и 6а). Сайт — направленный мутагенез подтвердил, что
мутация S282T в репликонах 8 генотипов ответственна за снижение в
2-18 раз чувствительности к софосбувиру и уменьшение способности
вируса к репликации на 89-99% по сравнению с соответствующим вирусом
дикого типа. Рекомбинантная NS5B полимераза из генотипов lb, 2а, За и
4а, экспрессирующая замену S282T, продемонстрировала пониженную
чувствительность к активному метаболиту софосбувира (GS-461203) по
сравнению с аналогичными полимеразами диких штаммов вируса.
Выбор
in
vitro
репликонов ВГС с пониженной восприимчивостью к велпатасвиру
проводился в клеточной культуре для множественных генотипов, включая
1a, 1b, 2a, 3a, 4a, 5a и 6a. Варианты были выбраны на стойких к NS5A
позициях 24, 28, 30, 31, 32, 58, 92 и 93. Сопоставимые по
сопротивлению варианты (ССВ), выбранные из 2 или более генотипов,
были F28S, L31I/V и Y93H.
Сайт-направленный
мутагенез известных NSVA ССВ показал, что замещения, приписывающие >
100-кратное снижение восприимчивости велпатасвира представляют собой
M28G, A92K и Y93H / N / R / W в генотипе 1a, A92K в генотипе 1b, C92T
и Y93H / N в генотипе 2b , Y93H в генотипе 3 и L31V и P32A / L / Q /
R в генотипе 6. Никакие индивидуальные замены, протестированные в
генотипах 2a, 4a или 5a, не давали > 100-кратного снижения
восприимчивости велпатасвира. Комбинации этих вариантов часто
демонстрировали большее снижение восприимчивости к велпатасвиру, чем
одиночные ССВ.
Перекрестная
резистентность
Данные
in
vitro
свидетельствуют о том, что большинство ССВ NS5A, которые вызывают
устойчивость к ледипасвиру и даклатасвиру, остаются восприимчивыми к
велпатасвиру. Велпатасвир
был
активен против софосбувир-резистентной замены S282T в NS5B, тогда как
все связанные с велпатасвир-резистентными заменами в NS5A были
полностью восприимчивы к софосбувиру. Софосбувир и велпатасвир были
полностью активны в отношении замещений, связанных с резистентностью
к другим классам противовирусных препаратов прямого действия с
различными механизмами действий, такими как NSKB-ненуклеозидные
ингибиторы и ингибиторы NS3-протеазы.
Показания к применению
—
лечение хронического вирусного гепатита С в составе противовирусной
комбинированной терапии у взрослых.
Способ применения и дозы
Лечение
должен назначать врач с опытом лечения хронического гепатита С.
Принимать
внутрь, 1 таблетку Велпаната
один раз в сутки, во время еды или после. Таблетку необходимо
проглатывать целиком, запивая водой. Не желательно разжевывать или
разламывать, имеет
горький вкус.
Таблица 1:
Рекомендуемое лечение и продолжительность для всех генотипов вируса
гепатита С
|
Популяция |
Лечение и |
|
Пациенты без |
Препараты
Добавление |
|
Пациенты с |
Софосбувир и |
a.
Включает пациентов, одновременно инфицированных вирусом
иммунодефицита человека (ВИЧ), и пациентов с рецидивирующей
трансплантацией печени после вируса гепатита С.
Коррекция
дозы
Таблица 2:
Рекомендации по дозированию рибавирина при применении с софосбувиром
и велпатасвиром пациентам с декомпенсированным циррозом
|
Пациент |
Доза |
|
Чайлд-Пью-Туркотта |
1000 |
|
CPT
CPT цирроза |
Начальная |
Если
рибавирин принимается инфицированными пациентами с генотипом 3 и
компенсированным циррозом (до или после трансплантации),
рекомендуемая доза рибавирина составляет 1000/1200 мг (1000 мг для
пациентов весом <75 кг и 1200 мг для пациентов весом> 75 кг).
Пациентов
следует предупредить, что если в течение 3 часов после дозирования
возникает рвота, следует принять дополнительную таблетку Велпаната.
Если рвота происходит более чем через 3 часа после применения
препарата, дальнейшая доза Велпаната не требуется.
Если
время применения Велпаната
было
пропущено в течение 18 часов, следует принять таблетку как можно
скорее. Следующая таблетка принимается в обычное время.
Если
опоздание в приеме составило более 18 ч (интервал с момента приема
последней таблетки больше 42 ч), то следует пропустить и принять дозу
Велпаната в обычное время.
Не
следует применять двойную дозу Велпаната.
Пациенты
пожилого возраста
У
пациентов пожилого возраста коррекция дозы не требуется.
Нарушение
функции почек
Для пациентов
с легкой или умеренной почечной недостаточностью не требуется
коррекция дозы софосбувира и велпатасвира. Безопасность и
эффективность софосбувира и велпатасвира не оценивалась у пациентов с
тяжелой почечной недостаточностью (расчетная скорость клубочковой
фильтрации рСКФ] <30 мл / мин / 1,73 м2) или терминальной
хронической почечной недостаточностью (ТХПН), требующая гемодиализа.
Нарушение функции
печени
Не
требуется коррекция дозы софосбувира и велпатасвира у пациентов с
легкой, умеренной или тяжелой печеночной недостаточностью (Класс A, B
или C по шкале Чайлда—Пью). Безопасность и эффективность
софосбувира и велпатасвира оценивались у пациентов с циррозом класса
B, но не у пациентов с циррозом класса C по шкале Чайлда—Пью.
Пациенты
детского возраста
Безопасность
и эффективность софосбувира и велпатасвира у детей и подростков в
возрасте до 18 лет еще не установлены. Данные отсутствуют.
Побочные действия
—
головные боли, усталость и тошнота
—
в комбинации с рибавирином возможно снижение содержания гемоглобина.
Описание
отдельных побочных реакций.
Сердечные
аритмии
Случаи
тяжелой брадикардии и блокады сердца наблюдались, когда софосбувир и
велпатасвир, использовались в сочетании с амиодароном и / или другими
лекарственными средствами, снижающими частоту сердечных сокращений.
Противопоказания
—
повышенная чувствительность к софосбувиру и велпатасвиру или любому
другому компоненту препарата.
Лекарственные взаимодействия
Использование
с антиаритмическими средствами.
Амиодарон
следует применять с софосбувиром и велпатасвиром только когда другие
альтернативные антиаритмические методы лечения не переносятся или
противопоказаны. Если одновременное использование амиодарона
считается необходимым, рекомендуется проходить курс под тщательным
наблюдением врача.
Из-за
длительного периода полувыведения амиодарона, пациентам прекратившим
его применение в течение нескольких месяцев, перед началом курса
софосбувира и велпатасвира необходимо пройти обследование.
Использование
с мощными гликопротеинами и индукторами цитохрома.
Совместное
применение с лекарственными средствами, которые являются мощными
P-гликопротеинами (P-gp) или мощными индукторами цитохрома P450 (CYP)
(рифампицин, рифабутин, зверобой (Hypericum perforatum),
карбамазепин, фенобарбитал и фенитоин) значительно снизят
концентрацию софосбувира и велпатасвира в плазме и могут привести к
потере эффективности софосбувира и велпатасвира.
Велпатасвир
является ингибитором транспортера P-гликопротеина и белка
резистентности рака молочной железы (БРРМЖ),
транспортным полипептидом органических анионов ТПОА1B1 и ТПОА1B3.
Совместное применение софосбувира и велпатасвира с лекарственными
препаратами, которые являются субстратами этих транспортеров, могут
увеличить воздействие на эти лекарственные препараты. В таблице 3
приведены примеры взаимодействий с чувствительными субстратами
P-гликопротеином (дигоксин), БРРМЖ (розувастатин) и ТПОА
(правастатин).
Таблица
3: Взаимодействие софосбувира и велпатасвира с другими лекарственными
препаратами
|
Лекарственный |
Влияние |
Рекомендация |
|||
|
Активный |
Cmax |
AUC |
Cmin |
||
|
ВЕЩЕСТВА, |
|||||
|
Растворимость |
|||||
|
Антациды |
|||||
|
например, |
Взаимодействие Ожидаемо. ↔ ↓ |
Рекомендуется |
|||
|
Антагонист |
|||||
|
Фамотидин
(разовая |
Софосбувир |
↔ |
↔ |
Антагонист |
|
|
Фамотидин
Циметидин
(Увеличение |
Велпатасвир |
↓ (0.70, 0.91) |
↓ (0.71, 0.91) |
||
|
Фамотидин
(разовая |
Софосбувир |
↓ 0,77 (0.68, 0.87) |
↓ 0,80 (0.73, 0.88) |
||
|
Фамотидин
(Увеличение |
Велпатасвир |
↔ |
↔ |
||
|
Ингибиторы |
|||||
|
Омепразол
(20 |
Софосбувир |
↓ (0.55, 0.78) |
↓ (0.60, 0.83) |
Совместный |
|
|
Омепразол
Лансопразол |
Велпатасвир |
↓ 0.63 (0.50, 0.78) |
↓ 0.64 (0.52, 0.79) |
||
|
Омепразол
(20
Омепразол |
Софосбувир |
↓ (0.68, 0.92) |
↔ |
||
|
Велпатасвир |
↓ (0.58, 0.78) |
↓ (0.63, 0.86) |
|||
|
АНТИАРИТМИЧЕСКИЕ |
|||||
|
Амиодарон |
Взаимодействие
Влияние |
Допустимо |
|||
|
Дигоксин |
Изучено Ожидаемо: ↔ Софосбувир |
Совместное |
|||
|
Дигоксин
(Ингибирование |
Эффект Ожидаемо: ↔ |
||||
|
Наблюдается: Дигоксин |
↑ (1.7, 2.1) |
↑ (1.1, 1.6) |
|
ПРОТИВОСУДОРОЖНЫЕ |
|||||
|
Карбамазепин
(Индукция |
Взаимодействие Ожидаемо: ↓ Софосбувир ↓ Велпатасвир |
Таблетки |
|||
|
Окскарбазепин
(Индукция |
Взаимодействие Ожидаемо: ↓ Софосбувир ↓ Велпатасвир |
Ожидается,
и |
|||
|
ПРОТИВОГРИБКОВЫЕ |
|||||
|
Кетоконазол |
Взаимодействие Ожидаемо: ↔ Софосбувир |
Корректировка |
|||
|
ПРОТИВОТУБЕРКУЛЕЗНЫЕ |
|||||
|
Рифампицин
Индукция |
Влияние Ожидаемо: ↔ Рифампицин |
Противопоказано |
|||
|
Наблюдается: Софосбувир |
↓ 0.23 (0.19, 0.29) |
↓ 0.28 (0.24, 0.32) |
|||
|
Рифампицин
(Индукция |
Влияние Ожидаемо: ↔ Рифампицин |
||||
|
Наблюдается: Велпатасвир |
↓ 0.29 (0.23, 0.37) |
↓ 0.18 (0.15, 0.22) |
|||
|
Рифабутин
(Индукция |
Взаимодействие Ожидаемо: ↓ Софосбувир ↓ Велпатасвир |
Противопоказано
Ожидается, |
|||
|
ПРЕПАРАТЫ, |
|||||
|
Тенофовир
Фумарат |
Доказано, |
||||
|
Софосбувир |
↔ |
↔ |
|||
|
Велпатасвир |
↔ |
↔ |
↔ |
||
|
Софосбувир |
↔ |
↔ |
|||
|
Велпатасвир |
↔ |
↔ |
↔ |
||
|
РАСТИТЕЛЬНЫЕ |
|||||
|
Зверобой |
Взаимодействие Ожидаемо: ↓ Софосбувир ↓ Велпатасвир |
Прием |
|||
|
3-ГИДРОКСИ-3-МЕТИЛГЛЮТАРИЛ-КОФЕРМЕНТ |
|||||
|
Розувастатин |
Взаимодействие Ожидаемо: ↔ Софосбувир |
Одновременное
Розувастатин |
|||
|
Розувастатин |
Наблюдается: Розувастин |
↑ 2.6 (2.3, 2.9) |
↑ 2.7 (2.5, 2.9) |
а.
Среднее соотношение (90% ДИ) совместно назначаемой фармакокинетики
лекарственных препаратов отдельно или в сочетании. Без эффекта =
1,00.
б.
Все исследования взаимодействия проводились у здоровых добровольцев.
в.
Вводится в качестве софосбувира и таблетки велпатасвира
г.
Отсутствие взаимодействия фармакокинетики 70-143%.
д.
Это лекарственные средства в классе, где подобные проявления могут
быть предсказаны.
е.
Граница биоэквивалентности / эквивалентности 80-125%.
ж.
Отсутствие фармакокинетического взаимодействия ограничивает 50-200%.
Особые указания
Софосбувир
и велпатасвир не следует применять одновременно с другими
лекарственными препаратами, содержащими софосбувир.
Цирроз
класса С по шкале Чайлда—Пью.
Безопасность
и эффективность софосбувира и велпатасвира не оценивалась у пациентов
с циррозом класса C по шкале Чайлда—Пью.
Пациенты,
перенесшие трансплантацию печени
Безопасность
и эффективность софосбувира и велпатасвира не оценивали при лечении
вируса гепатита С у пациентов, перенесших трансплантацию печени.
Лечение на основе софосбувира и велпатасвира в соответствии с
рекомендациями по дозировке должно основываться на оценке
потенциальных преимуществ и рисков для отдельного пациента.
Беременность
и период лактации
Препарат
противопоказан при беременности и во время лактации.
Дети
Не
рекомендуется применять детям и подросткам до 18
лет.
Передозировка
Самые
высокие задокументированные дозы софосбувира и велпатасвира были
представлены разовой дозой 1200 мг и разовой дозой 500 мг,
соответственно. В этих исследованиях у здоровых добровольцев не было
никаких негативных эффектов, наблюдаемых на этих уровнях дозы.
Эффекты более высоких доз / экспозиции неизвестны.
Лечение
передозировки софосбувиром и велпатасвиром заключается в общих
вспомогательных мерах, включая контроль жизненно важных симптомов, а
также наблюдение за клиническим статусом пациента.
Форма выпуска и упаковка
По
28 таблеток во флаконе из полиэтилена высокой плотности, с
закручивающейся крышкой.
Флакон вместе с инструкцией по медицинскому применению на
государственном и русском языках вкладывают в картонную коробку.
Условия хранения
В
защищенном от света месте, при температуре не выше 30 0С.
Хранить
в недоступном для детей месте!
Срок хранения
2
года
Не
применять по истечении срока годности.
Условия отпуска из аптек
По
рецепту
Производитель
Natco
Pharma Limited
Kothur-509228
Rangareddy
District
Telangana,
Индия.
Держатель
регистрационного удостоверения
Представительство
«APC
Healthcare
Limited»,
Республика Казахстан
Наименование,
адрес и контактные данные (телефон, факс, электронная почта)
организации на территории Республики Казахстан, принимающей претензии
(предложения) по качеству лекарственных средств от потребителей и
ответственной за пострегистрационное наблюдение за безопасностью
лекарственного средств:
Представительство
«APC
Healthcare
Limited»
050040,
г. Алматы, ул. Попова 19, офис 301
Тел:
(8727) 260-84-33, факс: (8727) 386-82-25
E—mail:
rahulsingh@apchealthcare.com
| ИМП_Велпанат_109862.doc | 0.16 кб |
| Велпанат_каз_ок_13.08_.19_.doc | 0.19 кб |
Отправить прикрепленные файлы на почту
Дата публикации 16 октября 2017Обновлено 14 февраля 2022
Определение болезни. Причины заболевания
Вирусный гепатит С — острое или хроническое инфекционное заболевание, вызываемое различными типами вируса гепатита С, которые поражают в основном гепатоциты (клетки печени) и вызывают развитие воспалительного процесса в печени. При сочетании ряда факторов, образа жизни и отсутствии адекватного лечения вирусы гепатита С приводят к цирротической перестройке ткани и раку печени (гепатоцеллюлярной карциноме).
Краткое содержание статьи — в видео:
Этиологический агент — вирус гепатита С (ВГС). Вирус был впервые выделен американскими учёными в 1989 году.
Таксономическая структура:
- царство — вирусы
- семейство — Flaviviridae
- род — Hepacivirus
- вид — вирус гепатита С (hepatitis C virus, HCV) — 7 генотипов и 67 подтипов
Этиологические и морфологические свойства вируса
Диаметр вириона (вирусной частицы) — 50 нанометров. Имеет внешнюю белково-липидную оболочку. Оболочка вирусной частицы образуется в том числе за счёт взаимодействия вируса с липопротеидами низкой плотности хозяина, что позволяет ему ускользать из под иммунной атаки и проникать в клетки.
Генетическая структура представляет собой линейную однонитевую молекулу рибонуклеиновой кислоты (РНК), её размер примерно 9400 нуклеотидов. В ней выделяют следующие зоны: шифрующие структурные (Е1 и Е2 белки) и неструктурные (функциональные) белки — NS2, NS3, NS4A, NS4B, NS5A, NS5B, отвечающие за различные функции в жизни вируса. Структурные белки определяют прямой цитопатический эффект (повреждение клеток), полиморфизм (многообразие) вируса, участвуют в эффекте проникновения и выхода из клетки. Неструктурные белки участвуют в процессе развития и размножения вируса, определяют развитие резистентности (устойчивости) к интерферонам (NS5A). Встраивания вирусной РНК в геном клеток человека не замечено.
Вирус неоднороден (есть его различные подвиды — генотипы). Это обусловлено тем, что скорость его репликации огромна (за сутки 1011-1012) и в результате возникает большое число ошибок — вирус быстро мутирует. Такие мутации позволяют вирусу ускользать от иммунного ответа человека и длительно находиться в организме, а также сопротивляться воздействию лекарственных препаратов. Основной резервуар вируса — это клетки печени, однако он способен размножаться и в клетках иммунной системы (макрофагах, моноцитах и др.).
В целом вирус малоустойчив в окружающей среде. Под воздействием хлороформа, спирта, хлоргексидина и других дезинфицирующих средств погибает практически мгновенно, инактивируется при температуре 100 °С за 2 минуты, при температуре 60 °С за 30 минут. При комнатной температуре живёт не более четырёх суток, под действием ультрафиолета погибает за 30 минут. В плазме, эритроцитарной массе и др. может сохраняться до года. На культурах клеток не культивируется, не имеет гемагглютинирующей (склеивающей эритроциты) и гемолитической (разрушающей эритроциты) активности [2][8][10][11].
Передача вируса гепатита С
Передача вируса осуществляется только через кровь. Инфицирующая доза в несколько десятков раз больше, чем при гепатите В, т. е. для заражения нужны видимые следы крови. А вот пути заражения бывают различны:
- употребление наркотиков;
- медицинские манипуляции (в том числе пирсинг, тату и др.);
- половой путь (незащищённый половой контакт, в среднем около 1,5 % в гетеросексуальной семье);
- от матери к ребёнку в родах;
- бытовой путь (использование общих бритв, ножниц, зубных щёток).
При поцелуях, рукопожатиях, через посуду, сухие пятна крови на одежде, через воду, при кашле, чихании, потении, сидении рядом, по воздуху и т. д. гепатит С не передаётся. Заразиться через грудное молоко также нельзя, но заражение возможно при попадании крови матери на повреждённые губы ребёнка. Есть незначительный риск при попадании инфицированной крови в глаза, однако это единичные случаи. Заразиться при переливании крови практически невозможно, т. к. кровь на гепатит С тестируют методом ПЦР (полимеразной цепной реакции) с высокой чувствительностью.
Нет никаких научных оснований ограничивать выбор профессии, работы и круг общения людей с гепатитом С — передача осуществляется только через кровь, поэтому ограничений в работе (например учителем, врачом, няней), контактах с родственниками и т. п. быть не должно.
Территориальное распределение
Гепатит С распространен во всем мире. Наиболее часто он встречается в Регионе ВОЗ Восточного Средиземноморья и Европейском регионе ВОЗ, где в 2015 г. распространенность HCV, по оценкам, составила соответственно 2,3% и 1,5%. Общее количество больных вирусным гепатитом С в мире не менее 150 млн, в Российской Федерации — неизвестно (по некоторым данным ориентировочное количество больных — не менее 2 млн человек). По состоянию на 2016 год в США было заражено не менее 2,4 млн человек (по другим данным — не менее 4 млн). По самым скромным подсчётам в этой стране в 2018 году от гепатита С умерли не менее 15 тыс. человек. В РФ превалирующее распространение имеют генотипы 1b и За, но частота их выявления может значительно колебаться в зависимости от региона [4][7][9].
В настоящее время вирусный гепатит С распространяется в общей популяции, т. е. заболеванию подвержены люди всех возрастов и социальных слоёв, однако наибольший риск имеют следующие категории:
- потребители инъекционных наркотиков;
- ВИЧ-инфицированные;
- пациенты отделений гемодиализа;
- лица, подвергшиеся трансплантации органов (в настоящее время менее значимо);
- медработники;
- дети, рождённые от матерей с гепатитом С;
- маргинальные слои общества, работники секс-индустрии.
После перенесённого острого вирусного гепатита С примерно 30 % людей самоизлечиваются, т. е. полностью избавляются от вируса, в остальных случаях формируется хронический гепатит. Предикторы (прогностические параметры) самоизлечения — желтуха, высокий уровень АЛТ, молодой возраст, женский пол, 1 генотип вируса, наличие гепатита В с HbsAg (антигеном вируса гепатита В). У каждого 5-25 человека из 100 в течение 10-20 лет от момента инфицирования при хронизации развивается цирроз печени и у них имеется 1-4 % годовой вероятности развития рака печени.
Провоцирующие факторы развития цирроза печени:
- мужской пол;
- возраст более 50 лет;
- злоупотребление алкоголем;
- коинфекция ВИЧ, гепатита В или стеатогепатита;
- иммуносупрессивная терапия.
Гепатитом С можно заразиться после выздоровления от предыдущего случая (даже тем же генотипом), можно заразиться другим генотипом, даже если человек уже имеет гепатит С какого-либо генотипа (суперинфекция). В этом случае наблюдается борьба между генотипами за доминирование. Побеждает, как правило, какой-то один, а другой может сохраняться на минимальных степенях репликации. При этом существует риск ошибки при определении генотипа.
Иммуногенность вируса слабая, т. е. антитела, которые должны вырабатываться в ответ на заражение, появляются медленно (не ранее чем через 3 недели от заражения) и не обладают явным вируснейтрализующим действием [2][4][8][9].
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы гепатита С
Скрытый (инкубационный) период гепатита С может составлять от 2 недель до 6 месяцев. В это время может не быть никаких признаков заражения и развивающегося заболевания. Однако коварство гепатита С в том, что даже по прошествии этого времени может не возникнуть никаких явных симптомов и проявлений (большинство больных вообще не имеет симптомов или их нельзя связать с гепатитом). Даже если симптомы и возникают, то зачастую они настолько незначительны, что человек абсолютно не придаёт им значения и не обращается за медицинской помощью до развития осложнений. Чаще всего информация о болезни появляется после прохождения рутинных исследований для операции или донорства крови.
Симптомы вирусного гепатита С в остром и хроническом периоде:
- снижение или отсутствие аппетита;
- общая слабость, ухудшение самочувствия, повышенная утомляемость, депрессия (один из основных симптомов);
- тошнота;
- тяжесть и дискомфорт в правом подреберье;
- боли в животе, небольшое расстройство пищеварения;
- боли в суставах;
- в редких случаях — пожелтение склер глаз, кожи, потемнение мочи или осветление кала.
Повышение температуры отмечается редко. Возможен различный характер течения хронического заболевания, в большинстве случаев на протяжении десятков лет больной испытывает незначительную усталость, периодический дискомфорт в правом подреберье, иногда связанный с погрешностями в диете. Примечательно, что чёткого продолжительного периода ухудшения самочувствия обычно нет. Лишь на завершающей стадии заболевания (через несколько десятков лет) человек испытывает резкое ухудшение самочувствия, нарастание отёков, в том числе у него наблюдается накопление жидкости в брюшной полости (асцит), повышенная кровоточивость, похудание, желтуха. Зачастую толчком к этому служит принятие алкоголя на праздники в значительных дозах. В этом коварство вирусного гепатита С — мнимый период благополучия даже при высокоактивном инфекционном процессе («ласковый убийца», как длительное время его называли).
Гепатит С у беременных
Каких-либо значимых различий в течении вирусного гепатита С при беременности нет, как правило, происходит даже минимизация клинических и лабораторных изменений. Риск заражения ребёнка имеется лишь в родах, причём чем выше количество вируса в мл крови (вирусная нагрузка), тем выше риск. Выбор способа родоразрешения может влиять на риск передачи вируса при высокой вирусной нагрузке (свыше 8 х 10^5 МЕ/мл): при естественных родах риск до 8 %, при плановом кесаревом сечении — до 1 % (некоторые исследователи не подтверждают это). При коинфекции ВИЧ у матери риск передачи значительно возрастает — до 15 %.
Гепатит С у детей
После рождения от матерей с гепатитом С у 100 % детей выявляются материнские антитела к вирусу до 18 месяцев в максимальном исчислении (это нормально). Если заражения не произошло, в течение этого срока антитела исчезают и у ребёнка больше не будет никаких следов контакта. Если происходит заражение, то уже через 1-2 месяца в крови будет выявляться вирусная РНК в ПЦР исследовании (требует повторения даже при первичном отрицательном результате). Как правило, течение гепатита у детей малоактивное и не приводит к выраженным изменениям печени и самочувствия до момента возможного современного лечения и выражается только периодическим повышением АЛТ/АСТ [2][3][8][9].
Патогенез гепатита С
Проникая в организм, вирус гепатита С не оставляет никаких следов в месте внедрения. С током крови он быстро попадает в клетки печени, где оказывает неярко выраженное прямое разрушающее действие на клетки-мишени и в большей степени вызывает иммуноопосредованное поражение клеток на фоне репликации вируса. При использовании одного из исследований — ультрачувствительного ПЦР (полимеразной цепной реакции) — РНК вируса в крови может обнаруживаться уже через 2 недели от момента заражения. Значений, которые выявляются всеми тест-системами, как правило, вирусная нагрузка достигает через 1,5 месяца после заражения.
Нарушается баланс продукции цитокинов (белков, которые оказывают комплексное регулирующее влияние на воспаление и иммунитет):
- усиливается выработка интерлейкинов IL-4 и IL-10 (сигнальных веществ, которые вырабатываются клетками иммунной системы и служат для регуляции активности других клеток);
- снижается образование интерферонов IL-2 (белков с противовирусной и иммуномодулирующей активностью);
- подавляется активация СD4+ лимфоцитов (клеток, которые отражают работу иммунной системы).
Возможность нахождения и размножения вируса в клетках иммунной и нервной систем делает его недоступным для иммунного контроля. Главенствующая частота перехода вирусного гепатита С в хроническую форму (около 70 %) обусловлена не только различными особенностями самого вируса, но и обязательным участием (или вернее неадекватным участием) иммунной системы:
- наличием внепечёночного размножения вируса (главным образом в моноцитарной системе);
- наличием множества генотипов с подтипами и частыми мутациями (перестановками составляющих генома вируса);
- запуском иммунопатологических реакций, которые участвуют и во внепечёночных поражениях при гепатите С, в том числе в клетках эндотелия сосудов головного мозга;
- низкой иммуногенностью вируса;
- участием в патогенезе процессов перекисного окисления липидов.
После заражения и малосимптомного протекания острой фазы заболевания при отсутствии самоизлечения (около 30 %) наступает хронизация инфекции — длительный латентный период (до 10-30 лет, иногда более длительно). В течение этого периода человек ведёт обычный образ жизни, не испытывает никаких явных признаков заболевания, а появляющееся чувство усталости вполне логично списывает на интенсивный современный ритм жизни.
Длительность латентного периода зависит от свойств вируса, его реактивности, развития иммунопатологических реакций иммунной системы, образа жизни человека и других факторов. Однако рано или поздно наступает переломный момент в системе взаимодействия патогенного микроорганизма и восприимчивого человеческого макроорганизма. Несмотря на широкие регенераторные возможности печени происходит нарушение её восстановительных сил. Вследствие постоянного некупируемого воспалительного процесса активная функциональная ткань печени замещается жировой и далее соединительной тканью (рубцовой). При этом нарушается нормальное функционирование органа и по механизму обратной связи происходит прогрессирующее ухудшение работы печени и жизнедеятельности организма в целом [2][4][10][11].
Классификация и стадии развития гепатита С
Острый вирусный гепатит С
Периоды:
- Инкубационный период — от 3 недель до 4-6 месяцев. Полное отсутствие симптоматики.
- Преджелтушный (продромальный) период — от 4 суток до 3 недель. Симптомы малозаметны, может быть депрессивное настроение, слабость, дискомфорт в животе, неустойчивый стул.
- Период паренхиматозного гепатита (желтушный) — от 1 до 3 недель. Бывает редко, чаще отмечается незначительное желтушное окрашивание склер в совокупности с предыдущими признаками.
- Период выздоровления (реконвалесценции) или переход в малоактивное хроническое течение — от 3 до 6 месяцев.
По (МКБ-10): B17.1 Острый гепатит С.
По клинической форме:
- Манифестная:
- желтушная (типичная);
- безжелтушная.
- Бессимптомная:
- субклиническая (симптомы выражены очень слабо);
- инаппарантная (симптомов нет, возможны лишь лабораторные изменения).
По степени тяжести:
- Лёгкая — незначительная интоксикация до 5 дней, отсутствие или незначительная желтушность до 7 дней, отсутствие лихорадки, нормальные или незначительно увеличенные размеры печени, общий билирубин до 85-100 мкмоль/л, протромбиновый индекс (ПТИ) до 80 %, АЛТ до 500 ед/л.
- Средней тяжести — умеренная интоксикация до 7 дней, умеренная желтушность до 10 дней, субфебрилитет (повышение температуры тела в пределах от 37,1 до 38,0 °С) в начальном периоде до 5 дней, увеличение печени до 4 см, общий билирубин 100-170 мкмоль/л, ПТИ 80-60 %, АЛТ до 1000 ед/л.
- Тяжёлая — резко выраженная интоксикация 15 и более дней, интенсивная желтушность кожи 3 недели и более, фебрильная температура весь начальный и период разгара болезни, тахикардия, увеличение печени на 6 см и резкое её уменьшение в размерах на фоне прогресса болезни, общий билирубин от 170 мкмоль/л, ПТИ менее 60 %, АЛТ более 1000 ед/л.
По длительности течения:
- острый гепатит С (циклический — до 3 месяцев, острый затяжной — 3-6 месяцев);
- хронический гепатит С — продолжительностью более 6 месяцев.
Классификации хронических форм не разработаны, могут применяться различные составляющие на основании выраженности цитолитического синдрома, уровня повышения печёночных ферментов, морфологических изменений печени, наличию осложнений и др. [2][10][11].
Осложнения гепатита С
В остром периоде гепатита С возможно развитие «печёночной комы» — резкого выраженного угнетения функции печени вследствие массивной гибели печёночных клеток и накопления в организме токсичных продуктов обмена различных веществ. Это состояние характеризуется заторможенностью, потерей сознания, нарушением витальных (жизненно важных) функций. Однако встречаемость данного осложнения крайне низкая.
В хронической фазе болезни (или, по мнению части исследователей, конечной фазе заболевания) наиболее частым осложнением является развитие цирроза печени — замещения функционального долькового строения печёночной ткани грубым соединительнотканным образованием, что приводит к неадекватному функционированию органа. Определённое время печень способна выполнять функцию даже на стадии цирроза, но со временем при воздействии вируса наступает декомпенсация работы. Это состояние характеризуется нарушением кровотока в печени, повышением давления в системе воротной вены, расширением вен пищевода и желудка, увеличением селезёночной вены. Прогрессивно снижается уровень выработки белков, факторов свёртывания крови, фильтрационная способность. Появляются отёки, асцит (скопление жидкости в брюшной полости), кровотечения различной интенсивности, ухудшается общее состояние, интеллектуально-мнестические характеристики. В конечном итоге возможен летальный исход из-за массивного кровотечения и полиорганной недостаточности.
Не менее значимое осложнение хронической фазы гепатита С — развитие гепатоцеллюлярной карциномы (опухолевое перерождение). Согласно основной гипотезе, злокачественное перерождение возникает в результате повышенного распада клеток печени и последующего их восстановления, что приводит к повышенному числу мутаций. На ранних стадиях принципиальных отличий от течения хронического гепатита нет, в запущенных случаях возникает стремительное ухудшение состояния, нарастание асцита, желтухи, неспецифических желудочно-кишечных симптомов, потери веса, анорексии.
У 10-15 % больных с хроническим вирусным гепатитом С возможно развитие аутоиммунных заболеваний, наиболее частыми из которых являются аутоиммунный гепатит (АИГ) и криоглобулинемия. АИГ — это иммуноопосредованное поражение печени. Внешне оно мало отличается от проявлений гепатитов другой этиологии, но зачастую имеет более агрессивное течение и поддаётся терапии только длительными курсами иммуносупрессивных препаратов. Криоглобулинемия — накопление в малых и средних кровеносных сосудах специфических белков, которые вызывают затруднение в них тока крови и приводят к специфическим проявлениям.
Также определена связь гепатита С с развитием сахарного диабета, неходжкинской лимфомы и кожной порфирии Тарда [2][8][9][10].
Диагностика гепатита С
Вариантов первичного выявления вируса и заболевания множество, однако чаще всего гепатит С выявляется в ходе планового обследования при сопутствующем заболевании (операции или госпитализации). Как правило, обнаруживают повышенный уровень АЛТ или антитела к гепатиту С (HCVAb). Это служит поводом для направления такого пациента к врачу-инфекционисту для углублённого обследования.
На приёме врач-инфекционист (гепатолог) осматривает пациента, в части случаев (в различных сочетаниях) выявляет характерное изменение цвета ладоней (печёночные ладони), увеличение размеров печени. В продвинутых случаях заболевания врач отмечает расширение вен области передней брюшной стенки («голова медузы»), отёчность (в том числе асцит как причина увеличения размеров живота), сосудистые звездочки и др.
Прохождение тестирования на гепатит С
При лабораторном обследовании в первую очередь должно быть назначено исследование на АЛТ, РНК вируса методом ПЦР качественно с чувствительностью 15-60 МЕ и антитела к вирусу гепатита С суммарные. При отрицательном результате ПЦР и положительном анализе на антитела диагноз гепатита С не подтверждается. Согласно действующему в РФ законодательству, такой человек должен быть поставлен на учёт к инфекционисту на срок 2 года с обязательным обследованием методом ПЦР раз в 6 месяцев. При отрицательном результате наблюдение прекращается с диагнозом паст-инфекция гепатита С (выздоровление). При положительном результате ПЦР происходит подтверждение диагноза — острый или хронический вирусный гепатит С — и назначается дополнительное обследование в целях уточнения текущего состояния. Необходимо помнить, что выявление суммарных антител в иммуноферментном анализе (ИФА) говорит лишь о прошлой встрече с инфекцией и не даёт практически никакой информации о наличии заболевания в текущий момент. Антитела могут сохраняться пожизненно.
Обязательно должны быть назначены следующие исследования:
- Развернутый клинический анализ крови + СОЭ (скорость оседания эритроцитов). Для гепатита С характерны: лейкопения (снижение количества лейкоцитов), лимфо- и моноцитоз (увеличение числа лимфоцитов и моноцитов), уменьшение СОЭ, тромбоцитопения (снижение количества тромбоцитов);
- Биохимический анализ крови:
- аланинаминотрансферраза (АЛТ) — возможен нормальный уровень или периодическое повышение;
- аспартатаминотрансферраза (АСТ) — норма или повышение;
- гамма-глутамилтранспептидаза (ГГТ) — норма или повышение;
- щелочная фосфатаза (ЩФ) — повышение при ухудшении процесса;
- общий билирубин — норма или повышение;
- общий белок — снижение при нарушении функции печени;
- протеинограмма — повышение гамма-глобулинов;
- протромбиновый индекс (ПТИ) — снижение при прогрессировании процесса;
- креатинин, амилаза, сахар.
- Онкомаркеры. Альфафетопротеин — повышение при прогрессировании процесса и развитии рака печени.
- Общий анализ мочи — появление уробилина, белка.
- УЗИ органов брюшной полости — возможно увеличение размеров печени и селезёнки, изменение структуры печени, размера внутренних сосудов.
- ФГДС — исследование пищевода, желудка и двенадцатиперстной кишки. Выявляется расширение вен пищевода при развитии портальной гипертензии — осложнение цирроза печени.
- Фиброскан — метод оценки фиброза печени, который позволяет определить тяжесть заболевания без биопсии (F0 – отсутствие фиброза, F4 — цирроз).
- ПЦР на гепатите С — качественный и при необходимости количественный тест.
- Генотипирование — определение генотипа вируса гепатита С.
- Мутации лекарственной резистентности NS3, NS5A и NS5B регионов генома вируса гепатита С (при неудаче в лечении препаратами прямого действия или высоком риске такой неудачи до лечения).
- Анализы на маркеры сопутствующих вирусных гепатитов (HbsAg, HbcorAb total, anti-Hbs).
- Анализ на ВИЧ.
При необходимости список исследований может расширяться. Стоит подчеркнуть, что грамотное назначение обследования и его интерпретация возможны исключительно врачом-инфекционистом (гепатологом). Врач назначит лишь необходимое, тем самым поможет пациенту сэкономить деньги, даст грамотную оценку полученных данных, что чрезвычайно важно в планировании дальнейшего лечения и его исхода [2][5][6][9][12].
Дифференциальная диагностика
- Вирусные и невирусные гепатиты другой этиологии. Связаны с путешествиями, любыми повреждениями кожи и слизистых, употреблением заражённых пищи и воды. Отличаются выраженностью симптоматики. Для уточнения диагноза проводятся специфические серологические тесты ИФА и ПЦР.
- Токсическое поражение печени. Связано с недавним значительным употреблением алкоголя или токсинов. Проводятся специфические серологические тесты ИФА и ПЦР, выявляется чрезмерное повышение ГГТ (фермент, маркер поражения печени).
- Паразитарные заболевания печени (например описторхоз, эхинококкоз). Связаны с проживанием в эндемичном регионе, употреблением плохо приготовленной рыбы, контактом с собаками. Характеризуются выраженной эозинофилией (увеличением уровня эозинофилов) периферической крови. Проводятся специфические серологические тесты, выявление яиц паразитов, инструментальные исследования.
- Первичный или метастатический рак печени. Изучаются данные анамнеза о сопутствующих заболеваниях, учитываются результаты инструментальной и лабораторной диагностики [2][4][10][11].
Надо ли проверяться на гепатит С здоровому человеку
Регулярное обследование на гепатит С при отсутствии симптомов следует проводить медработникам, пациентам отделений гемодиализа, частым посетителям стоматолога, больным хроническими заболеваниями с частыми парентеральными вмешательствами (внутривенно, подкожно и внутримышечно) и лицам, часто меняющим половых партнёров.
Лечение гепатита С
Основу любого лечебного воздействия составляет правильно подобранная диета. В отношении вируса гепатита С этот метод как никогда актуален, однако он зачастую игнорируется как пациентами, так и самими врачами.
Диета при гепатите С
Самое главное условие — полный отказ от алкоголя. Ничто так не вредит печени, как алкоголь. Именно он может стать тем фактором, который запускает цепь патологических реакций и переводит гепатит из вялотекущего процесса в высокоактивный, ускоряя наступление цирротической стадии гепатита. В отношении других продуктов питания и напитков следует соблюдать золотую середину: питание должно быть разнообразным, всего должно быть в меру, без злоупотреблений «тяжёлой» пищей (ограничение жирного, жареного, солёного, копчёного) с учётом отсутствия или наличия сопутствующих заболеваний.
Большое значение имеет поддержание разумной физической активности и контроль веса (индекс массы тела не должен превышать 25 кг/м2).
Какие врачи лечат гепатит С
Лечением гепатита С занимаются врачи-инфекционисты.
Медикаментозная терапия Гепатита С
Медикаментозное лечение гепатита С зависит от фазы развития заболевания, индивидуальных особенностей и возможностей организма. В остром периоде широко применяется инфузионная терапия (введение растворов) с привлечением различных дезинтоксикационных (очищение организма от вредных веществ) и питательных лечебных растворов.
Роль специфической противовирусной терапии острого гепатита С окончательно не решена и возможна лишь в индивидуальном порядке, например при угрозе хронизации или при фульминантном течении болезни (тяжёлом варианте воспалительно-некротического поражения печени). При невозможности радикального лечения гепатита С в хронической фазе вполне приемлема поддерживающая терапия так называемой группой гепатопротекторов (фосфолипиды, аминокислоты, антиоксиданты и др.). Данные средства не имеют чётко доказанной эффективности, однако широко применяются на практике и в некоторых случаях способны несколько задержать прогрессирование заболевания. Хороший эффект даёт нормализация функции ЖКТ и улучшение микрофлоры кишечника.
Попытки воздействия на вирус предпринимались с момента его открытия. Вначале это было изолированное применение препаратов интерферона короткого действия, затем комбинации интерферона короткого действия и рибавирина (препарата общевирусного действия). Их сменила комбинация интерферона пролонгированного действия и рибавирина.
К концу интерфероновой эпохи были достигнуты значительные успехи в процессе лечения и избавления человеческого организма от вируса гепатита С. Однако терапия была длительной, процент излечения достигал не более 70 % в среднем по генотипам, и курс лечения имел серьёзные побочные эффекты, иногда приводя к последствиям намного серьёзнее, чем сам гепатит С. Это обстоятельство дало толчок к разработке принципиально новых лекарственных средств, характеризующихся прямым противовирусным действием, сочетающих высокую эффективность (до 99 %), высокий профиль безопасности (минимальные побочные эффекты), простоту и удобство дозирования и небольшую длительность (2-3 месяца). В основу механизма действия легло подавление ключевых этапов размножения вируса, в первую очередь протеазы и полимеразы вируса гепатита С. Проведённые испытания препаратов показали высокие результаты, и, начиная с 2013 года, данная группа последних эффективных разработок с успехом применяется во всём мире. В некоторых странах одобрено лечение детей современными препаратами начиная с 3 лет (в зависимости от генотипа) с соответствующими взрослым показателями успеха.
Можно ли вылечить гепатит С полностью
В 2016 году Всемирная организация здравоохранения (ВОЗ) объявила гепатит С полностью излечимым заболеванием.
На 2020 год в мире доступны следующие виды и комбинации лекарственных препаратов прямого противовирусного действия для лечения гепатита С:
- Софосбувир.
- Даклатасвир.
- Элбасвир и Гразопревир.
- Глекапревир и Пибрентасвир.
- Ледипасвир и Софосбувир.
- Омбитасвир / Паритапревир / Ритонавир.
- Омбитасвир / Паритапревир / Питонавир / Дасабувир.
- Симепревир.
- Софосбувир и Велпатасвир.
- Софосбувир / Велпатасвир / Воксилапревир (комбинация не зарегистрирована в РФ).
Как лечить гепатит С в домашних условиях
Назначение противовирусной терапии должно осуществляться врачом, хорошо ориентирующимся в множестве применяемых для терапии гепатита С лекарств, после изучения всех составляющих процесса, возможных противопоказаний, взаимодействий с уже принимаемыми препаратами, особенностей диеты и образа жизни [1][5][8][9]. Гепатит С — тяжёлое инфекционное заболевание, которое может привести к циррозу и раку печени, поэтому самолечение опасно для жизни.
Схемы лечения гепатита С в России
В России на сегодняшний день для лечения гепатита С используется преимущественно устаревшее лечение интерферонами (чаще бесплатно или со скидкой), в редких случаях — препаратами прямого противовирусного действия (чаще платно со скидкой).
Прогноз. Профилактика
Если лечение гепатита начать до того, как разовьётся цирроз печени, то прогноз будет благоприятным: как правило, наступает полное излечение. При запущенных стадиях (цирроз и рак печени) прогноз зависит от множества факторов, обычно при начальном циррозе больные при должном лечении могут жить дальше без каких-либо серьёзных проблем со здоровьем, при декомпенсированном процессе прогноз неблагоприятный.
Прогноз при отсутствии лечения гепатита С
В среднем без лечения при отсутствии пагубных привычек и здоровом образе жизни в течение 20 лет примерно у 10-20 % больных разовьются цирроз и рак печени, при регулярном злоупотреблении алкоголем, наркотиками и токсинами (в том числе лекарствами) доля таких тяжёлых осложнений составит до 30-40%.
Из-за повышенной мутационной способности вируса существует ряд технических сложностей в создании вакцины — на данный момент её не существует (ведутся разработки). Поэтому меры профилактики распространения вируса гепатита С направлены на разрывы механизмов и путей передачи вируса, санитарное информирование и обучение населения.
Первичная профилактика
- Предупреждение возможности заражения в медицинских учреждениях:
- гигиена и обработка рук, инструментария, использование перчаток;
- тестирование донорской крови, плазмы и компонентов;
- тестирование донорских органов;
- надлежащее проведение медицинских инъекций;
- обучение медицинского персонала;
- обследование доноров, беременных, госпитализированных.
- Предупреждение полового пути заражения
- обучение правильному и своевременному использованию презервативов;
- тестирование перед вступлением в брак.
- Выдача стерильного инструментария потребителям инъекционных наркотиков (не во всех странах).
Вторичная профилактика
- Проведение противовирусной терапии (в идеале при выявлении заболевания, т. к. это предупреждает дальнейшее распространение инфекции).
- Матерям с гепатитом С (если он не был пролечен до беременности) следует внимательно следить за состоянием целостности кожи сосков и рта ребёнка, при наличии повреждений необходимо прекращать грудное вскармливание на время до их заживления [2][7][9][12].
Что делать, если член семьи болен гепатитом С
Самое важное, что следует сделать, чтобы предотвратить заражение вирусом — это избегать контакта с кровью инфицированного человека. Кровь может быть заразной, даже если она сухая. Надевайте перчатки, если вам нужно прикасаться к использованным бинтам. После контакта с кровью тщательно вымойте руки, даже если вы были в перчатках.
Некоторые предметы личной гигиены могут иногда содержать небольшое количество крови. Не следует совместно использовать зубную щётку, бритву или маникюрные ножницы.
Деятельность ВОЗ
В мае 2016 г. Всемирная ассамблея здравоохранения приняла первую «Глобальную стратегию сектора здравоохранения по вирусному гепатиту на 2016–2021 гг. Главной целью стратегии является снижение к 2030 г. числа новых случаев инфицирования вирусным гепатитом на 90 % и смертности от вирусного гепатита на 65 %. Для реализации этой стратегии ВОЗ занимается повышением осведомлённости о заболевании и его профилактике и расширяет охват услугами по скринингу, оказанию помощи и лечению гепатита С [13].
Состав
В качестве активных ингредиентов препарат Велакаст содержит: софосбувир и велпатасвир в дозах 400 мг и 100 мг соответственно.
Таблетки включают следующие неактивные ингредиенты: кроскармеллозу натрия, стеарат магния и микрокристаллическую целлюлозу, диоксид титана IP и алмазный синий FCF, полиэтиленгликоль, поливиниловый спирт, тальк.
Форма выпуска
Препарат выпускается в таблетках, покрытых пленочной оболочкой, по 28 штук в упаковке.
Фармакологическое действие
Велакаст представляет собой комбинацию фиксированных доз софосбувира и велпатасвира, противовирусных средств прямого действия против вируса гепатита С. Софосбувир является ингибитором РНК-зависимой РНК-полимеразы NS5B HCV, необходимой для репликации вируса. Софосбувир представляет собой нуклеотидное пролекарство, которое подвергается внутриклеточному метаболизму до фармакологически активного аналога уридин-трифосфата (GS-461 203), который может быть включен в РНК HCV с помощью полимеразы, а NS5B действует как терминатор цепи. Биохимический анализ GS-461203 ингибировал полимеразную активность рекомбинантного NS5B из генотипов 1b, 2a, 3a и 4a HCV со значением IC50 в диапазоне от 0,36 до 3,3 микромоль. GS-461203 не является ни ингибитором ДНК-ДНК и РНК-полимераз человека, ни ингибитором митохондриальной РНК-полимеразы.
Велпатасвир является ингибитором белка NS5A ВГС, который необходим для репликации вируса. Выбор устойчивости в исследованиях клеточных культур и перекрестной устойчивости указывает на то, что цель NS5A Vegeta-virgin является его механизмом действия.
Фармакокинетика
Оба активных вещества Velakast довольно неплохо абсорбируются из желудка в кровь. Наибольшее соотношение действующих веществ в плазме достигается спустя 3 часа после приема препарата. Софосбувир метаболизируется в печени, а велпатасвир в бессменном виде экскретируется через толстый кишечник с фекалиями.
Показания к применению
Препарат Велакаст применяется в лечении хронической вирусной инфекции гепатита С.
Противопоказания
Аллергия на компоненты Велакаста и детский возраст до 18 лет являются ограничениями к приему данного препарата.
Побочные реакции
При приеме препарата Velakast у некоторых больных периодически отмечались такие негативные эффекты:
- головокружение и полуобмороки;
- подавление кровообращения в виде малокровия, лимфоцитопении или тромбоцитопении;
- гипотиреоз;
- высыпания на коже.
Как правило, все неблагоприятные реакции имеют слабовыраженный характер и не требуют отмены приема препарата.
Таблетки Велакаст в сочетании с мощными или умеренными индукторами P-gp вызывают потерю активности данного препарата за счет снижения концентрации софосбувира в плазме. Велакаст, вводимый совместно с ингибиторами P-gp или BCRP, приводят к увеличению воздействия побочных эффектов этих субстратов. Медпрепарат в сочетании с варфарином вызывает колебания как протромбинового времени, так и значений МНО. Велакаст совместно с кислотными восстановителями вызывает снижение эффекта концентрации софосбувира, а Велпатасвир приводит к потере активности Велакаста.
Препарат в сочетании с амиодароном вызывают брадикардию. Велакаст, вводимый вместе с противосудорожными или антимикобактериальными средствами, вызывает снижение концентрации софосбувира и велпатасвира.
Прием препарата со зверобоем вызывает потерю противовирусной активности Велакаста за счет снижения концентрации софосбувира или Велпатасвира.
Велакаст в сочетании с ингибиторами HMG CoA редуктазы вызывает повышение концентрации этих лекарств.
Применение и дозы
Пациентам, страдающим компенсированным циррозом печени или без цирроза следует принимать одну таблетку один раз в день в течение 12 недель.
Больным с декомпенсированным циррозом печени назначают одну таблетку в комбинации с рибавирином на основе веса путем приема во время еды в течение 12 часов. Дозу рибавирина следует рассчитывать индивидуально.
Пациентам с массой тела <75 кг рекомендуемая доза рибавирина составляет 1000 мг два раза в день. Пациентам с массой тела от 75 кг рекомендуемая доза рибавирина составляет 1200 мг два раза в день.
Передозировка
На сегодняшний день случаи передозировки зарегистрированы не были.
Условия продажи
По рецепту.
Условия хранения
В температурном диапазоне от 15 до 25 градусов Цельсия, в месте, без доступа для детей.
Применение при беременности и кормлении грудью
Данное медсредство запрещено назначать данной категории граждан.
Влияние на способность к вождению автотранспорта и управлению механизмами
Не влияет.
Особые указания
Повторное возникновение инфекции HBV происходит у пациентов с коинфекцией HBV / HCV. В связи с этим, перед началом терапии необходимо проверить уровень HBsAg и анти-HBc. Функциональный тест печени следует часто проверять.
САМОЛЕЧЕНИЕ МОЖЕТ БЫТЬ ОПАСНЫМ ДЛЯ ВАШЕГО ЗДОРОВЬЯ. ОБЯЗАТЕЛЬНО КОНСУЛЬТИРУЙТЕСЬ С ЛЕЧАЩИМ ВРАЧОМ
При каких заболеваниях применяют?
- гепатит С
- лечение гепатита С
- хронический вирус гепатита C 1-го или 4-го генотипа
- терапия гепатита С у больных с ВИЧ-инфекцией
Излечившиеся от инфекционного воспаления печени интересуются, возможен ли рецидив гепатита С. Медики дают утвердительный ответ.
Врачи отмечают, что зачастую причинами рецидива становятся нарушение правил личной гигиены либо несоблюдение профилактических мер. Обезопасить себя на 100% нельзя, ведь от гепатита С нет вакцины.
После перенесённой болезни иммунитет к ней тоже не вырабатывается.
Статистка рецидивирования гепатита С
По статистике примерно 30% пациентов после выздоровления рискуют столкнуться с рецидивом заболевания. Таковы данные российских агентств. В странах с пандемией гепатита процент повторных заражений выше.
У вируса гепатита С6 генотипов. У них есть подвиды — квазитипы. Одни чаще встречаются в странах бывшего социалистического лагеря. Другие разновидности патогена поражают жителей Африки.В общем, болезнь «охватывает» весь земной шар. Одни генотипы типичны в среде наркоманов. Другие подвиды болезни поражают и благополучных граждан.
Генотипы вируса отличаются:
- степенью устойчивости к медикаментам;
- последствиями, то есть приводят к осложнениям разной степени тяжести.
Особенно опасными считаются 1 и 4 генотипы.Они требуют сложного и длительного лечения. Стандартный курс терапии составляет более 48 недель.
Недуги 1 и 4 типов склонны вызывать быстрое развитие цирроза, печёночной комы, рака. При этом гепатит и его осложнения долго протекают бессимптомно. Причина тому — отсутствие в печени нервных окончаний.
Вес органа составляет 1,5 килограмма. Боль появляется,когда воспалённая печень увеличивается и начинает растягивать наружную капсулу, в которой есть многочисленные нервные клетки, рецепторы и волокна нервов.
Причины рецидива болезни
- Медики выделяют ряд факторов, способных спровоцировать повторное обострение гепатита С.
- К ним относят:
- Наличие в организме пациента других патогенов, к примеру, ВИЧ (вируса иммунодефицита человека). Патология затрудняет выявление и терапию гепатита.
- Некоторые хронические болезни органов желудочно-кишечного тракта. Их симптоматика схожа с признаками гепатита. В итоге воспаление печени как бы маскируется. Из-за наличия проблем с пищеварительным трактом убедиться в выздоровлении бывает проблематично.
- Диабет 2 типа. Заболевание оказывает негативное влияние на состояние и работу печени. Орган остаётся уязвимым и легко инфицируется повторно.
- Неправильно подобранное лечение. Вирус гепатита С отличается высокой способностью к мутированию. Патоген может не реагировать на используемые медикаменты. Принятое за выздоровление затишье может быть временным снижением вирусной нагрузки. Если частиц патогена на миллилитр крови меньше 100 тысяч, аппаратура не фиксирует вирус.
- Нарушение режима лечения. Чтобы вирус погиб, в организме пациента должна постоянно поддерживаться определённая концентрация лекарства. Если больной забывает принимать препарат или на своё усмотрение меняет график терапии, она становится бесполезной.За время отсутствия поступления очередных доз лекарства вирус размножается с новой силой.
- Некоторые генотипы вируса гепатита. Разновидность 1b, к примеру, рецидивирует чаще прочих.
- Период менопаузы у женщин. Гормональная перестройка снижает иммунную защиту организма. Если вирус гепатита повторно проникает в кровь, системы тела не могут противостоять болезни. У молодых людей с сильным иммунитетом, напротив, возможно самоизлечение. Оно фиксируется примерно у 15% инфицированных.
- Значительное повреждение гепатоцитов. Так называются функциональные клетки печени, составляющие 80% её массы. Если гепатит побеждён, но гепатоциты повреждены, орган остаётся уязвимым.
- Наличие у пациента избыточного веса. Жир скапливается не только под кожей, но и на внутренних органах, давя на них. Под «гнётом» печень ослабевает, хуже работает, легче поддаётся повторному инфицированию.
- Отсутствие профилактики заболевания. После излечения устойчивого иммунитета к гепатиту С нет. Поэтому при несоблюдении профилактических мер, пациенты рискуют повторно заразиться.
Некоторые медики считают, что для развития рецидива достаточно изменения режима питания и образа жизни, которых пациент придерживался во время лечения.
Существуют вызывающие возврат болезни факторы, связанные с полом и возрастом пациентов.
Вызвать рецидив гепатита могут:
- у детей — слишком подвижные игры и длительное нахождение на солнце;
- у мужчин — злоупотребление спиртными напитками;
- у женщин — большие физические нагрузки, которые могут быть связаны с работой на даче или даже уборкой в доме.
Чтобы не допустить рецидив, пациенту весь период лечения необходимо соблюдать режим, рекомендованный врачом.
Кто в группе риска
Медики выделяют следующие категории людей, более прочих подверженных рецидиву гепатита:
- Наркозависимые, использующие инъекционные наркотические вещества.
- Пациенты, проходившие процедуру переливания крови до 1987 года.
- Люди, регулярно проходящие гемодиализ.
- Пациенты, перенёсшие трансплантацию органов до 1992 года.
- ВИЧ-инфицированные.
- Люди, имеющие невыясненные патологии печени.
- Дети, рождённые от инфицированных гепатитом С матерей.
- Люди, ведущие беспорядочную половую жизнь без использования барьерных методов контрацепции.
- Медицинские работники, контактирующие по долгу службы с кровью или её компонентами.
- Граждане, регулярно посещающие салоны красоты, увлекающиеся пирсингом или татуировками.
- Люди, пользующиеся чужими гигиеническими принадлежностями.
Гражданам из списка медики настоятельно рекомендуют дважды в год проходить комплексное обследование. Оно позволит своевременно выявить гепатит С, начать лечение до того, как вирус приведёт к необратимым последствиям.
Сроки возврата болезни после первичного излечения
- Так как устойчивый иммунитет к вирусу гепатита С после лечения не вырабатывается, спустя некоторое время можно вновь ощутить признаки заболевания.
- Почему оно может вернуться:
- если вернулся через 3 месяца после лечения, вероятно несоблюдение правил лечения, к примеру,пропускал приём лекарства;
- из-за ложного вердикта о выздоровлении, обусловленного маскировкой гепатита на фоне других заболеваний.
Обычно заболевание возвращается не ранее, чем через 50 дней после излечения. Полтора месяца — длительность инкубационного периода гепатита С. После вирус может диагностироваться клинически.
Если рецидив произошёл через полтора месяца после констатации излечения, последнее наверняка определено ошибочно. Вероятность, что вирус повторно попал в организм в день выздоровления мала.
Как отследить рецидив гепатита
Как можно узнать, что случился рецидив заболевания?
На это могут указывать такие симптомы:
- болезненность справа под рёбрами;
- нарушение работы пищеварительной системы;
- повышенная утомляемость и постоянная раздражительность;
- желтушность кожных покровов и слизистых оболочек;
- красный оттенок ладоней.
Если после прохождения курса лечения гепатита С пациент вновь почувствовал слабость и другие характерные симптомы, необходимо пройти повторное обследование.
Произойти рецидив может по неконтролируемым человеком причинам, таким, как:
- Использование нестерильных инструментов в стоматологических клиниках или салонах красоты.
- Переливание крови или её компонентов. Материал может оказаться заражённым, если не прошёл должной проверки.
- Половой акт с инфицированным партнёром без использования барьерных методов контрацепции.
После лечения предстоит раз в 3 месяца проходить профилактическое обследование. Оно помогает своевременно выявить рецидив болезни. Если неприятные симптомы появились раньше планового срока обследования, не стоит откладывать визит к врачу.
Как лечится повторная инфекция
Когда произошёл возврат гепатита после лечения Софосбувиром или другим противовирусным, врач назначает повторный курс терапии.Лечение заключается в продлении приёма лекарств, которые использовались ранее. Обычно это Софосбувир или Рибавирин.
Дополнительно больному назначают:
- гепатопротекторы, защищающие клетки печени, поддерживающие работоспособность органа;
- сорбенты, помогающие вывести из организма токсины;
- витаминно-минеральные комплексы, действие которых направлено на поддержание и укрепление иммунной системы.
Схема лечения повторной инфекции может быть такой же, как и в первый раз, а может отличаться дозировкой или использованием препаратов-аналогов. Замена применяемых ранее лекарств бывает обоснована генотипом патогена, малым вирусологическим ответом. Последний, как правило, связан с устойчивостью возбудителя к используемым противовирусным.
Альтернативой Софосбувиру и Рибавирину становятся:
- Даклатасвир.
- Велпатасвир.
- Харвони.
Перечисленные препараты являются ингибиторами, действуя непосредственно на возбудитель, препятствуют его дальнейшему размножению.
Обычно при повторном лечении интерфероносодержащие лекарства, усиливающие иммунитет, уже не назначают. Средства серии дают серьёзные побочные эффекты.
- Дозировку же основного препарата противовирусной направленности после рецидива гепатита С увеличивают.
- Дополнительно может потребоваться лечение осложнений или сопутствующих патологий.
- При этом возникают сложности:
- Главная состоит именно в повторном лечении. После первичного курса терапии организм ослаблен вирусом и приёмом сильнодействующих лекарств. Поэтому при рецидиве может не оказаться сил для борьбы с возбудителем гепатита С.
- Бывают случаи, когда рецидив связан с развитием нескольких форм болезни. Значит, пациенту необходимо принимать препараты сразу от 2 генотипов вируса. Двойная нагрузка может спровоцировать нарушение работы печени, вызвать цирроз.
- Иногда повторная терапия способна привести к нарушению работы почек, вызвав гломерулонефрит. Иногда рецидив способен повлечь за собой фиброз, стеатоз, развитие злокачественного образования в печени.
Два последних случая требуют лечения и от сопутствующих гепатиту С патологий.
Профилактика рецидива гепатита С
Препараты, используемые для терапии гепатита С, оказывают негативное влияние на организм больного. Поэтому после лечения важно заняться восстановлением иммунной системы. Это сведёт риск рецидива болезни к минимуму.
Пациенту следует соблюдать следующие профилактические рекомендации:
- блюсти диету, особенно в первое время после терапии, поскольку направленные на подавление вируса препараты негативно влияют на состояние органов пищеварения;
- снизить физические нагрузки, ограничившись прогулками на свежем воздухе, стандартной зарядкой, пробежками;
- отказаться от спиртных напитков и наркотических средств;
- закаливать организм и укреплять иммунитет;
- отказаться от беспорядочной половой жизни;
- при необходимости лечить зубы выбирать только проверенные стоматологические кабинеты с хорошей репутацией.
Лечение гепатита С сложное и длительное. Чтобы терапия была успешной, а после окончания курса не произошёл рецидив, важно в точности соблюдать предписания лечащего врача. После излечения столь же важно заниматься профилактикой.
Рецидив гепатита С: причины и схемы лечения
Известно, что гепатит С в настоящее время является излечимым заболеванием. Несмотря на этот факт, многих интересует вопрос, возможен ли рецидив гепатита С. По мнению профильных специалистов, не стоит исключать этот факт, поскольку даже после курса возможен возврат заболевания.
Почему так происходит? Доктора отмечают, что основные причины рецидива – это нарушение правил личной гигиены или несоблюдение профилактических мер. К сожалению, обезопасить себя на все 100% от вирусного заболевания невозможно.
На данный момент вакцина от гепатита С находится на стадии разработки, когда она поступит в массовое использование, никто не знает. Иммунитет не вырабатывается после перенесенной болезни.
Что это значит? Если Вы сумели победить вирус hcv, то это не говорит о том, что теперь Вы защищены от повторного инфицирования.
Неутешительная статистика: это интересно
Если рассматривать статистические данные, то приблизительно 30% людей, которые выздоровели, рискуют столкнуться с рецидивом заболевания. Такую информацию предоставляют российские агентства. В странах с пандемией вирусного гепатита процент повторного заражения намного выше.
Выделяют 6 генотипов вируса hcv, у которых есть свои подвиды – квазитипы. Первые четыре типа встречаются в странах постсоветского пространства. Пятый и шестой характерны для Африки.
Это говорит о том, что болезнь распространена по всему земному шару.
Есть определенные виды вируса, которые встречаются чаще всего среди наркоманов, другие представляют собой опасность и для благополучных граждан.
Важно понимать, что болезнь опасна для каждого жителя нашей планеты, поэтому надо максимально ответственно относиться к своему здоровью и ежегодно сдавать необходимые анализы. Помните, предупрежден значит вооружен.
Отличительные особенности генотипов вируса:
- Степень устойчивости к лекарственным средствам;
- Осложнения разной степени тяжести.
Сами опасными считаются 1 и 4 генотипы, поскольку они требуют более длительного лечения интерферонами. Стандартный курс может превышать 48 недель. Данные типы вызывают быстрое развитие цирроза, печеночной комы и онкологии. В настоящее время при их выявлении назначают безинтерфероновой курс, который рассчитан на 12-24 недели.
Основные причины рецидива гепатита С
Специалисты выделяют факторы, которые могут спровоцировать повторное обострение гепатита Ц:
- Наличие в организме больного других патогенов: например, вирус иммунодефицита человека. ВИЧ затрудняет выявление и само лечение гепатита С.
- Хронические заболевания желудочно-кишечного тракта: их симптомы можно спутать с признаками гепатита. В таких случаях маскируется воспаление печени. Проблемы с пищеварительным трактом затрудняют процесс выздоровления.
- Диабет 2 типа: данная болезнь негативно влияет на состояние и функционирование печени. Орган при таком диагнозе уязвим и легко может быть повторно инфицирован.
- Неправильно подобранная стратегия лечения гепатита С: высокая способность к мутациям является отличительной особенностью вируса. Патоген в некоторых случаях не реагирует на принимаемые лекарства. Иногда за выздоровление принимают снижение вирусной нагрузки. В случае, когда частиц патогена меньше 100 тысяч на миллилитр крови, аппаратура не фиксирует наличие ВГС.
- Нарушение курса лечения: важно постоянно поддерживать определенную концентрацию медикаментов в крови для уничтожения вируса. Когда больной забывает принять лекарства или самостоятельно меняет график приема, то медикаменты просто становятся бесполезными. В организме происходит размножение инфекции во время отсутствия поступления лекарственных компонентов.
- Некоторые генотипы вируса: тип 1 и чаще всего рецидивирует.
- У женщин период менопаузы: во время гормональной перестройки снижается иммунная защита организма. При повторном проникновении вируса в кровь, системы не могут противостоять ему. Молодые люди с сильным иммунитетом могут выздороветь даже без применения медикаментов. В 15% случаев фиксируется самоизлечение.
- Значительное повреждение клеток печени: даже если гепатит побежден, но гепатоциты повреждены, печень остается под ударом.
- Избыточный вес: жир откладывается не только под кожей, но и на внутренних органах. При таких обстоятельствах печень плохо работает, поэтому легче поддается повторному заражению.
- Пренебрежение профилактикой: после выздоровления иммунитет к заболеванию не вырабатывается. При игнорировании профилактических мер увеличиваются риски повторного инфицирования.
По мнению некоторых медиков, повторный гепатит С может произойти в том случае, если человек меняет режим питания и образ жизни, которых он придерживался во время ПВТ.
Внимания заслуживают и факторы, которые связаны с возрастом и полом больных. Вызвать рецидив могут:
- У детей: длительное нахождение на солнце и слишком подвижные игры;
- У женщин: тяжелые физические нагрузки;
- У мужчин: злоупотребление алкогольными напитками.
Важно даже после выздоровления соблюдать режим, назначенный лечащим врачом для исключения возврата болезни.
Кто находится в группе риска?
Повторный гепатит С (рецидив) чаще всего встречается среди следующих категорий пациентов:
- Наркоманы, употребляющие наркотические вещества инъекционно;
- Больные, проходившие переливание крови до 1987 года;
- Люди, находящиеся на постоянном гемодиализе;
- Больные, которые перенесли трансплантацию органов до 1992 года;
- ВИЧ-положительные;
- Люди с невыясненными патологиями печени;
- Дети от зараженных гепатитом С матерей;
- Люди, которые ведут беспорядочные половые связи без использования мер защиты;
- Медицинские работы, контактирующие с кровью;
- Любители салонов красоты, татуировок и пирсинга.
Важно бережно относиться к своему здоровью и приложить максимум усилий для того, чтобы вновь не встретиться с коварным заболеванием.
Когда болезнь может вернуться?
Как уже говорилось выше, иммунитет к гепатиту С не вырабатывается, поэтому спустя время болезнь может снова дать о себе знать. Речь идет о следующих ситуациях:
- Рецидив через 3 месяца ПВТ: чаще всего происходит из-за несоблюдения графика приема лекарств;
- Ложная констатация выздоровления: вирус может маскироваться на фоне других проблем со здоровьем.
В большинстве случаев болезнь возвращается через 50 дней после излечения. Инкубационный период составляет полтора месяца, после чего можно диагностировать болезнь. Стоит отметить, что если рецидив фиксируется через полтора месяца, то это говорит о том, что излечение было поставлено не верно. Слишком мала вероятность повторного заражения в день выздоровления.
Лечение рецидива гепатита: основные моменты
Кто подвержен осложнениям? Стоит отметить, что в определенной мере в зоне риска может находится каждый. Фиксируется рецидив после курса софосбувира, также и после интерферона. В случае возврата заболевания врач назначает повторный курс. Это может быть продление приема уже назначенных медикаментов или применение других.
Дополнительно могут быть назначены следующие лекарственные средства:
- Гепатопротекторы для защиты клеток печени, которые поддерживают работоспособность органа;
- Сорбенты для выведения токсинов из организма;
- Витаминно-минеральные комплексы для поддержания и укрепления иммунной системы.
Вышеперечисленные лекарства должен назначать профильный специалист. Самостоятельно ничего предпринимать при таком серьезном диагнозе не стоит.
Схемы лечения повторной инфекции могут быть теми же, что и в первый раз. Врач может изменить дозировку или предложить другие противовирусные препараты. Почему может быть произведена замена лекарств? Дело в том, что определенные генотипы тяжелее отвечают на прием медикаментов, поскольку обладают устойчивостью к противовирусным. Сегодня могут быть назначены:
- Софосбувир;
- Даклатасвир;
- Ледипасвир;
- Велпатасвир;
- Рибавирин.
В каким комбинациях уже определяет врач в зависимости от конкретно поставленного диагноза.
Если случился рецидив гепатита С после лечения интерферонами, то повторно они не назначаются. Их прием вызывает тяжелые побочные реакции, поэтому многие врачи не используют их в своей практике.
В некоторых случаях требуется лечение осложнений и сопутствующих патологий. При таких обстоятельствах могут возникнуть сложности:
- Повторное лечение сложное, потому что после первого курса организм ослаблен. Иной раз организм не имеет достаточно сил для очередной борьбы с вирусом.
- Наличие сразу 2-х генотипов может спровоцировать нарушение работы печени, что приведет к циррозу. Повторная терапия может стать причиной нарушения работы почек.
- Рецидив может стать причиной развития фиброза, стеатоза или злокачественного новообразования.
Перелечивание гепатита С после приема софосбувира или других противовирусных средств – это сложная работа, которой должен заниматься профессионал.
Препараты из Индии для лечения ВГС: на что можно рассчитывать?
Эффективное лечение рецидива гепатита С может быть организовано только под чутким руководством врача. В настоящее время особенной популярностью пользуются индийские дженерики. Они могут быть использованы даже в тех случаях, когда интерферон и рибавирин не помогли справится с вирусным заболеванием.
Лечение дженериками рассчитано на 12 или 24 недели. Врач назначает сдачу анализов спустя несколько недель ПВТ гепатита С для того, чтобы посмотреть, как организм реагирует на выбранную стратегию борьбы с ХГС. Важно контролировать терапию для того, чтобы вовремя среагировать на происходящие в организме изменения.
К сожалению, защитить себя на все 100% от повторного заражения вирусом нельзя. После излечения важно соблюдать меры профилактики для исключения повторной встречи со своим «врагом».
Несмотря на то, что лекарства от гепатита С уже найдены, он все также представляет собой опасность для человечества. При необходимости купить софосбувир, даклатасвир или другие дженерики, можно воспользоваться услугами нашей компании. Также на нашем сайте находятся в свободном доступе схемы лечения гепатита С, рекомендованные EASL.
Результат лечения вируса гепатита Ц во многом зависит о самого больного. Хотите победить болезнь? Активизируйте все свои силы и возможности, тогда непременно все получится!
Рецидив гепатита С после лечения Софосбувиром, причины повторного обострения болезни
Гепатит С является самым коварным недугом, поражающим печень, поскольку сопровождается долгим скрытым периодом и опасными осложнениями. Софосбувир относится к категории новейших противовирусных препаратов, широко используемых в лечении этого заболевания с 2013 года.
По сравнению с предыдущими классами аналогичных медикаментов, он показывает высокую безопасность и эффективность – от 80 до 100% в зависимости от тяжести течения болезни, генотипа вируса, сопутствующих недугов.
Однако рецидив гепатита С после лечения Софосбувиром иногда все же случается.
Софосбувир
Проявления рецидива
При повторном инфицировании гепатитом С наблюдаются те же симптомы, что и первоначально:
Слабость
- утомляемость, нервозность, слабость;
- тошнота, рвота, абдоминальные боли, диарея или запор, плохой аппетит;
- субфебрильные значения температуры тела;
- желтушность кожи, склер, слизистых;
- обесцвечивание каловых масс, потемнение урины;
- увеличение печени в размерах.
Рецидив гепатита С после Софосбувира, то есть повторное заражение, протекает в более тяжелой форме. Обострение заболевания связано с ослаблением организма после борьбы с первоначальным возбудителем.
Рецидивирующий гепатит С грозит развитием следующих осложнений:
- Фиброз печени. При недуге наблюдается замещение тканей органа соединительной рубцовой, в результате чего нарушается его функция.
- Гломерулонефрит. Представляет собой поражение почек, ведущее к формированию почечной недостаточности.
- Жировой гепатоз. Обратимая патология, которая сопровождается заменой гепатоцитов на жировые клетки. Может приводить к фиброзу и циррозу печени.
- Онкология. Наличие злокачественных новообразований в органе с плохим прогнозом в случае несвоевременного лечения.
- Неврологические расстройства. Сюда относятся депрессии, ухудшения памяти, внимания и умственной работоспособности.
Онкология
Терапевтические процедуры
В случае если гепатит С снова диагностируется у того же человека, назначается повторный курс лечения Софосбувиром или другим противовирусным препаратом. Длительность приема медикамента обычно увеличивается по сравнению с первым разом. Лечить пациента продолжают с учетом тяжести недуга, генотипа вируса, индивидуальных особенностей.
Помимо Софосбувира или других противовирусных средств, направленных на подавление возбудителя гепатита С, назначаются также:
- гепатопротекторы – препараты, останавливающие разрушение клеток печени и способствующие их восстановлению;
- сорбенты для выведения токсинов и устранения признаков интоксикации, иногда назначают совместный прием антибактериальных препаратов, которые призваны блокировать всасывание токсинов кишечником;
- кислота урсодезоксихолевая, чье действие помогает нормализировать уровень билирубина и справиться с неприятными симптомами;
- поливитамины, включающие в себя фолиевую кислоту, витамины С, Е, группы В для поддержания и укрепления иммунитета.
Поливитамины
Обязательной частью лечения гепатита С является соблюдение диеты №5 по Певзнеру для того, чтобы максимально разгрузить печень и насытить организм необходимыми витаминами и микроэлементами. Она предусматривает дробное питание около 5 раз в день.
Уменьшается процент жира, соли в рационе, исключаются продукты, провоцирующие брожение и гнилостные процессы в кишечнике, копченые, консервированные, слишком холодные или горячие блюда, алкоголь.
В основе питания должны лежать нежирные сорта мяса и рыбы, крупы, овощи и фрукты, молочные продукты, каши.
Профилактические действия
Для недопущения развития рецидива гепатита С после лечения Софосбувиром необходимо соблюдать меры предосторожности:
- предохраняться барьерными методами контрацепции при интимных контактах;
- перед проведением травмоопасных процедур необходимо убедиться в том, что используются одноразовые или хорошо простерилизованные инструменты;
- пользоваться услугами надежных стоматологических клиник и салонов красоты;
- исключить многократное использование шприцев;
- избегать контактов с биологическими жидкостями инфицированных людей;
- пользоваться индивидуальными гигиеническими и другими личными принадлежностями (щетками для чистки зубов, ножницами, бритвами).
Исключить многократное использование шприцев
Поскольку после прохождения курса лечения гепатита С организм пациента ослаблен, для снижения вероятности повторного инфицирования необходимо придерживаться таких профилактических рекомендаций, как соблюдение режима умеренных физических нагрузок, диеты для восстановления работы пищеварительного тракта, отказ от алкоголя.
Причины рецидива
Если гепатит С вернулся после лечения Софосбувиром, этому могут служить такие причины:
- Генотип болезни.
- Проблемы с печенью.
- Неправильная терапия.
- Климакс.
- Лишний вес.
- Несоблюдение профилактики.
- Сахарный диабет.
- СПИД.
При наличии таких факторов можно ожидать рецидива болезни. В этом случае надо продлить лечение и изменить дозу или лекарство на более современные аналоги.
При рецидиве заболевание проявляется такими симптомами:
- Печень ноет и болит.
- Раздраженность, усталость, нарушения работы ЖКТ.
- Ладони становятся красными.
- Окрашивание кожи и видимых слизистых оболочек в желтый цвет.
Если после выздоровления появились подобные симптомы, необходимо сдать анализы и при их положительном результате пройти повторную схему лечения.
Возвращение вируса напрямую зависит то того, как пациент будет питаться и жить после терапии, так как он может заразиться уже другим штампом вируса.
Помимо этого, есть факторы, которые человек порой не может контролировать, но они становятся причиной заражения:
- процедуры маникюра, педикюра, пирсинга, татуировок (невозможно проверить стерильность инструментов);
- посещение стоматолога;
- во время переливания крови;
- секс без предохранения.
После излечения людям рекомендуют сдавать анализ раз в 3 месяца. Это позволяет обнаружить рецидив на раннем этапе. Однако, при обнаружении ранее описанных симптомов, надо срочно обращаться к врачу, чтобы не пропустить момент.
ОСОБЕННОСТИ ЛЕЧЕНИЯ ГЕПАТИТА С ПОСЛЕ РЕЦИДИВА
Все о причинах рецидива при заболевании и способах решения проблемы
С позиции современных знаний рецидив вируса после лечения гепатита с представляет собой непростую клиническую задачу, которая требует всестороннего анализа, поиска причин рецидива HCV и принятия решения о повторном лечении гепатита (перелечивании). Чаще всего рецидив HCV-инфекции возникает в течение первых 3-12 месяцев (12-48 недель) после окончания курса противовирусной терапии. Срок возникновения рецидива не зависит от того чем пациент лечился, устаревшими режимами на основе интерферона-альфа или самыми современными безинтерфероновыми препаратами. В то же время рецидивы HCV после лечения интерфероном и рибавирином возникают чаще чем после безинтерфероновой терапии ингибиторами прямого противовирусного действия.
При контрольном вирусологическом обследовании после окончания курса противовирусной терапии РНК HCV в плазме крови у пациента не определяется. Однако через некоторое время, иногда через год после терапии, результаты анализа ПЦР вновь становятся положительными, в крови вновь повышается уровень активности АЛТ и могут вновь появиться явные симптомы и клинические признаки обострения гепатита. Иногда бывают случаи, когда рецидив HCV регистрируют только спустя много лет после окончания курса лечения. Подобные ситуации чаще всего связаны с развитием иммунодефицитных состояний, когда иммунная система перестает «контролировать» процесс размножения (репликации) вируса. Вирусная репликация при этом многократно усиливается и РНК HCV вновь появляется в крови.
О такой сложной клинической ситуации как рецидив гепатита с через несколько лет после лечения можно говорить в тех случаях, когда по результатам контрольного анализа ПЦР после длительной авиремии в плазме крови повторно обнаруживают виремию РНК HCV. Рецидив виремии может сочетаться с повышением уровня активности АЛТ в крови и появлением характерных клинических симптомов. В части случаев никаких клинических симптомов и гиперферментемии АЛТ вообще не бывает. Однако в любом случае возврат вируса гепатита с и виремию следует рассматривать в качестве неблагоприятного состояния, которое требует повторного противовирусного лечения с целью предотвратить цирроз и рак печени, а также различные тяжелые системные лимфопролиферативные и аутоиммунные заболевания.
Многие пациенты с HCV-инфекцией, у которых удается достичь УВО (устойчивый вирусологический ответ) после успешной безинтерфероновой терапии оригинальными препаратами или дженериками нередко задают вопрос о том может ли алкоголь спровоцировать возврат гепатита с и через какое время после окончания курса лечения это может случиться. Ответ на данный вопрос довольно прост. Алкоголь не является «стимулятором» процесса вирусной репликации и поэтому не может стать причиной рецидива даже в том случае, если после лечения гепатит С «перешел» в незаметную вирус HCV остался в организме и «затаился» глубоко в клетках печени гепатоцитах и иммунных клетках крови В-лимфоцитах. оккультную форму,
Ответ на другой часто задаваемый вопрос … возможен ли рецидив гепатита с после лечения, к сожалению, утвердительный. Рецидив гепатита свидетельствует о том, что сразу после лечения вирус HCV на какое-то время «спрятался» в гепатоцитах и В-лимфоцитах и затем в результате действия той или иной причины вновь стал активно размножаться.
Рецидив после софосбувира и даклатасвира
Очень неприятной ситуацией для пациента и врача-гепатолога является рецидив после софосбувира и даклатасвира, который отличается тем, что у вируса HCV на фоне терапии этими двумя ингибиторами, скорее всего, возникли мутации лекарственной устойчивости к этим ингибиторам и для эффективного перелечивания HCV-инфекции у пациента-неудачника потребуются уже не два, а три более мощных ингибитора следующих поколений (см. ниже итоговые рекомендации по лечению рецидива HCV).
Перелечивание гепатита С
17.08.2020
ОСОБЕННОСТИ ЛЕЧЕНИЯ ГЕПАТИТА С ПОСЛЕ РЕЦИДИВА
Все о причинах рецидива при заболевании и способах решения проблемы
С позиции современных знаний рецидив вируса после лечения гепатита с представляет собой непростую клиническую задачу, которая требует всестороннего анализа, поиска причин рецидива HCV и принятия решения о повторном лечении гепатита (перелечивании). Чаще всего рецидив HCV-инфекции возникает в течение первых 3-12 месяцев (12-48 недель) после окончания курса противовирусной терапии. Срок возникновения рецидива не зависит от того чем пациент лечился, устаревшими режимами на основе интерферона-альфа или самыми современными безинтерфероновыми препаратами. В то же время рецидивы HCV после лечения интерфероном и рибавирином возникают чаще чем после безинтерфероновой терапии ингибиторами прямого противовирусного действия.
При контрольном вирусологическом обследовании после окончания курса противовирусной терапии РНК HCV в плазме крови у пациента не определяется. Однако через некоторое время, иногда через год после терапии, результаты анализа ПЦР вновь становятся положительными, в крови вновь повышается уровень активности АЛТ и могут вновь появиться явные симптомы и клинические признаки обострения гепатита. Иногда бывают случаи, когда рецидив HCV регистрируют только спустя много лет после окончания курса лечения. Подобные ситуации чаще всего связаны с развитием иммунодефицитных состояний, когда иммунная система перестает «контролировать» процесс размножения (репликации) вируса. Вирусная репликация при этом многократно усиливается и РНК HCV вновь появляется в крови.
О такой сложной клинической ситуации как рецидив гепатита с через несколько лет после лечения можно говорить в тех случаях, когда по результатам контрольного анализа ПЦР после длительной авиремии в плазме крови повторно обнаруживают виремию РНК HCV. Рецидив виремии может сочетаться с повышением уровня активности АЛТ в крови и появлением характерных клинических симптомов. В части случаев никаких клинических симптомов и гиперферментемии АЛТ вообще не бывает. Однако в любом случае возврат вируса гепатита с и виремию следует рассматривать в качестве неблагоприятного состояния, которое требует повторного противовирусного лечения с целью предотвратить цирроз и рак печени, а также различные тяжелые системные лимфопролиферативные и аутоиммунные заболевания.
Многие пациенты с HCV-инфекцией, у которых удается достичь УВО (устойчивый вирусологический ответ) после успешной безинтерфероновой терапии оригинальными препаратами или дженериками нередко задают вопрос о том может ли алкоголь спровоцировать возврат гепатита с и через какое время после окончания курса лечения это может случиться. Ответ на данный вопрос довольно прост. Алкоголь не является «стимулятором» процесса вирусной репликации и поэтому не может стать причиной рецидива даже в том случае, если после лечения гепатит С «перешел» в незаметную оккультную форму, вирус HCV остался в организме и «затаился» глубоко в клетках печени гепатоцитах и иммунных клетках крови В-лимфоцитах.
Ответ на другой часто задаваемый вопрос … возможен ли рецидив гепатита с после лечения, к сожалению, утвердительный. Рецидив гепатита свидетельствует о том, что сразу после лечения вирус HCV на какое-то время «спрятался» в гепатоцитах и В-лимфоцитах и затем в результате действия той или иной причины вновь стал активно размножаться.
Причины возврата гепатита С после лечения
Наиболее часто встречающиеся причины рецидива гепатита с хорошо известны многим пациентам и практикующим врачам-гепатологам. Эти причины давно установлены, их довольно много, но в числе наиболее значимых нужно выделить следующие:
- прием дженериков сомнительного происхождения, не очень высокого качества или с истекшим сроком годности;
- наличие у пациента сопутствующих гепатотропных «виремических» вирусных инфекций – HBV, HDV, HGV, CMV, TTV, которые «отвлекают на себя» внимание иммунной системы, не давая возможности сосредоточиться на борьбе с вирусом HCV;
- самолечение, отсутствие во время лечения лабораторного контроля и клинического контроля со стороны врача-гепатолога;
- досрочное прекращение курса лечения или недостаточная продолжительность курса лечения;
- неправильный выбор препаратов для лечения и режима терапии;
- далеко зашедшая стадия фиброзных изменений в печени или цирроз печени на момент начала лечения;
- наличие тяжелых внепеченочных проявлений HCV-инфекции, в первую очередь криоглобулинемии с полиорганными проявлениями, а также аутоиммунных, нефрологических, гематологических, ревматологических или лимфопролиферативных заболеваний;
- несоблюдение пациентом во время курса лечения строгих правил хранения и введения интерферона или правил приема рибавирина (например, полное прекращение приема рибавирина при появлении первых нежелательных явлений или побочных реакций);
- несоблюдение пациентом во время курса лечения строгих правил приема препаратов-ингибиторов;
- неоднократные пропуски приема лекарственных препаратов во время курса лечения;
- наличие у вируса HCV мутаций лекарственной устойчивости (резистентности), которые могут быть или «первичными», или возникшими на фоне приема препаратов-ингибиторов;
- несоблюдение пациентом во время курса лечения строгих правил контроля межлекарственных взаимодействий и лекарственной совместимости.
Вышеперечисленные причины рецидива HCV позволяют дать утвердительный ответ на вопрос может ли гепатит с вернуться, хорошо объясняют почему возвращается гепатит с после лечения и как этого можно избежать. На самом деле возврат гепатита с после пвт (противовирусной терапии) это нередко встречающаяся в клинической практике ситуация, особенно в тех случаях, если пациенты занимаются бесконтрольным самолечением, не соблюдают правила приема лекарственных препаратов или в качестве препаратов для противовирусной терапии принимают дженерики сомнительной репутации и не очень высокого качества. Поэтому всем пациентам с HCV-инфекцией, которые начинают курс лечения гепатита С, следует знать о том, что возврат гепатита с после дженериков более вероятен, чем после лечения оригинальными препаратами. При прочих равных условиях эффективность дженериков все-таки уступает эффективности оригинальных препаратов.
Рецидив гепатита С и лечение рецидива
Эффективное лечение рецидива гепатита с гарантией достижения УВО (устойчивого вирусологического ответа) после повторного курса лечения всегда представляет определенные трудности для пациента и врача-гепатолога. Необходим правильный выбор конкретного режима повторного лечения (перелечивания), который зависит от генотипа/субтипа HCV, характеристики противовирусных лекарственных препаратов, которыми пациент неудачно лечился и стадии фиброзных изменений в печени.
Всех пациентов с рецидивом гепатита С в зависимости от стадии фиброза условно разделяют на 3 группы:
- 1-я группа – это пациенты с F0, F1, F2 и F3 стадиями фиброза, у которых для повторного лечения HCV можно применять короткий 8-ми недельный курс двух новых ингибиторов glecaprevir/pibrentasvir (оригинальная торговая марка «Мавирет»);
- 2-я группа – это пациенты с F4 стадией фиброза (то есть с компенсированным циррозом печени класса Child-A не более 6 баллов по шкале Child-Pugh); лечение рецидива гепатита С у таких пациентов представляет определенные трудности и требует сопровождения опытного врача-гепатолога;
- 3-я группа – это пациенты с субкомпенсированным циррозом печени класса Child-B (7-9 баллов по шкале Child-Pugh) и декомпенсированным циррозом печени класса Child-C (10-15 баллов по шкале Child-Pugh); повторное лечение HCV у таких пациентов является чрезвычайно трудной задачей и требует слаженных действий команды врачей нескольких специальностей.
Перелечивание гепатита и лечение рецидива HCV у пациентов, получавших «простые» режимы интерферон с рибавирином и/или софосбувир с рибавирином
Лечение рецидива HCV после любого из трех «простых» режимов противовирусной терапии …
- Peg_IFN-alfa + RBV_ribavirin
- Peg_IFN-alfa + RBV_ribavirin + SOF_sofosbuvir
- SOF_sofosbuvir + RBV_ribavirin
… является не очень сложной клинической задачей и подробно описано в общих рекомендациях EASL. В клинике ЭКСКЛЮЗИВ для повторного лечения HCV у таких пациентов успешно применяют различные по составу и продолжительности безинтерфероновые режимы, которые подробно представлены на сайте здесь.
Лечение рецидива HCV и повторное лечение гепатита у пациентов, получавших ингибиторы NS3/4A и/или NS5A
Значительно более трудной клинической задачей по сравнению с предыдущей представляется лечение рецидива гепатита С у пациентов, не достигших УВО после различных комбинированных безинтерфероновых режимов, в состав которых входили те или иные ингибиторы протеазы NS3/4A 1-го и 2-го поколений и/или ингибиторы NS5A 1-го поколения, такие как:
- ингибиторы сериновой протеазы NS3/4A – Telaprevir (препарат 1-го поколения «Инсиво»), Boceprevir (препарат 1-го поколения «Виктрелис»), Simeprevir (препарат 2-го поколения «Олисио»), Asunaprevir (препарат 2-го поколения «Сунвепра»), Paritaprevir (препарат 2-го поколения, входит в состав 3D-режима «Викейра Пак»);
- ингибиторы репликазы NS5A – Ledipasvir (препарат 1-го поколения, входит в состав 2D-режима «Харвони»), Daclatasvir (препарат 1-го поколения, входит в состав 2D-режимов «Даклинза» + «Сунвепра» и «Даклинза» + «Совальди»), Ombitasvir (препарат 1-го поколения, входит в состав 3D-режима «Викейра Пак»).
Несколько групп исследователей высказали предположение, что эффективность повторного лечения гепатита (рецидива HCV) у «пациентов-неудачников» может быть повышена при правильном подборе безинтерфероновых ингибиторов с учетом результатов определения мутаций лекарственной устойчивости, которые могут снижать восприимчивость вируса HCV к соответствующему классу ингибиторов. Наиболее неблагоприятные мутации были выявлены у больных, которые получали безинтерфероновые режимы, но не достигли УВО. Однако до сих пор в клинической гепатологии так и не выработаны какие-либо определенные рекомендации по конкретным режимам перелечивания в зависимости от выявленных мутаций. Поэтому выбор наиболее оптимальной схемы повторного лечения пациентов с рецидивом HCV после безинтерфероновой терапии должен быть основан в первую очередь на установлении и анализе причин рецидива гепатита (см. выше), информации о применявшихся ингибиторах и клиническом опыте врача-гепатолога.
На сегодняшний день известны результаты первых двух многоцентровых клинических испытаний III фазы (POLARIS-I и POLARIS-IV), показавших безопасность и эффективность принципиально новой 12-ти недельной комбинации трех ингибиторов sofosbuvir (ингибитор NS5B 1-го поколения) + velpatasvir (ингибитор NS5A 2-го поколения) + voxilaprevir (ингибитор NS3/4A 3-го поколения) у пациентов, которые не достигли УВО после различных безинтерфероновых режимов, включавших те или иные ингибиторы протеазы NS3/4A 1-го и 2-го поколений и/или ингибиторы NS5A 1-го поколения.
В исследование POLARIS-I было включено 263 пациента с рецидивом HCV, в том числе 143 пациента с циррозом печени. С целью перелечивания эти пациенты в течение 12-ти недель получали тройную комбинацию sofosbuvir/velpatasvir/voxilaprevir. Итоговый показатель УВО составил 96% (253 из 263). В исследовании был зарегистрирован всего лишь один случай вирусологического прорыва во время курса перелечивания и 9 случаев повторного рецидива виремии HCV после его окончания. Показатель УВО у пациентов без цирроза печени составил 99% и был показательно выше, чем у пациентов с циррозом печени (93%).
Врачи-исследователи POLARIS-I особо отметили, что ни генотип HCV, ни профиль мутаций лекарственной устойчивости на момент начала курса повторного лечения не имели никакого влияния на конечный результат терапии у наблюдавшихся пациентов.
В параллельное исследование РOLARIS-IV было включено в общей сложности 333 пациента с рецидивом HCV. Всех пациентов разделили на 2 сопоставимые группы. В первую группу вошли 182 пациента (46% с циррозом печени), которые начали получать 12-ти недельную комбинацию трех ингибиторов sofosbuvir/velpatasvir/voxilaprevir (SOF/VEL/VOX). Во вторую группу включили 151 пациента (44% с циррозом печени), которые начали получать 12-ти недельную комбинацию двух ингибиторов sofosbuvir/velpatasvir (SOF/VEL). Итоговый показатель УВО в 3D-группе SOF/VEL/VOX составил 98% (178 из 182) и был достоверно выше итогового показателя УВО в 2D-группе SOF/VEL (всего лишь 90%, 136 из 151).
Врачи-исследователи POLARIS-IV также отметили, что ни генотип HCV, ни профиль мутаций лекарственной устойчивости на момент начала курса перелечивания не оказывали никакого влияния на конечный результат у больных, получавших новый безинтерфероновый 3D-режим тремя мощными ингибиторами SOF/VEL/VOX. Важно подчеркнуть, что у тех немногих пациентов, которые на этом режиме также испытали неудачу, не было обнаружено никаких мутаций лекарственной устойчивости ни перед началом курса лечения, ни при вирусологическом прорыве во время курса лечения, ни при рецидиве HCV после окончания курса лечения.
Результаты еще одного обсервационного исследования MAGELLAN-I по лечению «пациентов-неудачников» с рецидивом HCV после безинтерфероновых режимов, включавших различные ингибиторы NS5A 1-го поколения, показали недостаточную эффективность стандартного 12-ти недельного и пролонгированного 16-ти недельного двойного режима glecaprevir/pibrentasvir (GLE/PIB) в преодолении барьера вирусологической устойчивости у таких пациентов. Новая комбинация GLE/PIB включала в себя два новых ингибитора – glecaprevir/GLE (ингибитор протеазы NS3/4A 3-го поколения) и pibrentasvir/PIB (ингибитор NS5A 2-го поколения). Итоговый показатель УВО среди пациентов в исследовании MAGELLAN-I даже при 16-ти недельном режиме не превысил 80%, поэтому в настоящее время комбинация GLE/PIB («Maviret/Мавирет») не рекомендована к применению для повторного лечения пациентов с рецидивом HCV после безинтерфероновой терапии, содержавшей тот или иной ингибитор NS5A.
С учетом результатов исследований РOLARIS-I, POLARIS-IV и MAGELLAN было высказано предположение о том, что для перелечивания пациентов с рецидивом HCV после безинтерфероновой терапии, включавшей тот или иной ингибитор NS5A 1-го поколения может применяться 3D-комбинация из ингибиторов NS5B sofosbuvir/SOF, NS3/4А glecaprevir/GLE и NS5A pibrentasvir/PIB, поскольку новый ингибитор NS5A 2-го поколения pibrentasvir обладает более высокой противовирусной эффективностью и способностью преодолевать барьер вирусологической устойчивости, чем все другие известные ингибиторы NS5A. Тройная комбинация sofosbuvir + glecaprevir/pibrentasvir рассматривается в качестве альтернативы при перелечивании «трудных» пациентов со сложными мутациями лекарственной устойчивости в регионе NS5A и/или с прогрессирующими стадиями заболевания печени (кроме декомпенсированного цирроза класса Child-C), включая пациентов, испытавших несколько неудачных курсов лечения. Первый случай успешного перелечивания такого пациента с помощью 12-ти недельной 3D комбинации SOF + GLE/PIB в клинике ЭКСКЛЮЗИВ уже наблюдали и зарегистрировали.
Таким образом, на сегодняшний день для перелечивания самых сложных пациентов, не достигших УВО после первого курса безинтерфероновой терапии, в состав которой входили тот или иной ингибитор протеазы NS3/4A 2-го поколения (Simeprevir, Asunaprevir, Paritaprevir) и/или ингибитор NS5A 1-го поколения (Ledipasvir, Daclatasvir, Ombitasvir), рекомендованы две новые 12-ти недельные 3D-комбинации:
- sofosbuvir/velpatasvir/voxilaprevir (оригинальное торговое название «Vosevi»);
- sofosbuvir («Sovaldi») + glecaprevir/pibrentasvir («Mavyret», «Maviret»).
Перелечивание гепатита С после неудачной терапии Софосбувиром
Если случилась неприятная для пациента ситуация и гепатит С вернулся после окончания курса лечения препаратом софосбувир значит нужно принимать соответствующее решение и начинать повторный курс противовирусной терапии. Начинать повторное лечение можно в любое время вне зависимости от того, как давно был закончен предыдущий курс терапии.
Следует обратить особое внимание на такую неоднозначную клиническую задачу как рецидив после лечения софосбувиром. Данную ситуацию и прогноз эффективности повторного лечения следует рассматривать с двух сторон, с учетом того, в комбинации с какими препаратами пациент получал ингибитор NS5B софосбувир. Во-первых, это может быть рецидив HCV после двух «простых» режимов, в состав которых входил софосбувир (см. ниже):
- комбинированный режим «пегилированный IFN-альфа в сочетании с рибавирином и софосбувиром» (Peg_IFN-alfa + Ribavirin + Sofosbuvir);
- полностью безинтерфероновый режим «софосбувир в сочетании с рибавирином» (Sofosbuvir + Ribavirin).
Режимы перелечивания таких пациентов в клинике ЭКСКЛЮЗИВ представлены на сайте здесь.
Во-вторых, рецидив HCV может случиться после полностью безинтерфероновых комбинированных режимов, в состав которых кроме ингибитора NS5B софосбувира входил тот или иной ингибитор NS5A 1-го поколения, например, ледипасвир/ledipasvir (в составе комбинированного препарата «Харвони»), велпатасвир/velpatasvir (в составе комбинированного препарата «Эпклуза») или даклатасвир/daclatasvir (комбинация препаратов «Совальди» + «Даклинза»). Вирусологическая неудача после таких сложных безинтерфероновых схем требует перелечивания (повторного лечения) с помощью новых лекарственных режимов, в состав которых должны входить три мощных ингибитора. Самыми эффективными режимами перелечивания на сегодняшний день являются 12-ти недельные пангенотипные режимы «Восеви» («Vosevi») и «Мавирет» + «Совальди» («Maviret» + «Sovaldi»).
Возврат гепатита после софосбувира в последнее время регистрируют, к сожалению, все чаще. В большинстве случаев рецидив виремии РНК HCV происходит у пациентов, которые принимали сомнительного качества дженерик софосбувира, особенно в комбинации с препаратом рибавирин, или в тех случаях когда схема лечения на основе софосбувира не являлась оптимальной.
Рецидив после софосбувира и даклатасвира
Очень неприятной ситуацией для пациента и врача-гепатолога является рецидив после софосбувира и даклатасвира, который отличается тем, что у вируса HCV на фоне терапии этими двумя ингибиторами, скорее всего, возникли мутации лекарственной устойчивости к этим ингибиторам и для эффективного перелечивания HCV-инфекции у пациента-неудачника потребуются уже не два, а три более мощных ингибитора следующих поколений (см. ниже итоговые рекомендации по лечению рецидива HCV).
Рецидив гепатита С после лечения препаратом Харвони
С позиции современных знаний ситуацию когда вернулся вирус гепатита после Харвони, в состав которого входит ингибитор репликазы NS5A 1-го поколения ледипасвир/ledipasvir, нужно рассматривать как неудачу после безинтерферонового режима, содержавшего ингибитор NS5A.
Рецидив гепатита после курса Харвони требует перелечивания и назначения мощного 12-ти недельного безинтерферонового режима, включающего в свой состав три ингибитора, например:
- 3D-режим «Восеви» (ингибитор NS5B софосбувир + ингибитор NS5A велпатасвир + ингибитор NS3/4A воксилапревир в одной таблетке);
- комбинированный 3D-режим «Мавирет» + «Совальди» (соответственно, ингибитор NS3/4A глекапревир + ингибитор NS5A пибрентасвир в одной таблетке в комбинации с ингибитором NS5B софосбувиром).
Как лечить рецидив HCV после «Викейра Пак»
Ответ на вопрос: Может ли вернуться вирус гепатита С после лечения Викейра Пак, к сожалению, утвердительный. Но это бывает очень редко. По данным клиники ЭКСКЛЮЗИВ рецидив виремии РНК HCV зарегистрирован у 2% пациентов, которые получали 3D-режим «Викейра Пак».
Возврат вируса гепатита после лечения викейра пак является трудной клинической задачей для повторного лечения (перелечивания), так как комбинированный препарат «Викейра Пак» содержит в своем составе три ингибитора всех трех белков-ферментов (NS3/4A, NS5A и NS5B), которые играют важную роль на этапах процесса репликации HCV. Перелечивание пациентов с вирусологической неудачей в виде рецидива виремии РНК HCV после 3D-режима «Викейра Пак» представляется значительно более сложной задачей по сравнению с перелечиванием пациентов с неудачей после двойных 2D-режимов «Харвони» (LED/ледипасвир и SOF/софосбувир), «Эпклуза» (VEL/велпатасвир + SOF/софосбувир) или «Совальди» (SOF/софосбувир) + «Даклинза» (DAC/даклатасвир).
На сегодняшний день для эффективного перелечивания пациентов с неудачей после 3D-режима «Викейра Пак» рекомендованы два новых 3D-безинтерфероновых режима, в состав каждого из которых входят по 3 мощных ингибитора. Первый рекомендуемый режим перелечивания – это 12-ти недельная 3D-комбинация «Восеви» (SOF/софосбувир + VEL/велпатасвир + VOX/воксилапревир) в одной таблетке от фармацевтической компании Gilead Sciensis, Inc. Второй возможный режим перелечивания – это 12-ти недельная 3D-комбинация «Мавирет» (GLE/глекапревир и PIB/пибрентасвир) + «Совальди» (SOF/софосбувир) в разных таблетках от фармацевтических компаний AbbVie, Inc. и Gilead Sciensis, Inc.
Следует знать, что антитела к вирусу гепатита С после курса Викейра Пак будут сохраняться в организме и определяться в плазме крови в реакции ИФА (иммуноферментный анализ) в течение неопределенно длительного времени даже после успешного окончания курса терапии. Антитела к HCV при отсутствии виремии РНК HCV (иными словами при отрицательных результатах ПЦР) после окончания курса лечения свидетельствуют только лишь о том, что вирус HCV «оставил свой след» в организме в результате контакта с иммунной системой.
Возврат вируса HCV после лечения чаще всего происходит в течение первых 3-12 месяцев после окончания курса Викейра Пак или какого-либо иного курса противовирусной терапии. Такую ситуацию регистрируют не очень часто, обозначают специальным термином «рецидив виремии РНК HCV» и рассматривают как один из четырех возможных вариантов вирусологической неудачи, перечисленных ниже, а именно:
- отсутствие вирусологического ответа;
- частичный вирусологический ответ;
- «вирусологический прорыв» виремии РНК HCV во время курса терапии;
- рецидив виремии РНК HCV после окончания курса терапии.
Рецидив HCV и перелечивание гепатита у пациентов после неудачи «Мавирет»
Предварительные результаты продолжающегося клинического испытания 3D-комбинации sofosbuvir + glecaprevir/pibrentasvir («Совальди» + «Мавирет») были официально объявлены в самом начале 2018 г. Первых 23 пациентов, которые ранее не достигли УВО после 8-ми или 12-ти недельных курсов терапии в 2D-режиме GLE/glecaprevir и PIB/pibrentasvir, перелечивали усиленной рибавирином комбинацией sofosbuvir + glecaprevir/pibrentasvir + ribavirin в течение 12-ти (2 пациента) или 16-ти (21 пациент) недель. УВО зарегистрирован в 96% случаев (у 22 из 23 пациентов). У одного пациента повторно возник рецидив HCV после окончания курса перелечивания. Таким образом, 3D-комбинация SOF + GLE/PIB + RBV (три мощных ингибитора с добавлением рибавирина) показала высокую эффективность, хороший профиль безопасности и хорошую переносимость.
Есть обоснованные предположения, что у особо «трудных» для перелечивания пациентов, которые ранее получали безинтерфероновую терапию, включавшую тот или иной ингибитор NS5A 1-го поколения, комбинированные 3D-режимы sofosbuvir/velpatasvir/voxilaprevir и sofosbuvir + glecaprevir/pibrentasvir могут быть эффективны даже без добавления рибавирина и/или увеличения продолжительности курса лечения до 16-24 недель. Однако пока нет никаких убедительных данных, чтобы поддержать эти показания, которые должны быть отдельно рассмотрены и решены командами опытных врачей-гепатологов с учетом многих клинических параметров на момент начала курса перелечивания. Необходимо обязательно учитывать стадию и характер хронического заболевания печени, наличие внепеченочных проявлений HCV, например, криоглобулинемию, информацию о предыдущих неудачных курсах лечения и профиль мутаций лекарственной устойчивости. Также следует помнить, что наличие у пациента субкомпенсированного (класса Child-B) или декомпенсированного (класса Child-C) цирроза печени полностью исключает при повторном лечении HCV использование ингибиторов протеазы NS3/4A, но в то же время требует как можно более быстрого начала терапии.
Итоговые рекомендации по лечению рецидива HCV при возврате вируса гепатита С
Тестирование мутаций лекарственной устойчивости HCV в программе обследования перед началом курса повторного лечения у пациентов с возвратом вируса гепатита С после предыдущего лечения представляется полезным (но не обязательным) для выбора наиболее оптимального режима терапии и повышения вероятности успеха.
- Пациенты, у которых ранее не был достигнут УВО с помощью «простых» режимов Peg_IFN-alfa+RBV, Peg_IFN-alfa+RBV+SOF или SOF+RBV должны перелечиваться с учетом генотипа/субтипа HCV и стадии фиброза (цирроза) согласно общим рекомендациям, представленным на сайте здесь;
- Пациенты с хроническим HCV-гепатитом (фиброз F0-F3 ст.) или компенсированным HCV-циррозом печени класса Child-A, у которых ранее не был достигнут УВО после безинтерфероновой терапии, включавшей тот или иной ингибитор протеазы NS3/4A 2-го поколения и/или ингибитор NS5A 1-го поколения, должны получать 12-ти недельную тройную комбинацию sofosbuvir/velpatasvir/voxilaprevir в сопровождении опытного врача-гепатолога.
- off-label-use … Более «трудным» для повторного лечения пациентам с хроническим HCV-гепатитом в стадии «продвинутого» фиброза F3 или с компенсированным HCV-циррозом печени класса Child-A, у которых ранее не был достигнут УВО после безинтерфероновой терапии, включавшей тот или иной ингибитор протеазы NS3/4A 2-го поколения и/или ингибитор NS5A 1-го поколения и которые имеют предсказывающие факторы более низкой эффективности перелечивания (например, значимые мутации лекарственной устойчивости в регионе NS5A), можно на основе персонального решения и информированного согласия назначать 12-ти недельную тройную комбинацию sofosbuvir + glecaprevir/pibrentasvir в сопровождении опытного врача-гепатолога.
- off-label-use … У самых «трудных» для повторного лечения пациентов, которые ранее дважды не достигли УВО после повторных курсов безинтерфероновой терапии, включавшей тот или иной ингибитор протеазы NS3/4A 2-го поколения и/или ингибитор NS5A 1-го поколения и у которых выявлены мутации лекарственной устойчивости в регионе NS5A, может на основе персонального решения и информированного согласия и в сопровождении опытного врача-гепатолога быть применена 12-ти недельная тройная комбинация sofosbuvir/velpatasvir/voxilaprevir или sofosbuvir + glecaprevir/pibrentasvir с обязательным добавлением ribavirin в дозе 1.000 мг (при массе тела менее 75 кг) или 1.200 мг (при массе тела более 75 кг). В случае невозможности приема рибавирина продолжительность курса перелечивания у таких пациентов на основе отдельно принятого решения и информированного согласия должна быть увеличена до 16 или 24 недель.
- off-label-use … У пациентов с субкомпенсированным циррозом печени класса Child-B и декомпенсированным циррозом печени класса Child-C, которые ранее потерпели неудачу после безинтерферонового режима, включавшего тот или иной ингибитор протеазы NS3/4A 2-го поколения и/или ингибитор NS5A 1-го поколения, должно быть исключено повторное использование ингибиторов протеазы NS3/4A ввиду высокого риска декомпенсации цирроза и развития печеночной недостаточности. У таких сложных пациентов на основе персонального решения и информированного согласия и в сопровождении мультидисциплинарной команды врачей может быть применена 24-х недельная комбинация sofosbuvir + velpatasvir с добавлением ribavirin в дозе 1.000 мг (при массе тела менее 75 кг) или 1.200 мг (при массе тела более 75 кг).
Записаться к специалисту нашего центра
Записаться на прием к опытному врачу нашего многопрофильного медицинского центра для лечения или диагностики можно по телефону +7 (812) 570-80-80 ежедневно с 09.00 до 21.00 или онлайн здесь.
Горячая линия «Гепатит С»
Бесплатная консультация по телефону. Профессор Дмитрий Леонидович Сулима с 09:00 до 21:00 по МСК
Автор статьи

Врач гепатолог, доктор медицинских наук, руководитель специализированного отделения инновационной гепатологии