Хижий Е.А., Нафикова Г.Р., Пиратова Н.В.
Консультативно-диагностический центр «СервисМед», Санкт-Петербург.
Целью клинических исследований БАД «Зифлан» является оценка ее эффективности и безопасности в лечении больных среднего и пожилого возраста с желчнокаменной болезнью (ЖКБ).
Задачи исследования: изучить литолитический и побочные эффекты БАД «Зифлан» у больных старших возрастных групп с ЖКБ.
ДИЗАЙН ИССЛЕДОВАНИЯ
1. Тип исследования
Данное клиническое исследование проводилось по ограниченной программе как открытое, контролируемое.
2. Общее описание исследования
В исследовании приняли участие 22 больных, которые соответствовали критериям включения/исключения.
Пациенты получали исследуемое средство БАД «Зифлан» по 1 капсуле 3 раза в день во время еды в течение 2-х месяцев с перерывом в 10 дней между месячными курсами.
В процессе исследования каждый пациент проходил клинико-инструментальное обследование соответственно протоколу.
Эффективность и безопасность исследуемого средства оценивали по предлагаемой шкале (раздел «оценка переносимости исследуемого средства»).
КОНТИНГЕНТ И МЕТОДЫ ИССЛЕДОВАНИЯ
1. Критерии включения
- женщины и мужчины;
- возраст 45-75 лет;
- больные ЖКБ, подтверждённой УЗИ;
- способность пациента к адекватному сотрудничеству в процессе исследования.
2. Критерии исключения
- известная гиперчувствительность к бессмертнику песчаному;
- наличие конкрементов, заполняющих более 1/3 желчного пузыря;
- наличие конкрементов, превышающих 2 см в диаметре;
- рентгенопозитивные конкременты желчного пузыря;
- наличие выраженных часто повторяющихся болей в правом подреберье;
- наличие других признаков обострения хронического холецистита;
- острая сердечная недостаточность;
- острая почечная недостаточность;
- язвенная болезнь желудка и двенадцатиперстной кишки;
- недееспособность или ограниченная дееспособность;
- участие в любом другом клиническом исследовании.
3. Условия выбывания пациентов из исследования.
- индивидуальная непереносимость исследуемого средства;
- возникновение у пациента в ходе исследования тяжелых и/или неожиданных побочных явлений;
- значительное ухудшение общего состояния в период исследования;
- несоблюдение режима лечения исследуемым средством;
- отказ пациента от участия в исследовании.
4. Схема и методы обследования.
Для оценки эффективности больные проходили УЗИ брюшной полости до начала приёма исследуемого препарата и не позже чем через месяц после окончания приёма. Все данные обследования заносились в историю болезни и индивидуальную регистрационную карту больного.
ЛЕЧЕНИЕ
1. Схема лечения
БАД «Зифлан» назначали пациентам в соответствии с инструкцией, предоставленной фирмой-производителем в дозе 1 капсула 3 раза в день во время еды. Курс лечения составлял 2 месяца с перерывом в 10 дней между месячными курсами.
2. Сопутствующее лечение
Во время исследования все пациенты получали обычную терапию (гипотензивную, противодиабетическую и т.д.).
Все препараты, которые использовались для сопутствующей терапии (название, доза, способ приема, частота приема, дата начала и окончания терапии) вносились в историю болезни и индивидуальную регистрационную карту.
ОЦЕНКА ЭФФЕКТИВНОСТИ И ПЕРЕНОСИМОСТИ ПРЕПАРАТА
1. Оценка эффективности:
учитывались изменения в размерах конкрементов желчного пузыря по результатам УЗИ
2. Оценка переносимости исследуемого средства
Переносимость исследуемого средства оценивалась на основании субъективных симптомов и ощущений, которые сообщались пациентом, и объективных данных, полученных исследователем в процессе лечения.
Переносимость исследуемого средства оценивалась исследователем в баллах по следующей шкале:
1. — неудовлетворительная (нежелательный побочный эффект, который отрицательно влияет на состояние больного, что в свою очередь приводит к прекращению приема исследуемого средства);
2. — удовлетворительная (побочные эффекты, которые влияют на состояние организма, но не требуют отмены исследуемого средства);
3. — хорошая (побочные эффекты не отмечаются или незначительные побочные эффекты, которые не требуют отмены исследуемого средства).
ЭФФЕКТИВНОСТЬ И ПЕРЕНОСИМОСТЬ ИССЛЕДУЕМОГО СРЕДСТВА БАД «ЗИФЛАН».
1. Начальное клиническое состояние обследованных.
Начальное субъективное состояние обследованных характеризовалось наличием у 10-ти пациентов периодических (редких) болей в правом подреберье после погрешностей в диете или связанных с физической нагрузкой, 6 пациентов предъявляли жалобы на тошноту после нарушений питания.
На УЗИ у всех больных были выявлены конкременты желчного пузыря, у большинства (77 %) величиной от 10 мм до 20 мм. У 12 больных присутствовали УЗИ-признаки хронического панкреатита.
2. Динамика показателей под влиянием лечения.
2.1. Субъективные показатели
Опрос пациентов после двухмесячного курса приёма Зифлана выявил уменьшение количества больных, отмечающих периодические боли в правом подреберье и тошноту.
Таблица 1. Динамика выраженности жалоб больных на фоне приёма Зифлана.
|
Жалобы пациентов |
До лечения (n=22) |
После лечения (n=22) |
|
Кратковременные боли в правом подреберье |
10 (45,5%) |
2 (9%) |
|
— при нарушении питания |
9 (40,9%) |
2 (9%) |
|
— связанные с физической нагрузкой |
1 (4,5%) |
0 |
|
Тошнота |
6 (27,2%) |
0 |
После двухмесячного курса приёма Зифлана кратковременные боли в правом подреберье после погрешностей в диете наблюдались лишь у 2-х больных, жалоб на тошноту не предъявлял ни один больной. Причём установлено, что наибольшее субъективное улучшение самочувствия наблюдалось уже в течение первой недели приёма препарата.
2.2. Результаты инструментального обследования.
Уменьшение в размерах конкрементов желчного пузыря по результатам УЗИ наблюдалось у 82 % пациентов. Следует подчеркнуть, что почти у всех больных конкременты изначально были более 10 мм в диаметре. Не смотря на это, у одной пациентки наблюдалось полное растворение конкремента величиной 14 мм, а у пациента, имевшего в начале исследования камень желчного пузыря 19 мм, произошло уменьшение конкремента более чем в половину величины (до 9 мм).
У остальных больных конкременты уменьшились в диаметре на 1,5 4 мм. У 4-х пациентов уменьшения конкрементов не наблюдалось.
Таблица 2. Динамика размеров конкрементов желчного пузыря по результатам УЗИ после двухмесячного курса лечения БАД «Зифлан».
|
Изменение размеров конкрементов |
Количество пациентов |
|
Полное исчезновение |
1 (4,5%) |
|
Уменьшение более чем на 50% |
2 (9%) |
|
Уменьшение от 30% до 50% |
2 (9%) |
|
Уменьшение от 15% до 30% |
7 (31,8%) |
|
Уменьшение от 10% до 15% |
6 (27,3%) |
|
Без динамики |
4 (18,2%) |
УЗИ-признаки хронического панкреатита после курса приёма Зифлана сохранялись лишь у 27 % больных.
Переносимость препарата.
Каких либо значимых побочных эффектов при приёме препарата не отмечалось. Один пациент отметил незначительные боли в эпигастрии на 3-й неделе исследования, но связь этих болей с приёмом Зифлана сомнительна: больной считал, что боли возникли из-за погрешностей в диете: (употребление острой пищи). Боли купировались самостоятельно и не требовали специального лечения.
Приведённые данные свидетельствуют о безопасности использования БАД «Зифлан»
ВЫВОДЫ
Таким образом, данные клинических испытания показали, что БАД «Зифлан» обладает определенным литолитическим эффектом, кроме того «Зифлан» безопасен и удобен в использовании у пациентов среднего и старшего возраста. Однако короткий протокол исследований не дает определенного ответа, приводит ли БАД «Зифлан» к полному растворению конкрементов желчного пузыря, что требует дополнительно изучения. В ходе апробации не было выявлено побочных эффектов.
БАД «Зифлан» может быть рекомендован для применения больными ЖКБ в составе комплексной терапии (вне периода обострения хронического холецистита), которым по тем или иным причинам не рекомендовано оперативное лечение.
Над описанием клинического случая, представленного доктором
работали
литературный редактор
Юлия Липовская,
научный редактор
Сергей Федосов
Врач УЗИ
Cтаж — 21 год
Медицинский центр «Афло-центр» на Володарского
Поликлиника №7
Центр здоровых ног «Гермес»
Больница №8
Дата публикации 17 декабря 2021 г.Обновлено 17 декабря 2021
Вступление
В декабре 2017 года в поликлинику № 7 города Кирова обратилась женщина 32 лет. Она пришла сделать плановое ультразвуковое исследование (УЗИ) брюшной полости, так как около года назад у неё выявили желчнокаменную болезнь (ЖКБ).
Жалобы
Жалоб у пациентки не было. Каких-либо симптомов, в том числе связанных с желудочно-кишечным трактом (например, изжогу, горечь во рту или расстройство стула), она не отмечала
Несмотря на отсутствие жалоб, женщину беспокоило наличие камня в желчном пузыре.
Анамнез
Камень выявили случайно в конце 2016 года, когда впервые провели УЗИ брюшной полости без каких-либо показаний для этого.
Анамнез жизни у пациентки без особенностей. Вес нормальный, питается обычно. Наследственность по ЖКБ не отягощена.
Обследование
При осмотре и физикальном обследовании никаких отклонений от нормы не выявлено.
Показатели общего и биохимического анализов крови в пределах нормы: АЛТ — 23 Ед/л, АСТ — 28 Ед/л, общий билирубин — 12,5 мкмоль/л.
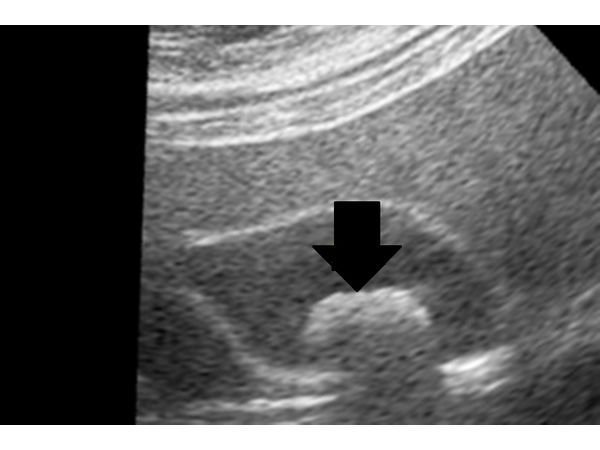
По данным УЗИ, размеры желчного пузыря 33×29×64 мм, толщина стенки до 3 мм. В желчном пузыре определяется подвижное однородное образование овальной формы с чётким, ровным контуром размером 14×16×19 мм (рис. 1). В других органах брюшной полости патологий не выявили.
На рентгенограмме желчного пузыря камень не обнаружили. Это указывает на то, что камень, вероятнее всего, холестериновый.
Диагноз
УЗИ от 23.12.2017. Камень желчного пузыря размерами 14×16×19 мм.
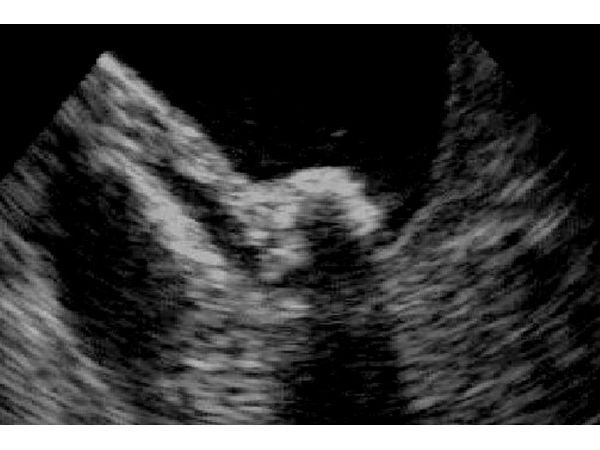
УЗИ от 19.09.2018. Камень желчного пузыря размерами 5×7×11 мм.
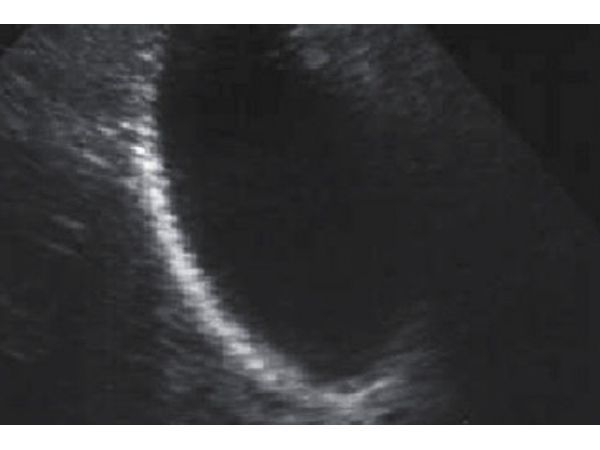
УЗИ от 12.03.2019 Желчный пузырь без признаков камня.
Лечение
Показаний для операции не было, так как болезнь никак себя не проявляла. Пациентке сообщили, что холестериновый камень можно пролечить урсодезоксихолевой кислотой и предупредили о возможных рецидивах ЖКБ после окончания курса терапии. Женщина согласилась на лечение.
Пациентка весила 67 кг, поэтому ей назначили 750 мг урсодезоксихолевой кислоты в сутки, т. е. три капсулы по 250 мг.
При применении урсодезоксихолевой кислоты более месяца в первые 3 месяца нужно контролировать уровень печёночных ферментов (АСТ и АЛТ), щелочной фосфатазы (ЩФ), гамма-глутамилтрансферазы (ГГТ) и билирубина в крови каждые 4 недели. Далее 1 раз в 3 месяца.
УЗИ желчного пузыря нужно делать 1 раз в 3 месяца. Промежуточное обследование необходимо, чтобы исключить обызвествление камней (отложение солей кальция). В случае обызвествления лечение следует прекратить.
По разным причинам контроль АЛТ, АСТ и билирубина у этой пациентки провели только в сентябре 2018 года. Анализы по-прежнему были в норме.
Контрольное УЗИ тоже сделали не в рекомендованные сроки, а только 19.09.2018. В динамике у камня в желчном пузыре были те же характеристики, но он приобрёл округлую форму и уменьшился до 5×7×11 мм, т. е. на 88 % (рис. 2).
Следующие контрольные исследования и биохимические анализы провели 12.03.2019. Лабораторные тесты были в норме. В желчном пузыре камней либо эхогенной взвеси выявлено не было (рис. 3). Пациентка по-прежнему ни на что не жаловалась, лечение она перенесла хорошо, побочных явлений не отмечала. Результатом лечения была довольна.
Заключение
Никогда нельзя полностью быть уверенным, что камень именно холестериновый. И даже в случае холестериновых камней нет гарантии, что терапия будет эффективной. В этом случае камень полностью растворился. Всего в моей практике за 4 года было четыре пациента, получавших урсодезоксихолевую кислоту по поводу ЖКБ: у двоих камни растворились полностью, у двоих терапия не подействовала.
Учёные утверждают, что урсодезоксихолевая кислота является гепатопротектором с относительно доказанной эффективностью, который хорошо себя зарекомендовал при лечении гепатозов и гепатитов. Поэтому его целесообразно назначать пациентам, у которых обнаружен холестериновый камень или есть показания к лечению неалкогольной жировой болезни печени.
Регистрационные данные биологически активной добавки Зифлан (капсулы 190±19 мг)
Содержание
- Группа
- Действие на организм
- Способ применения
- Условия хранения препарата
- Срок годности
- Отзывы
Группа
Действие на организм
Источник флавоноидов (в пересчете на лютеонин).
Способ применения
Взрослым по 1 капс. 3 раз в день во время еды. Продолжительность приема — 1 мес. При необходимости прием можно повторить. Противопоказания: индивидуальная непереносимость компонентов, беременность, кормление грудью.
Условия хранения препарата
В сухом, защищенном от света месте, при температуре не выше 25 °C.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Отзывы


или
! Сегодня
Зифлан для лечения больных с желчнокаменной болезнью
Исслелование действия БАД «Зифлан» при лечении желчнокаменной болезни ЖКБ у больных 45-75 лет.
Хижий Е.А., Нафикова Г.Р., Пиратова Н.В.
Консультативно-диагностический центр «СервисМед», Санкт-Петербург.
Целью клинического испытания БАД «Зифлан» является выяснение эффективности и безопасности препарата на основе экстракта бессмертнка песчаного Зифлана при лечении взрослых больных желчнокаменной болезнью (ЖКБ).
Задачи испытания: изучить литолитический и побочные эффекты Зифлана у больных старшего и среднего возраста с Желчекаменной болезнью.

Клиническое испытание Зифлана
Открытое и контролируемое клиническое исследование БАД «Зифлан» по ограниченной программе.
Описание клинического испытания:
Колличество больных желчекаменной болезнью ЖКБ, принявших участие — 22
Пациенты принимали исследуемый препарат БАД «Зифлан» по 1 капсуле 3 раза в день во время еды в течение 2-х месяцев с перерывом в 10 дней между месячными курсами.
В процессе клинического испытания Зифлана каждый больной прошел клинико-инструментальное обследование в соответствии с протоколом.
Эффективность и безопасность БАД «Зифлан» при лечении ЖКБ оценивали по предлагаемой шкале (раздел «оценка переносимости исследуемого средства»).
В клинических исследованиях эффективности Зифлана принимали участие женщины и мужчины возрастом от 45 до 75 лет больные желчекаменной болезнью, подтверждённой УЗИ.
К испытанию не допускались пациенты:
- с гиперчувствительностью к бессмертнику песчаному,
- с заполненностью жечлного пузыря камнями более чем на одну треть,
- с камнями желчного пузыря больше 20 мм в диаметре,
- с камнями желчного пузыря, видимыми на рентгеновском снимке,
- с часто повторяющимися болями в правом подреберье,
- с признаками обострения хронического холецистита,
- с острой сердечной недостаточностью,
- с острой почечной недостаточностью,
- с язвенной болезнью желудка и двенадцатиперстной кишки,
- с ограниченной дееспособностью.
Пациенты исключались из группы клинического испытания:
- при индивидуальной непереносимости Зифлана,
- при возникновении у пациентов неожиданных побочных явлений,
- при значительном ухудшении самочувствия в период испытания,
- при несоблюдении режима приема Зифлана,
- по желанию пациента.
Клиническое испытание заключалось в проведении УЗИ брюшной полости до начала курса лечения ЖКБ Зифланом и через 30 дней после окончания курса лечения.
Данные испытания регистрировались в истории болезни и в индивидуальной карте больного.
Лечение желчекаменной болезни БАД «Зифлан»:
Все препараты, которые использовались для сопутствующей терапии (название, доза, способ приема, частота приема, дата начала и окончания терапии) вносились в историю болезни и индивидуальную регистрационную карту.
-
Схема лечения:
БАД «Зифлан» назначали пациентам в соответствии с инструкцией, предоставленной фирмой-производителем в дозе 1 капсула 3 раза в день во время еды. Курс лечения составлял 2 месяца с перерывом в 10 дней между месячными курсами.
-
Сопутствующее лечение:
Во время исследования все пациенты получали обычную терапию (гипотензивную, противодиабетическую и т.д.).
Оценка эффективности и переносимости Зифлана при лечении ЖКБ
- Эффективность Зифлана оценивалась изменением размеров камней в желчном пузыре по результатам УЗИ.
-
Оценка переносимости Зифлана
Переносимость исследуемого средства оценивалась на основании субъективных симптомов и ощущений, которые сообщались пациентом, и объективных данных, полученных исследователем в процессе лечения.
Переносимость исследуемого средства оценивалась исследователем в баллах по следующей шкале:
- — неудовлетворительная (нежелательный побочный эффект, который отрицательно влияет на состояние больного, что в свою очередь приводит к прекращению приема исследуемого средства);
- — удовлетворительная (побочные эффекты, которые влияют на состояние организма, но не требуют отмены исследуемого средства);
- — хорошая (побочные эффекты не отмечаются или незначительные побочные эффекты, которые не требуют отмены исследуемого средства).
Эффективность и переносимость исследуемого средства БАД «ЗИФЛАН»
-
Начальное клиническое состояние пациентов:
редкие боли в правом подреберье после тяжелой пищи или физических нагрузок — 10 пациентов;
тошнота после нарушения питания — 6 пациентов.
-
Камни желчного пузыря на УЗИ у всех пациентов:
10-20 мм — 77% пациентов
хронический панкреатит — 12 больных.
-
Изменения после курса лечения ЖКБ Зифланом:
-
Субъективные показатели
После 2 месяцев приёма Зифлана пациенты отмечали уменьшение периодических болей в правом подреберье и тошноты. Только 2 пациента из 22 все ещё жаловались на боли в боку при нарушении питания, на тошноту не жаловался никто. Наибольшее улучшение самочувствия по мнению самих пациентов ощущалось в течение первой недели приёма Зифлана.
Таблица 1. Динамика выраженности жалоб больных на фоне приёма Зифлана.
Жалобы пациентов до лечения после лечения редкие боли в правом подреберье при нарушении питания 9 2 редкие боли в правом подреберье при физических нагрузках 1 0 тошнота 6 0 -
Результаты инструментального обследования.
У большей части пациетов (18 из 22) 82% камни желчного пузыря уменьшились на 10-100% по результатам УЗИ. Важно отметить, что до лечения камни желчного пузыря у пациентов были не менее 1 см. У одного пациента полностью растворился камень 14 мм, а у другого пациента камень желчного пузыря 19 мм уменьшился до 9 мм.
У четырех пациентов уменьшения камней в желчном пузыре не наблюдалось.
Таблица 2. Динамика размеров камней желчного пузыря по результатам УЗИ после 2 месяцев лечения БАД «Зифлан».
Изменение размеров камней Количество пациентов Полное исчезновение 100% 1 Уменьшение на более чем 50% 2 Уменьшение на 30-50% 2 Уменьшение на 15-30% 7 Уменьшение на 10-15% 6 без изменения 4 УЗИ-признаки хронического панкреатита после курса приёма Зифлана сохранялись лишь у 27 % больных.
-
Переносимость Зифлана
При приёме Зифлана значимых побочных эффектов не наблюдалось.У одного пациента возникли незначительные боли в эпигастрии на третьей неделе приёма после острой пищи. Боли прошли самостоятельно.
Клинические испытания показали безопасность использования БАД «Зифлан» для лечения ЖКБ.
ВЫВОДЫ
Таким образом, данные клинических испытания показали, что БАД «Зифлан» обладает определенным литолитическим эффектом, кроме того «Зифлан» безопасен и удобен в использовании у пациентов среднего и старшего возраста.
Однако короткий протокол исследований не дает определенного ответа, приводит ли БАД «Зифлан» к полному растворению камней желчного пузыря, что требует дополнительно изучения.
В ходе апробации Зифлана для лечения желчекаменной болезни не было выявлено побочных эффектов.

БАД «Зифлан» может быть рекомендован для применения больными ЖКБ в составе комплексной терапии (вне периода обострения хронического холецистита), которым по тем или иным причинам не рекомендовано оперативное лечение.